五个罗氏沼虾群体遗传多样性的微卫星分析
2020-12-10李景芬夏正龙蔡缪荧唐琼英高权新杨国梁
李景芬 夏正龙 栾 生 蔡缪荧 罗 坤 唐琼英 高权新 孔 杰 杨国梁,
(1. 湖州师范学院 浙江省水生生物资源养护与开发技术研究重点实验室, 中国水产科学研究院水生动物繁育与营养重点实验室, 湖州 313000; 2. 江苏数丰水产种业有限公司, 高邮 225654; 3. 中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室, 青岛 266071)
罗氏沼虾(Macrobrachium rosenbergii)又名马来西亚大虾、淡水长臂大虾, 是世界上最大的淡水经济虾类。原产于东南亚地区以及大洋洲北部和西太平洋岛屿[1]。我国于1976年从日本引进罗氏沼虾,此后, 它在中国沿海各省得到发展和推广。20世纪90年代, 随着大规模人工孵化和育苗技术的进步, 我国罗氏沼虾养殖业迅速发展, 已成为我国水产养殖业的主要品种之一[2]。到2009年, 我国连续10年成为世界第一的罗氏沼虾养殖大国[3]。2010—2018年,我国罗氏沼虾养殖产量除2013年为1.174×108kg, 其余各年产量均在1.2×108kg以上, 2013—2017年产量连年持续增长, 2017年产量达1.374×108kg[4]。但是,由于近交和有限的小群体繁殖, 使养殖品种遗传多样性减少, 出现种质退化, 表现为抗病力下降、生长缓慢和性成熟提早等现象, 已成为影响罗氏沼虾产量和经济效益的严重问题[5]。而遗传多样性与种群的生存能力、适应能力和进化潜力呈正相关, 是物种进化的基础[6]。因此, 研究现有罗氏沼虾种质资源的遗传多样性对罗氏沼虾种质资源的有效利用、改良养殖种群的经济性状、选育优良的新品种及研究种群的遗传结构等具有重要意义。
种群遗传分析已被证明是评价物种种群遗传多样性和获取遗传结构信息的最佳方法[7]。微卫星标记被认为是进行种群遗传分析最为有效的分子标记之一, 因其具有共显性、高突变率、遍布全基因组、易于评分和能够提供丰富的遗传信息等特
点而被广泛采用。因此, 在研究罗氏沼虾群体遗传多样性和种群结构方面, 微卫星标记也是被广泛采用的标记之一。国内外关于罗氏沼虾微卫星标记的开发[8—11]及利用微卫星标记研究其遗传变异的[12—17]已有一些报道。但是同时对来自4个国家的罗氏沼虾群体的研究却鲜有报道, 且这4个国家均普遍养殖罗氏沼虾。此外, 研究罗氏沼虾群体遗传变异的微卫星标记量大多在5—12个[12—17], 而戴习林等[17]研究显示: 当标记量5—25时, 等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)和期望杂合度(He)等遗传参数呈现上升趋势, 当标记量大于20时,各遗传多样性指数值已无显著性差异。鉴于此, 本研究采用16个微卫星标记, 对3个国外引进群体和2个本国养殖群体进行了遗传多样性分析, 以期为罗氏沼虾种质资源的开发利用和优良品种的选育提供参考数据。
1 材料与方法
1.1 实验材料
实验所用的罗氏沼虾分别来自泰国(CP)、孟加拉(BD)、缅甸(MN)和江苏数丰水产种业有限公司(MP和DP)。MP是一个不同家系的混养群, DP是一个扩繁群。CP 13尾, BD 15尾, MN 16尾, MP 74尾和DP 29尾, 每个个体剪取虾背部肌肉组织, 于无水乙醇中保存。
1.2 试验方法
取出无水乙醇固定的虾肉于1.5 mL离心管中,挥发干乙醇, 用小剪刀尽量剪碎, 加入裂解液和蛋白酶K混匀, 于55℃摇床中消化至溶液澄清透明。再向裂解液中加入RNase于37℃水浴锅中保温1h。然后按传统的酚、氯仿和异戊醇法提取基因组DNA。用0.8%的琼脂糖凝胶电泳检测DNA的纯度和完整性, 用紫外分光光度计检测质量浓度, 并稀释至50 ng/μL, 存于–20℃冰箱中备用。
引物详细信息见表 1, 引物均由武汉天一辉远基因科技有限公司合成。
PCR反应体系总体积25 μL: 10×Buffer 2.5 μL,dNTP 1 μL, 引物2 μL, 50 ng/μL DNA 2 μL, rTaq0.2 μL,ddH2O 17.3 μL。PCR扩增反应程序: 94℃预变性4min; 94℃变性30s, 54—65℃退火30s, 72℃延伸1min, 30个循环; 72℃延伸5min, 4℃终止延伸5min。
STR基因分型委托上海翼和应用生物技术有限公司完成。采用美国ABI公司的PRISM3730测序仪进行STR序列分析。
1.3 数据分析
每个个体的基因型通过STR基因分型确定, 根据等位基因的大小, 按照从小到大按字母排序。Na、Ne、Ho、He、Shannon指数(I)、Nei氏遗传距离和遗传相似度采用Popgene Version1.32软件计算;等位基因丰度(Ar)采用HP-Rare 1.0软件计算[18]; 多态信息含量(PIC)采用Cervus3.0软件计算。

表 1 罗氏沼虾16对微卫星引物信息Tab. 1 16 pairs of microsatellite primers of M. rosenbergii
群体间遗传分化指数(Fst)、群体分子方差分析(AMOVA)采用Arlequin 3.5软件进行[19]。系统树根据Nei氏遗传距离通过MEGA 5软件采用非加权配对算数平均法(UPGMA)构建[20], 群体遗传结构采用STRUCTURE 2.3.1软件分析[21]、最佳K值(理论群体数)和群体遗传结构图利用在线软件(http://clumpak.tau.ac.il/)得出。
2 结果
2.1 微卫星位点多态性及群体遗传多样性
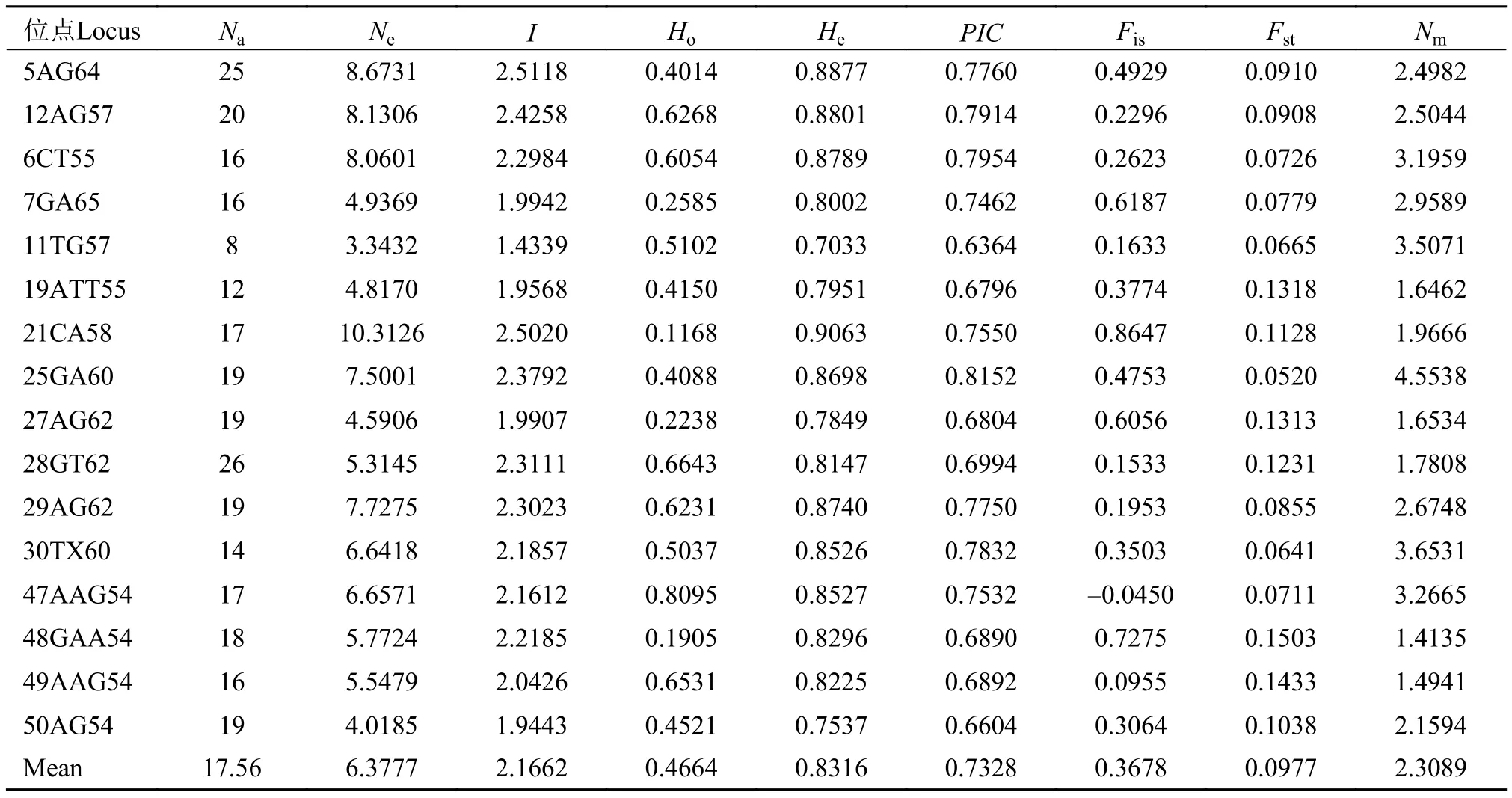
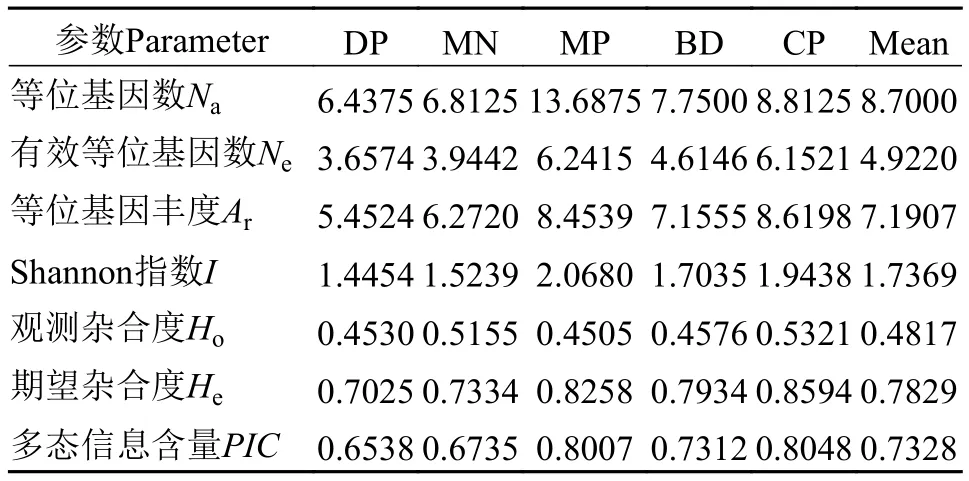
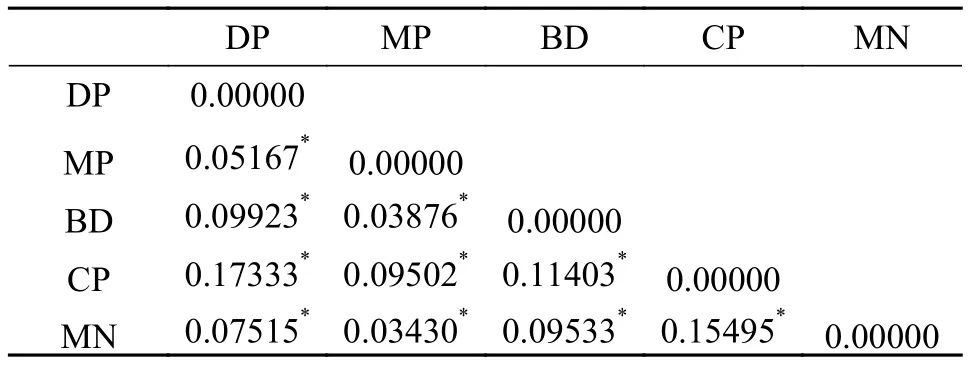
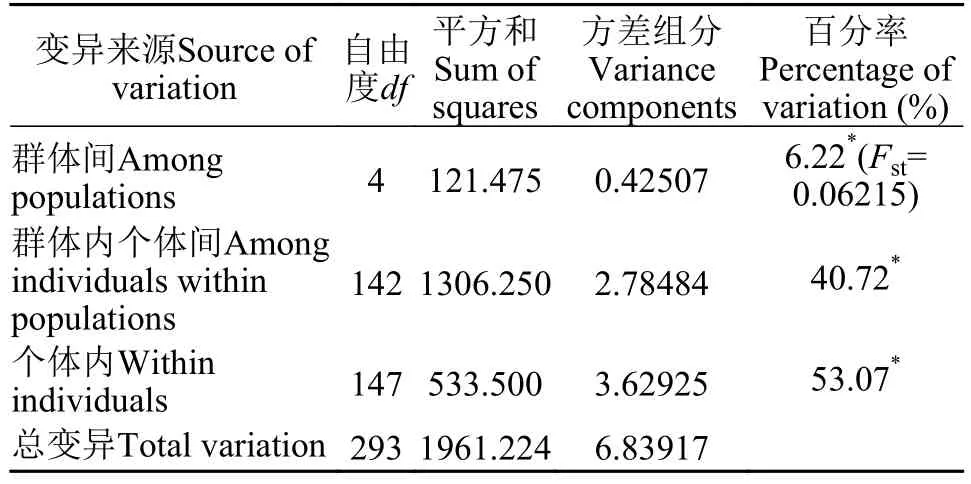
如表 2所示, 16个位点共检测出298个Na, 等位基因数介于8—26个, 每个位点平均有17个等位基因。Ne介于3.3432—10.3126, 平均值为6.3777个。I介于1.4339—2.5118, 平均值为2.1662。Ho介于0.1168—0.8095, 平均值为0.4664。He介于0.7033—0.9063, 平均值为0.8316。PIC介于0.6364—0.8152,平均值为0.7328。根据Botstein等[22]的标准,PIC≥0.5为高度多态性, 本研究中的16个位点均为高度多态性位点, 说明这些位点均可提供丰富的遗传信息,可用于罗氏沼虾群体遗传多样性的评估。F检验数据显示, 在16个位点中, 有1个位点的近交系数(Fis)值为负值, 其余15个位点为正值, 表明近交程度较高。16个位点遗传分化指数(Fst)的平均值为0.0977, 根据Wright[23]建议, 有1个位点遗传分化程度较大(Fst= 0.1503>0.15), 其余15个位点遗传分化程度中等(0.05 如表 3所示, DP群的Na(6.4375)、Ne(3.6574)、Ar(5.4524)、He(0.7025)、I(1.4454)和PIC(0.6538)均为最低, 而MP群的Na(13.6875)、Ne(6.2415)和I(2.0680)均为最高。MP群的Ho(0.4505)为最低, CP群的Ho(0.5321)、He(0.8594)、Ar(8.6198)和PIC(0.8048)为最高。所有群体的PIC均大于0.5, 表明群体的遗传多态性较高, 具有较大的选择潜力。5个群体的PIC从高到低排列依次为CP>MP>BD>MN>DP, 与各群体平均等位基因丰度(Ar)的大小顺序相吻合,更加说明CP群体具有较高的等位基因丰度, 而DP群体的等位基因丰度相对较低。 如表 4所示, 根据Wright[23]的建议, MP群体与MN群体之间的遗传分化水平最低(Fst=0.03430),MP群体与MN群体、与BD群体(Fst=0.03876)均属于低程度的遗传分化(Fst<0.05)。CP群体与DP群体之间的遗传分化水平最高(Fst=0.17333), CP群体与DP群体、与MN群体(Fst=0.15495)均属于较大程度的遗传分化(0.15 表 2 罗氏沼虾微卫星位点遗传多样性参数和基因流的估计Tab. 2 Genetic diversity parameters and the estimates of gene flow among 16 loci of M. rosenbergii 表 3 五个罗氏沼虾群体的遗传多样性Tab. 3 Genetic diversity of five populations of M. rosenbergii 表 4 五个罗氏沼虾群体间的遗传分化指数Tab. 4 Matrix of pair-wise Fst values between five populations of M. rosenbergii 如表 5所示, 群体间变异占总变异的6.22%, 且达到显著水平(P<0.05), 群体内个体间的变异占总变异的40.72%(P<0.05), 个体内部的遗传变异占总变异的53.07%(P<0.05)。这表明个体间的遗传变异远大于群体间的遗传变异, 遗传变异主要存在于个体间。Fst值为0.06215, 群体间有中等程度的遗传分化。 如表 6所示, 5个群体间的Nei氏遗传距离介于0.1823—1.4184。MN群体与CP群体间的Nei氏遗传距离最远(1.4184), 遗传相似度最低(0.2421)。MN群体与MP群体Nei氏遗传距离最近(0.1823), 遗传相似度最高(0.8334)。根据Nei氏遗传距离构建的UPGMA聚类树(图 1), MN群体首先与MP群体聚为一类, 再与DP群体聚为一类, 之后再与BD群体聚为一类, 最后与CP群体聚为一类。 本研究Length of Burn-in Period设置为100000,预设K值(理论群体数)为1—9, 每个K值重复运算10次。采用Evanno等[21]的方法进行分析计算, 得到最佳K值为5, 此时的DeltaK最大, 表明本研究中所有参试个体最佳可划分为5个理论群(图 2)。由图 2可知, DP、MN、BD、CP群体的个体遗传结构相对独立, 尤其是CP群体的个体, 而MP群体的个体遗传结构有一定程度的混杂, 且该群体的遗传组成多样化。 表 5 五个罗氏沼虾群体的分子方差分析Tab. 5 AMOVA analysis among five populations of M. rosenbergii 图 1 基于Nei’s遗传距离构建的5个罗氏沼虾群体的 UPGMA聚类树Fig. 1 UPGMA clustering tree of five populations of M. rosenbergii based on Nei’s genetic distance 图 2 罗氏沼虾群体在K=5下的遗传结构图Fig. 2 STRUCTURE genetic cluster analysis for the five populations of M. rosenbergii (K=5) 遗传多样性与物种的生存力、适应力和进化潜力密切相关, 是评估种群资源状况的重要依据[24]。等位基因数、杂合度、多态信息含量等遗传参数是反应群体遗传多样性的主要参数, 且与遗传多样性和基因丰度呈正相关[25,26]。但是, 在样本量差异较大时利用等位基因数来衡量遗传多样性是不准确的, 原因在于等位基因数量(等位基因丰度)高度依赖于样本的大小: 大样本比小样本包含更多的等位基因[27]。本研究中国外群体引种而来, 样本量较少, 为排除不同群体间较大样本量差异的影响, 采用HP-Rare软件实现对等位基因丰度的无偏估计,5个群体的Ar介于5.4524—8.6198。由于等位基因数(Na)依赖于样本大小的缺陷, 致使期望杂合度(He)更常用于衡量群体的遗传多样性[18]。本研究群体的He介于0.7025—0.8594, CP群体的He最高, 为0.8594, 与孙成飞等[16]的报道相比, 介于其泰国1(He=0.881)和泰国2(He=0.848)之间, 其他群体的He都低于孙成飞所报道群体的He(介于0.848—0.896); 与钟丹丹等[15]的报道相比, 其所研究的两个群体的He(0.7376和0.7609)处于本研究He的范围内; 与朱其建等[17]的报道(He介于0.5519—0.7332)相比, 本研究结果偏高; 与Schneider等[12]的报道(He介于0.5794—0.9356)相比, 本研究群体的He处于中等水平; 与Nguyen Thanh等[14]的报道(He介于0.785—0.835)相比, 本研究中的DP群和MN群的He略偏低, 其余群体的He与之基本一致。通过与他人研究结果比较发现, 本研究中群体的He处于中等水平。戴习林等[17]的研究也表明样本量与平均等位基因数和平均有效等位基因数呈高度正相关, 与杂合度呈中度相关。可以推知在样本含量足够的情况下, MN、BD和CP群体的等位基因数和杂合度会更高。Qin等[28]研究表明杂合度越高物种遗传多样性越丰富, 对环境的适应能力则越强。当群体杂合度在0.5—0.8即可认为具有较高的多样性[29], 当PIC>0.5即认为有高度多态性[22], 5个群体的平均PIC(0.7328)和平均期望杂合度(0.7829)均在0.7以上, 表明各研究群体的遗传多样性均处于较高水平, 说明这些群体种质资源良好、有一定的种群稳定性, 具有很大的选择潜力。 本研究中每个群体的Ne均小于Na, 王丰等[30]认为主要是等位基因在群体中分布不均, 导致某些等位基因的频率不够均匀。这说明本研究中各群体均存在等位基因分布不均匀的情况, 这种不均匀程度依次为MP>BD>MN>DP>CP。 遗传分化指数(Fst)是用来衡量群体间遗传分化程度的重要参数。5个罗氏沼虾群体间的Fst值介于0.03430—0.17333, 表明群体间均有不同程度的遗传分化。MP群与MN群(Fst=0.03430)、与BD群(Fst=0.03876)间遗传分化较小, 此结果与生产实际相符, MP群为家系的混养群, 缅甸家系的亲本就来源于MN群, 孟加拉家系亲本来源于BD群。除去MP群, 其余所有群体间均为中等和较大程度的遗传分化(0.07515≤Fst≤0.17333), 可能因为这些群体分属不同国家, 由于地域的限制, 基因交流较少, 而呈现出中等和较大程度的遗传分化。CP群与DP群和MP群间的Fst值分别为0.17333和0.09502, 分属较大和中等程度的遗传分化。系统树显示DP群和MP群最后与CP群聚为一支。这与孙成飞等[16]的研究结果基本一致, 中国和泰国罗氏沼虾群体间存在中等程度的遗传分化, 亲缘关系较远。基因流(Nm)就是基因在群体间的运动[31], 是引发群体内和群体间遗传变异的一个非常重要的来源[32]。Wright[33]认为当Nm大于1时可以抵制因遗传漂变造成的群体间遗传分化, 使群体间遗传分化程度降低。本研究中所有位点Nm均大于1, 其平均值为2.3089, 说明本研究中的5个群体不容易因遗传漂变而引起种群间的分化。 STRUCTURE软件是分析群体遗传结构的理想工具, 因该软件不受各群体样本量的影响, 是基于个体的遗传组成进行群体模拟分析的[21]。本研究所有个体被划分为5个理论群体, 图 2显示5个样本群基本独立成群, 该遗传结构图支持聚类结果。MP群是一个不同家系混养群, 故遗传结构图显示该群由多种遗传背景的个体构成, 有些个体的遗传成分混杂。该群中缅甸家系个体较多, 所以首先与MN群体聚为一类。DP群是亲虾扩繁群, 包含MP群的亲虾, 即MP群某些个体含DP群的血统, 且这些个体数量仅次于缅甸家系个体, 所以MP群与MN群聚为一支后再与DP群聚在一起。MP群中也包含孟加拉家系, 只是孟加拉家系个体稍少, 所以与DP群聚在一起后再与BD群聚在一起。因MP群中无泰国家系, 所以最后与CP群聚在一起。 综上所述, 本研究结果表明5个罗氏沼虾群体存在高度的遗传多样性, 说明这些群体种质资源状况良好、有一定的种群稳定性, 具有较大的选择潜力。中国群体与泰国群体亲缘关系较远。所获得的基于微卫星标记的罗氏沼虾的遗传数据丰富了罗氏沼虾的遗传信息, 对于制定行之有效的选育和保护策略有一定的参考价值。2.2 群体的遗传分化及遗传距离
2.3 群体遗传结构分析
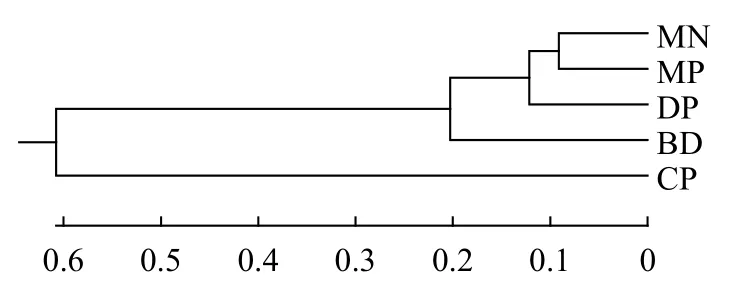
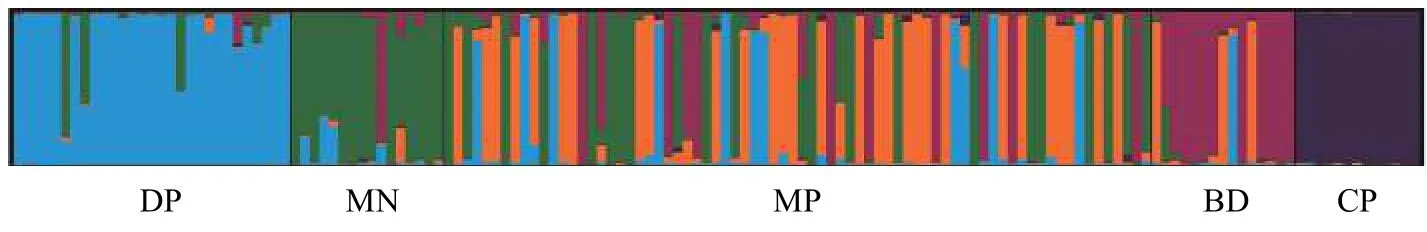
3 讨论
3.1 群体遗传多样性
3.2 群体遗传分化
3.3 群体遗传结构
