金鱼etv2基因的克隆及在雌核发育单倍体和自交二倍体胚胎中的差异表达
2020-12-10张琼宇胡海星唐云云罗湘玲孙远东
张琼宇 胡海星 唐云云 罗湘玲 孙远东
(1. 永州职业技术学院公共基础学部, 永州 425100; 2. 长沙环境保护职业技术学院环境科学系, 长沙 410004;3. 湖南科技大学生命科学学院, 湘潭 411201)
在脊椎动物胚胎发育过程中, 循环系统是最早建立并行使功能的器官系统之一。有效的血液循环为各组织器官提供了必需的氧气、营养物质、激素和代谢产物, 是胚胎生长发育和存活的前提[1]。
ETS转录因子家族成员都包含一个高度保守的DNA结合结构域, 即ETS结构域。它由约85个氨基酸残基组成, 能够特异性识别并结合含有GGAA/T的DNA核心序列从而调控基因的表达[2]。在脊椎动物胚胎发生过程中, 至少有13个ETS转录因子在造血或内皮细胞谱系中表达, 它们通过激活或抑制下游基因的表达在造血和血管发育过程中发挥重要作用[3,4]。其中, ETV2(Ets variant 2), 又称ER71/Etsrp, 是成血液血管干细胞(Hemangioblast)和内皮祖细胞最早表达的标志物之一[5,6]。etv2基因突变的小鼠(Mus musculus)由于造血和血管生成受阻而死于胚胎发育的第9.5天[5,7]。在斑马鱼(Danio rerio)胚胎中etv2突变或注射反义吗啡林寡核苷酸(Morpholino)敲降etv2可抑制所有已知血管内皮细胞标志基因的表达, 在受精后24h(24hpf)之前几乎没有血管内皮细胞和髓系细胞的分化[6,8,9]。在斑马鱼胚胎中, 过表达斑马鱼、人(Homo sapiens)源或鼠源etv2均可特异性上调成血液血管干细胞、血管内皮细胞和髓系细胞标记基因的表达, 促进血管内皮细胞和髓系细胞的生成[6,9,10]。此外, 在爪蟾(Xenopus tropicalis)胚胎中过表达etv2也出现类似结果[11]。这些研究结果表明ETV2的功能在不同脊椎动物胚胎中十分保守, 是造血和内皮细胞分化发育最早阶段所必需的转录因子。
在鱼类中, 采用人工诱导雌核发育或者雄核发育可获得只遗传母本或者父本基因组的单倍体个体[12]。各种人工诱导的鱼类单倍体在胚胎发育过程中绝大部分都呈现出“单倍体综合症”, 水肿、心血管畸形和循环障碍是其中的主要表现[13—16]。因此, 人工诱导的鱼类单倍体为研究脊椎动物循环系统发育的分子调控机制提供了独特的实验系统。目前, 有关鱼类单倍体循环系统发育异常的报道主要局限于形态描述, 尚未对其产生机制进行深入研究。金鱼(Carassius auratus)具有由隐性基因编码的双尾性状, 可以通过具有单尾显性性状的近缘鱼类遗传失活的精子刺激金鱼卵子进行雌核发育, 然后利用金鱼双尾的遗传性状在胚胎发育早期准确鉴定雌核发育单倍体胚胎[17,18]。故此, 我们选择金鱼为实验动物, 探究单倍体胚胎循环系统发育异常的分子机制。本研究克隆了金鱼etv2基因, 分析了其在胚胎和成体组织中的表达模式以及在雌核发育单倍体与自交二倍体早期胚胎发生中的表达差异。
1 材料与方法
1.1 实验动物和材料
金鱼红帽品系和雄性野生鲤(Cyprinus carpioL.)取自湖南省水产养殖实践教学示范中心。分离1龄金鱼性腺(卵巢或精巢)、脑、肾脏、肝脏、心脏、脾脏和肌肉等多种组织样品, 分别在液氮中快速冷冻后, 保存于–80℃冰箱备用。
1.2 金鱼雌核发育单倍体和自交二倍体胚胎的获得
金鱼繁殖季节, 用紫外线照射鲤精液, 完全破坏其遗传物质, 利用处理后的精子人工诱导金鱼成熟卵子的雌核发育, 得到雌核发育单倍体胚胎; 自交二倍体金鱼胚胎通过人工授精获得, 具体方法按先前的文献进行[18]。雌核发育单倍体和自交二倍体来自同一条雌鱼。金鱼受精卵于(20±0.5)℃孵育,受精后3—5min用0.25%的胰蛋白酶去膜。由于红帽金鱼具有编码双尾的隐性基因, 而鲤具有编码单尾的显性基因, 所以金鱼和鲤的杂合二倍体胚胎是单尾的, 而金鱼雌核发育单倍体是双尾的。如果鲤精子遗传物质未被紫外线破坏, 那么利用其使金鱼卵子受精所得胚胎为杂合二倍体, 在体节形成早期具有尾柄细长的单尾表型, 而不是尾柄短钝的双尾表型。根据这一表型特征, 即可通过体视镜观察将少量杂合二倍体胚胎从单倍体胚胎中剔除。所有金鱼雌核发育单倍体胚胎都在摄食期前死亡。
取不同发育时期的雌核发育单倍体和自交二倍体胚胎, 包括32细胞期、1K细胞期、尾芽期、6体节期、14体节期、20体节期、25% OVC (Otic vesicle closure, 耳囊闭合期)、35% OVC和96hpf,用于RNA提取或整胚原位杂交。
1.3 RNA提取和cDNA第一条链的获得
利用TRIzol(Invitrogen)分别提取金鱼各成体组织以及不同发育时期雌核发育单倍体和自交二倍体胚胎材料的总RNA。琼脂糖凝胶电泳和分光光度计测定RNA完整性和浓度。采用PrimeScript™RT reagent Kit with gDNA Eraser(TaKaRa)合成cDNA第一条链。
1.4 金鱼etv2编码区片段的克隆和全长cDNA序列的获得
利用鲤科鱼类的同源性, 根据GenBank中斑马鱼etv2/etsrp基因(DQ021472)编码区序列设计合成引物E-F和E-R(表 1), 以14体节期金鱼自交二倍体胚胎RNA逆转录所获得的cDNA为模板进行PCR扩增(图 1)。目的片段回收纯化后, 进行亚克隆和序列测定。使用NCBI网站(https://www.ncbi.nlm.nih.gov)中Blast功能对测序结果进行序列分析, 确认其是否为金鱼etv2基因的cDNA序列。

表 1 本研究所使用的PCR引物Tab. 1 Primers used in this study
根据已获得的部分etv2基因cDNA序列设计合成特异的3′-RACE和5′-RACE引物(表 1), 然后分别利用3′-Full RACE Core Set(TaKaRa)和SMART™RACE cDNA Amplification Kit(Clonetech)试剂盒扩增etv2基因的3′和5′序列(图 1), 具体操作按照说明书进行。PCR产物经回收、克隆和测序, 再与之前已获得的部分cDNA序列进行拼接即得到金鱼etv2基因的全长cDNA序列, 将所得序列提交至GenBank。
1.5 生物信息学分析
运用DNASTAR 7软件拼接金鱼etv2基因cDNA序列、确定开放阅读框并预测其编码氨基酸序列。Protparam tool(https://web.expasy.org/protparam/)预测蛋白分子量、等电点和各种氨基酸含量。利用SMART在线工具(http://smart.embl-heidelberg.de/)预测蛋白结构域。使用CLUSTAL Omega在线服务(https://www.ebi.ac.uk/Tools/msa/clustalo)和DNAMAN 5.0软件进行多序列比对。利用MEGA 7软件以邻近法 (Neighbor-joining)构建系统进化树。
1.6 RT-PCR和荧光实时定量PCR(qRT-PCR)分析etv2基因的表达
设计合成特异引物E-S和E-A(表 1), 利用半定量RT-PCR分析etv2在金鱼不同发育阶段以及不同器官组织中的表达情况。设计qRT-PCR引物ERS和E-RA(表 1)检测etv2的相对表达量。PCR反应及检测在ABI公司的Prism7500 Sequence Detection System上进行。为保证结果的准确性, 对每一种样品的分析都重复4次。反应条件为: 50℃ 2min;95℃ 10min; 95℃ 15s, 60℃ 45s, 40个循环。以金鱼β-actin作为内参基因,etv2基因的相对表达量采用Livak和Schmittgen[19]提出的相对标准曲线法2–∆∆Ct,以平均值±标准误(Mean±SEM)表示。采用SPSS 19.0软件对实验数据进行单因素方差分析, 多组间两两比较采用Tukey’s多重比较检验,P<0.05表示存在显著性差异。
1.7 整胚原位杂交和冰冻切片
利用特异性引物E-F1和E-R1(表 1)通过RTPCR扩增etv2基因部分cDNA序列。所得DNA片段克隆到pEGM-T载体(Promega)中, 构建的重组质粒经亚克隆测序后用限制性内切酶NotⅠ(TaKaRa)进行线性化处理, 然后以此为模板利用T7 RNA多聚酶(Roche)合成地高辛标记的反义RNA探针。整胚原位杂交方法按照先前的文献报道进行[20]。已完成原位杂交检测后的胚胎经4%多聚甲醛固定后,再用OCT(SAKURA)包埋, 于–21℃下进行冰冻切片。
2 结果
2.1 金鱼etv2基因cDNA结构及预测的氨基酸序列
利用RT-PCR在14体节期金鱼自交二倍体胚胎的RNA中扩增出一段长约930 bp的DNA片段。测序后BLAST分析结果显示该片段与斑马鱼etv2 cDNA序列高度相似, 故可以确定其为金鱼etv2部分cDNA序列。随后根据该序列设计特异性嵌套引物, 通过5′-RACE和3′-RACE获得了金鱼etv2基因的5′和3′端cDNA序列(图 1), 拼接后即得全长cDNA序列。金鱼etv2基因cDNA全长1531 bp, 包括5′非编码区64 bp, 3′非编码区351 bp, 其开放阅读框(ORF)为1116 bp, 编码371个氨基酸, 其中第244到327位氨基酸为ETS转录因子家族所特有的ETS结构域。预测的ETV2蛋白分子量约为41592.92 Da, 等电点为5.68, 氨基酸组成中丝氨酸(Ser)、甘氨酸(Gly)含量最多。所得的金鱼etv2基因全长cDNA序列Gen-Bank登录号为MK766456。
2.2 同源性分析和分子进化树的构建

图 1 金鱼etv2全长cDNA克隆所用引物扩增范围示意图Fig. 1 Primer positions for cloning the full length etv2 cDNA of goldfish
对比金鱼、斑马鱼、热带爪蟾、鼠、牛(Bos taurus)和人等6种脊椎动物的ETV2氨基酸序列发现, 金鱼ETV2与斑马鱼ETV2的相似性最高, 达86.9%, ETS结构域的相似性为100%; 金鱼ETV2与热带爪蟾ETV2的相似性为31.6%, ETS结构域的相似性为83.3%; 金鱼ETV2与鼠、牛和人等哺乳类ETV2的相似性分别为25.2%、25.5%和25.5%,ETS结构域的相似性均为60.7%。可见, 除了C端的ETS结构域之外, ETV2蛋白的其余部分在不同物种之间相似性较低, 具有较大差异。邻近法构建金鱼ETV2与斑马鱼、热带爪蟾、鼠、牛和人中同系物的NJ系统进化树 (图 2)。进化树显示ETV2进化关系与ETS1和ETS2分开。金鱼和斑马鱼ETV2亲缘关系最近, 首先聚类为一支, 进而与脊椎动物其他物种的ETV2聚类形成一个大的分支。
2.3 金鱼胚胎中etv2基因的时空表达模式
为了了解金鱼自交二倍体胚胎正常发育过程中etv2基因的时空表达模式, 利用半定量RT-PCR检测了金鱼未受精卵以及自交二倍体胚胎32细胞期、1K细胞期、尾芽期、6体节期、14体节期、20体节期和25% OVC等不同发育阶段的etv2表达情况(图 3a)。结果显示, 在未受精卵、32细胞期和1K细胞期没有检测到etv2表达; 从尾芽期开始,etv2有微量表达; 在6体节期、14体节期、20体节期和25% OVC,etv2表达水平较高。qRT-PCR检测结果显示,etv2基因在尾芽期表达水平最低, 在之后的发育时期表达水平逐渐升高, 20体节期达到最高水平, 25% OVC的表达水平低于20体节期(图 3b)。
在体节产生之前, 整胚原位杂交没有检测到明显的etv2表达信号(数据未显示)。在体节形成后,可以看到etv2特异性表达于前侧板中胚层(Anterior lateral plate mesoderm, ALPM)和后侧板中胚层(Posterior lateral plate mesoderm, PLPM)中, 胚胎前端的etv2表达信号在索前板处汇合(图 4a)。随着胚胎的发育,胚胎后部的etv2表达信号进一步向尾部延伸。14体节期,etv2在胚胎的前部、躯干和后部两侧的成血管细胞中表达十分明显(图 4b—d); 在PLPM区域可以看到一部分胚胎躯干和尾部表达etv2的成血管细胞由体节之间从胚胎两侧向中线迁移(图 4c黑色箭头所示), 而ALPM 区域的成血管细胞保持两侧定位不会向中线迁移(图 4e); 胚胎头部前端的表达信号逐渐消失(图 4d), 但在胚胎尾部腹侧出现表达信号(图 4d白色箭头所示)。20体节期, 在前侧板中胚层、预定前主静脉和总主静脉以及尾芽旁的成血管细胞中有很强的etv2表达(图 4f); 背主动脉中也可见明显的etv2表达信号(图 4g)。在25% OVC, 轴向血管、头部双侧原始静脉(Primordial hindbrain channel, PHBC)以及尾部静脉丛可见etv2的表达(图 4h)。在35% OVC, 大部分轴向血管中的etv2表达信号消失, 仅部分头部血管和后主静脉有微弱表达, 但尾部静脉丛及部分尾部体节间血管仍清晰可见(图 4i)。在96hpf, 未见明显的etv2表达信号(数据未显示)。
2.4 金鱼etv2 mRNA在成体组织中的分布
以未受精卵为阴性对照、14体节期为阳性对照, 利用半定量RT-PCR方法检测etv2基因在脑、心脏、肾脏、肝脏、脾脏、肌肉、卵巢和精巢等8种组织中的表达(图 3c)。结果表明, 在金鱼的肝脏、心脏、肌肉和肾脏中可以检测到etv2大量表达, 在精巢、脑和脾脏中可以检测到etv2少量表达, 在卵巢中没有检测到etv2表达。
2.5 金鱼etv2在雌核发育单倍体与自交二倍体胚胎中的表达存在明显差异

图 2 金鱼ETV2及斑马鱼、热带爪蟾、鼠、牛和人中同源物的系统发育分析Fig. 2 Phylogenetic analysis of goldfish ETV2 and its closest zebrafish, frog, mouse, cattle and human homologs
已有研究表明,etv2是血管发生的主调控基因[21],对脊椎动物脉管系统和血液循环的建成具有非冗余和不可替代的功能[22,23]。因此, 比较分析金鱼etv2在雌核发育单倍体与自交二倍体胚胎发育早期的表达情况对探讨雌核发育单倍体循环系统发育异常的分子机制具有重要意义。然而, 一旦循环系统建成后,etv2的表达就将下调[5,24], 于是我们主要比较了14体节和20体节期雌核发育单倍体与自交二倍体胚胎中etv2的表达差异。整胚原位杂交结果显示, 在14体节期(图 5a和图 5b), 与自交二倍体胚胎相比,etv2的表达在单倍体胚体中线或/和躯干两侧部分区域缺失(85%,n=40); 在20体节期(图 5c和图 5d), 与自交二倍体胚胎相比, 单倍体胚胎中etv2的表达出现不同程度减弱或/和在躯干及尾部的部分区域表达缺失(72.5%,n=40)。qRT-PCR结果显示, 14体节期和20体节期, 金鱼单倍体胚胎中etv2的表达均显著低于自交二倍体(图 5e和图 5f)。对14体节期已完成etv2反义RNA整胚原位杂交检测的金鱼胚胎进行冰冻切片, 观察胚胎横截面发现,在自交二倍体胚胎中etv2表达信号所标示的部分成血管细胞已经从胚体两侧迁移到了脊索下方(图 5g,箭头所示), 而单倍体胚胎中成血管细胞虽已分为内侧(图 5h黑色箭头)和外侧(图 5h白色箭头)两个亚群, 但仍保持胚体两侧定位, 不能迁移到胚体中线。这些结果表明金鱼胚胎早期发育的血管发生阶段, 雌核发育单倍体与自交二倍体中etv2的表达存在明显差异。
3 讨论
3.1 金鱼etv2序列分析
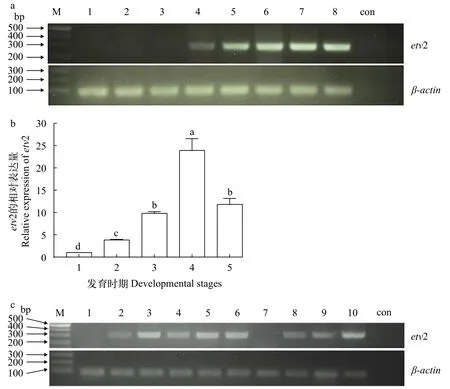
图 3 etv2在金鱼中的表达分析Fig. 3 The expression of etv2 in goldfish
本研究利用RT-PCR结合RACE-PCR方法克隆了金鱼etv2基因的cDNA全长序列, 并根据其ORF序列预测了ETV2蛋白的氨基酸序列。利用生物信息学方法分析发现金鱼ETV2蛋白仅在其C端含有一个ETS结构域, 除此之外, 没有其他明显可识别的结构域, 这与其他脊椎动物ETV2蛋白类似[9]。氨基酸序列比对分析发现, 金鱼与斑马鱼的ETV2氨基酸序列存在较高的相似性, 尤其是两者的ETS结构域氨基酸序列完全相同。由于ETS结构域的DNA结合核心序列GGAA/T广泛存在于血管内皮细胞谱系特异性表达基因的启动子和增强子中[25], 而不同物种ETV2蛋白的功能十分保守[9], 并且金鱼etv2基因也特异性表达于内皮细胞及其前体中(图 4),因此可以推测其在早期血管发生过程中也扮演重要角色。
3.2 金鱼etv2表达模式分析
在斑马鱼中, 除了cloche/npas4l,etv2比任何已知造血和内皮细胞分化调节因子都要更早表达[26,27]。RT-PCR结果显示金鱼etv2从尾芽期开始表达, 但是整胚原位杂交只能在体节形成后才能检测到其表达。qRT-PCR结果显示在20体节期前etv2的表达逐渐升高, 而25% OVC时期明显下降(图 3b); 整胚原位杂交也显示etv2在胚胎出现血液循环以后表达下调(图 4i), 胚胎发育至96hpf几乎无法检测到。这与其他脊椎动物胚胎中观察到的etv2表达模式类似[5,6,8,24,28], 说明胚胎发育时期,etv2在内皮细胞谱系中瞬时表达, 提示etv2对脉管系统的发育形成具有重要作用, 但对维持其正常生理功能并不重要。
ETS转录因子家族成员往往可以在多种成体组织中检测到表达[29], 但在小鼠和人成体中, Northern blot检测到etv2/ER71仅在睾丸中特异性表达[30,31]。与之不同, 我们利用RT-PCR方法在除了卵巢以外的多个金鱼成体器官组织中都检测到了etv2的表达(图 3c), 这可能与检测方法不同有关。考虑到etv2在胚胎发育过程中具有瞬时表达的特性, 可以推测etv2可能仅在某些成体组织的一小部分细胞中被瞬时激活表达, 由于其mRNA丰度极低,所以Northern blot方法检测不到。确实也有报道发现, 小鼠成体骨髓组织中etv2表达水平很低, 但其中分离的Lin-Sca1+c-Kit+(LSK)细胞中etv2表达水平较高[32]。
3.3 etv2异常表达可能是导致金鱼雌核发育单倍体胚胎血管发生异常的原因之一
脊椎动物的血管发育包括血管发生(Vasculogenesis)以及血管重塑(Angiogenesis)两个过程[33,34]。血管发生是指不依赖于已有的血管, 从无到有产生血管的过程。在斑马鱼中, 血管发生始于12hpf(4体节期), 此时侧板中胚层中首先特化产生成血管细胞, 并形成内侧和外侧两个成血管细胞亚群。随后它们大约在14hpf(约10体节期)和16hpf(约15体节期)分两批向胚胎中线迁移, 在内胚层上方和脊索下方聚集融合形成沿胚轴排列的血管索, 之后发育为主要轴向血管。其中, 内侧成血管细胞分化产生背主动脉, 而外侧成血管细胞则分化产生后主静脉[35,36]。etv2的表达对成血管细胞的分化、迁移以及融合形成功能性血管都十分重要[6,8,35]。在金鱼胚胎14—20体节期, 可以观察到雌核发育单倍体中etv2的表达在某些躯干部位表达缺失, 尤其是中线表达缺失(图5b、5d和5h), 这说明雌核发育单倍体中成血管细胞数量减少, 向中线迁移存在障碍, 轴向血管形成异常。在斑马鱼中用morpholino敲降etv2, 可导致成血管细胞不能迁移,etv2在胚胎中线的表达缺失[6], 说明ETV2蛋白的剂量本身可影响etv2基因的表达模式。我们发现金鱼etv2在单倍体胚胎14—20体节时期的表达水平较低(图 5e和图 5f),这可能是金鱼雌核发育单倍体中etv2表达部分缺失、成血管细胞减少和不能迁移的原因之一。先前研究发现, 由于存在母源甲基化现象, 调控中胚层特化及向中线汇聚所必需的ntl基因在金鱼雌核发育单倍体胚胎早期发育中的表达受到抑制[37]; 而成血管细胞起源于中胚层细胞, 所以可以推测ntl基因的异常表达可能间接影响了etv2的表达模式。此外, 单倍体胚盘中存在广泛的非特异性细胞死亡和细胞排列紊乱[13], 这也可能是导致成血管细胞减少和向胚胎中线迁移受阻的重要原因。

图 4 金鱼etv2在早期胚胎发育中的时空表达模式Fig. 4 Spatial and temporal expression pattern of goldfish etv2 during early embryogenesis
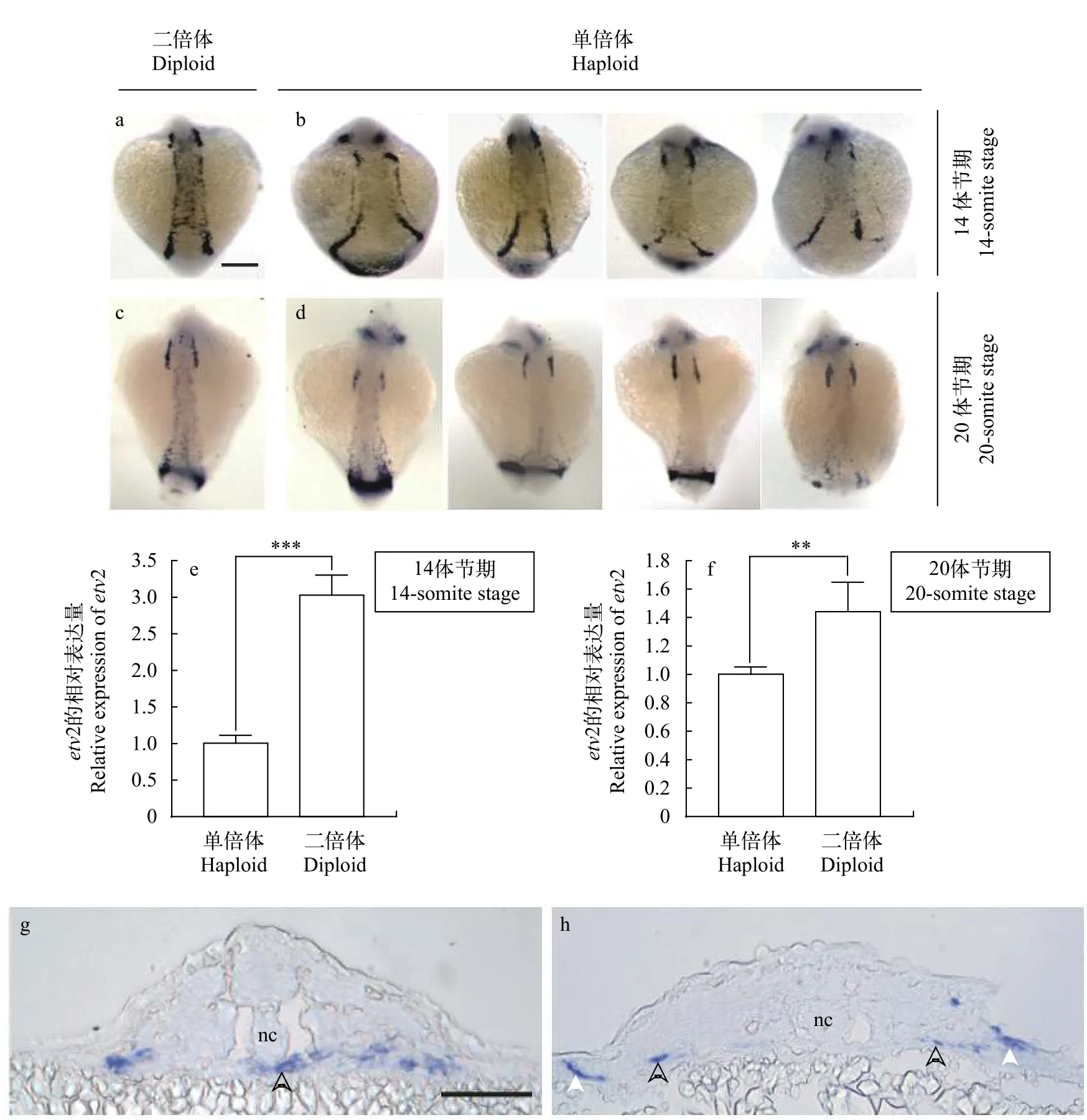
图 5 14体节和20体节期金鱼雌核发育单倍体与自交二倍体胚胎中etv2的差异表达Fig. 5 Differential expression of etv2 in gynogenetic haploid and inbred diploid goldfish embryos at 14-somite stage and 20-smoite stage
总之, 在本研究中, 我们克隆了金鱼etv2/ER71/Etsrp基因的全长cDNA, 并证明其表达模式在雌核发育单倍体和自交二倍体胚胎中存在差异, 为进一步揭示单倍体循环系统发育缺陷的分子机制奠定了基础。
