六价铬在斜带石斑鱼胚胎中的生物累积及其对igf2、glut2和pparg基因表达的影响
2020-12-10周小芳张鹏飞曾会玲叶恒振李慧莹靳方方梁智策郭志强
周小芳 张鹏飞 曾会玲 叶恒振 冯 浩 李慧莹 靳方方 梁智策 郭志强
(1. 海南大学海洋学院, 南海海洋资源利用国家重点实验室, 海口 570228; 2. 海南大学生命科学与药学院,热带生物资源教育部重点实验室, 海口 570228)
斜带石斑鱼(Epinephelus coioides), 俗称青斑,是石斑鱼属极具代表性的养殖品种[1], 我国野生斜带石斑鱼种群主要分布于南海海域和台湾海峡[2]。海南岛东部岛屿是南海斜带石斑鱼最主要的栖息地之一[1,3]。近十几年来, 我国野生斜带石斑鱼资源日益衰退[3]。因此, 对该鱼野生资源的保护已是迫在眉捷。在前期研究过程中, 有研究发现环境污染是斜带石斑鱼资源退化的重要原因之一[1], 但是相关的研究极其缺乏。
重金属是近海环境中主要的环境污染物之一,主要通过水体和食物途径累积到水生生物体内[4,6],对机体产生氧化胁迫、组织损伤和基因突变等毒害作用[7,9]。铬(Cr)是环境中常见的重金属污染物,Cr在环境中主要以Cr6+和Cr3+两种价态存在。即使在较低的浓度下, Cr6+也可能是剧毒的[10]。水体中Cr6+的污染对水生生物及鱼类具有生物毒性, 主要包括对细胞水平、免疫水平和抗氧化应激酶等方面具有毒性效应[11,14]。
鱼类早期生活阶段对外界环境极为敏感, 即使低浓度的重金属暴露也可能对其胚胎发育和仔鱼生长存活造成损害, 导致种群数量和质量的降低[15]。因此, 利用鱼类胚胎和仔鱼对重金属的毒理学反应进行生物监测已成为评价水体污染效应的重要手段[15]。目前重金属对鱼类早期发育阶段研究已取得初步进展, 主要采用孵化率、孵化时间和畸形率等发育指标展开研究, 常忽略了胚胎发育阶段对污染物的生物累积和分子监测指标方面的研究。石斑鱼胚胎发育属于内源性营养, 而胰岛素样生长因子2(Insulin like growth factor 2, IGF2)、葡萄糖转运蛋白(Glucose transporter 2, GLUT2)和过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor gamma, PPARG)这3种基因在生长和营养功能方面起着重要作用, 可用作胚胎发育的分子指标。igf2具有刺激DNA和蛋白质合成, 促进细胞有丝分裂, 调节糖原代谢的作用, 是最早发现的内源性印记基因之一, 也是胚胎发育的主要促进因子[16]。glut2基因和pparg基因分别为糖代谢水平和脂质代谢水平的重要基因, 其中glut2基因是调节胰岛素分泌的葡萄糖传感器[17], 而pparg基因是脂肪组织中调控脂肪酸代谢的核心转录因子, 影响脂肪细胞脂肪酸沉积及脂滴形成, 也是脂肪细胞生长、分化的重要指示基因[18]。
为了深入研究重金属在胚胎发育过程中的吸收和生物累积规律及其对胚胎发育过程中关键基因表达的影响, 本实验研究了水体中Cr6+在斜带石斑鱼胚胎中的生物累积量和吸收率及其对glut2、igf2和pparg基因mRNA表达的影响, 评价Cr6+暴露对石斑鱼胚胎细胞发育和营养代谢的影响。
1 材料与方法
1.1 实验材料
斜带石斑鱼受精卵于2018年4月1日购自海南晨海水产有限公司(陵水基地)。受精卵收集后, 洗净, 除去未受精的卵, 取上浮受精卵置于孵化桶中用于Cr6+暴露实验。斜带石斑鱼的受精卵呈圆球形, 为浮性卵, 卵径为(0.85±0.01) mm, 油球直径为(0.27±0.01) mm。
实验所用重铬酸钾(K2Cr2O7)试剂为分析纯(CAS No: 7646-85-7, 纯度>99.9%, 购自国药化学试剂公司), 先用去离子水配制成浓度3000 mg/L Cr6+母液备用, 实验前用膜过滤(0.22 μm滤膜)海水, 并稀释Cr6+溶液成所需浓度。据预实验及相关研究[19,20],确定0.20、0.60、1、5、10、20、40、60、80 mg/L9个Cr6+质量浓度梯度进行暴露实验, 每个浓度设3个平行, 实验使用500 mL的烧杯, 共20个烧杯, 用10 mL移液枪吸约受精卵(显微镜下均为刚受完精鱼卵)1万粒加入各个烧杯中, 实验期间用气石曝气保持水体正常溶氧, 光周期14L﹕10D, 实验海水盐度(32±1)‰, 温度(25±1)℃, pH为7.5±0.30, 溶解氧(6.3±0.80) mg/L(平均值±SD,n=3)。实验周期为30h, 分别在3h11min (桑葚胚期)、5h42min(囊胚期)、10h45min(原肠末期)、17h30min(脑泡形成期)、24h25min(心脏跳动期)取样, 用于测定其累积量样品放置−20℃冰箱, 用于测定分子样品放置−80℃冰箱, 每个浓度一式5份样品进行分析。
Cr6+暴露实验期间, 各处理组中Cr6+的实测浓度误差均<10%, 符合OECD关于此类实验误差在±20%范围内的要求[21]。
1.2 样品测定
样品Cr6+含量测定样品解冻后用蒸馏水清洗两遍除去表面的Cr6+, 然后置于烘箱65℃下48h烘干至恒重, 称重后转移至15 mL离心管, 加入1 mL HNO3(69%, ultrapure, Fisher Scientific, Geel,Belgium), 80℃下消化48h。使用电感耦合等离子体质谱法(ICP-MS; iCAP RQ Thermo Fisher, USA)测定样品中的Cr6+含量。
总RNA的提取及反转录总RNA抽提试剂Trizol购自Invitrogen公司。总的RNA用反转录试剂盒(公司)反转录。实时定量PCR试剂盒SYBR Premix ExTaq购自TaKaRa公司, 反应在实时定量PCR仪(ABI7500 Real-Time PCR System, 美国)上进行。测出的数据用内参β-actin进行归一化处理。
引物设计荧光定量PCR引物采用Primer 5.0软件设计, 由广州天一辉远生物科技有限公司合成, 引物序列及参数见表 1。
反应体系及条件使用10 μL荧光定量扩增体系, 反应条件为: 95℃ 30s预变性; 95℃ 5s, 58℃30s, 进行40个循环。每循环第2步结束时进行荧光信号收集。每个待测样品设置3个重复, 对3个阈值循环(Ct值)取平均值, 以备带入公式计算。
标准曲线的建立分别将β-actin、igf2、glut2和pparg4个基因的反转录产物用RNA-free离子水梯度稀释成10–9—1, 选择10–6—1共7个浓度为标准品, 标准品反应条件同上, 设置3个重复。基线由实时定量PCR仪自动设置, 标准曲线由软件自动分析, 得到斜率和扩增效率。
产物测序PCR产物由广州天一辉远生物技术有限公司测序, 登陆NCBI网站上与所找的鱼类的序列同源性比较, 测得同源性均为98%以上。

表 1 为所合成引物序列Tab. 1 Primer sequences
1.3 数据统计
吸收率[Jw, μg/(g·h)]通过计算其生物累积量和暴露时长两个变量的线性回归方程斜率获得, 吸收常数ku按如下公式计算[22]:
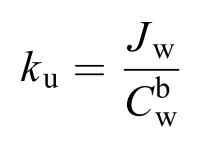
式中,ku代表胚胎对水相Cr6+的累积能力, b代表常数,Cw是水相Cr6+浓度(mg/L)。
根据系统自动分析的igf2、glut2、pparg及βactin标准曲线的斜率可得PCR扩增效率:
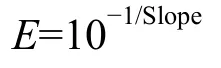
式中,E扩增效率, Slope为标准曲线斜率。igf2、glut2、pparg及β-actin的扩增效率都接近100%且相互间效率偏差在5%以内, 以目的基因mRNA的拷贝数与对应样品内参基因mRNA的拷贝数的比值表示基因mRNA的相对表达量。
所有数据以平均值±标准差(Mean±SD)表示,采用t检验检查处理组与对照组之间的差异显著性来判断其Cr6+暴露对胚胎重金属吸收、累积及目的基因表达的影响,P<0.05表示差异显著。数据统计分析使用SPSS19.0软件, 图表制作采用Sigmaplot和Graphpad prism软件。
2 结果
2.1 六价铬在胚胎发育过程中的生物累积和吸收率
如图 1所示, 各发育时期胚胎的生物累积量随着浓度的增加而呈线性增加。低浓度Cr6+暴露组(Cr6+≤5 mg/L), 生物累积量在胚胎发育期间变化不显著, 而在高浓度Cr6+暴露组(Cr6+为60和80 mg/L),Cr6+在胚胎发育期间持续累积。
如图 2所示, 不同发育时期的胚胎吸收率不仅随暴露浓度的增加而增加, 还随着胚胎的发育时期而逐渐降低。桑葚胚期、囊胚期、原肠末期、脑泡形成期和心脏跳动期的Cr吸收常数ku分别是2.79、0.50、0.25、0.18和0.14 L/(g·h)。
2.2 六价铬暴露对斜带石斑鱼胚胎发育时期igf2基因的mRNA表达量的影响
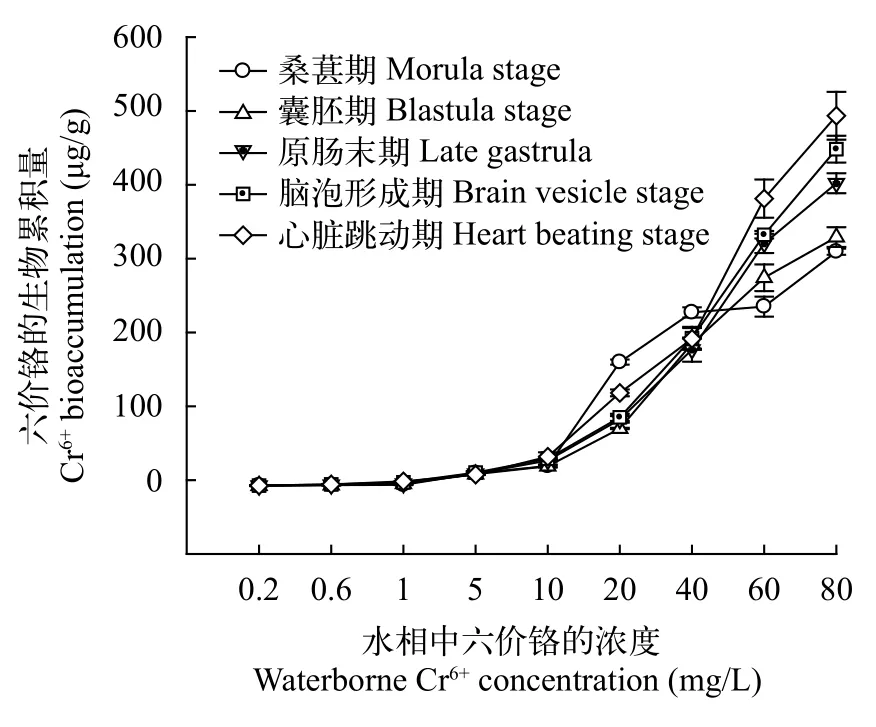
图 1 在不同浓度的Cr6+暴露下的斜带石斑鱼胚胎发育时期的Cr6+生物累积量Fig. 1 The Cr6+ bioaccumulation (μg/g) in Epinephelus coioides embryos under waterborne Cr6+ treatment

图 2 在不同浓度的Cr6+暴露下的斜带石斑鱼胚胎不同发育时期的Cr6+吸收率Fig. 2 The Cr6+ uptake rate [μg/(g·h)]in Epinephelus coioides embryos under waterborne Cr6+ treatment
与对照组相比, 在桑葚期浓度为0.6、1、10和80 mg/L的Cr6+暴露下, 石斑鱼胚胎的igf2基因的mRNA的表达量有显著促进作用(图 3A,P<0.05);囊胚期时除了在浓度为60 mg/L的Cr6+暴露下, 其他浓度的Cr6+暴露, 对igf2基因mRNA的表达量有显著促进作用(图 3B,P<0.05); 在原肠末期时, 仅在浓度为1 mg/L的Cr6+暴露下的表达量有显著促进作用(图 3C,P<0.05); 在脑泡形成期时, 在浓度为0.2、0.6、1和5 mg/L的Cr6+暴露下的igf2基因mRNA的表达量有显著促进作用(图 3D,P<0.05); 在浓度为10—80 mg/L的Cr6+暴露下的igf2基因mRNA的表达量为显著抑制作用(图 3E,P<0.05)。在igf2基因中,在浓度为1 mg/L的Cr6+暴露下的igf2基因mRNA的表达量在整个胚胎发育时期中为显著促进作用(图 3)。
2.3 六价铬暴露对斜带石斑鱼胚胎发育过程glut2基因的mRNA表达量影响
与对照组相比, 在桑葚期时, 除了在浓度为20和80 mg/L Cr6+暴露外, 其他浓度的Cr6+暴露对glut2基因的mRNA的表达量有显著促进作用(图 4A,P<0.05); 在囊胚期(图 4B), Cr6+暴露对glut2基因的mRNA的表达量有显著促进作用(P<0.05); 而在原肠末期(图 4C)中仅在浓度为0.2—5 mg/L的Cr6+暴露下有显著促进作用(P<0.05); 在脑泡形成期(图 4D)时, 仅在浓度为0.6、1和20 mg/L Cr6+暴露下,glut2基因的mRNA的表达量有显著促进作用(P<0.05);在心脏跳动期(图 4E)时, 在浓度为0.2、0.6、1、5和20 mg/L的Cr6+暴露下,glut2基因的mRNA的表达量有显著性作用(P<0.05),glut2基因的mRNA的表达量, 在浓度为80 mg/L的六价铬暴露下被显著抑制(P<0.05)。在glut2基因中发现, 浓度为0.2—5 mg/L的Cr6+暴露下, mRNA的表达量在石斑鱼胚胎发育的5个时期中都为显著促进作用(图 4)。
2.4 六价铬暴露对斜带石斑鱼胚胎发育时期pparg基因的mRNA表达量的影响
与对照组相比, 在桑葚期(图 5A)和囊胚期(图 5B)中, Cr6+暴露下的pparg基因的mRNA的表达量被显著抑制或不表达(P<0.05); 在心脏跳动期(图 5E)时,仅在浓度为5 mg/L的Cr6+暴露下有显著促进作用(P<0.05); 在原肠末期(图 5C)和脑泡形成期(图 5D)中, Cr6+暴露下的pparg基因的mRNA的表达量有显著促进作用(P<0.05); 特别是在脑泡形成期(图 5D)时, 仅在最高浓度80 mg/L暴露下的Cr6+pparg基因的mRNA的表达量无显著差异。在Cr6+暴露下的石斑鱼胚胎在发育的5个时期中,pparg基因的mRNA的表达水平普遍被抑制或者无明显差异, 仅在原肠末期(图 5C)和脑泡形成期(图 5D)时,pparg基因的mRNA的表达量显著促进作用(P<0.05)。

图 3 不同浓度Cr6+暴露下的斜带石斑鱼胚胎发育时期igf2基因的mRNA的表达水平Fig. 3 The effect of waterborne Cr6+ exposure on insulin like growth factor 2 (igf2) gene expressions in the grouper embryos

图 4 不同浓度Cr6+暴露下的斜带石斑鱼胚胎发育时期glut2基因mRNA的表达水平Fig. 4 The effect of waterborne Cr6+ exposure on glucose transporter 2 (glut2) gene expressions in the grouper embryos
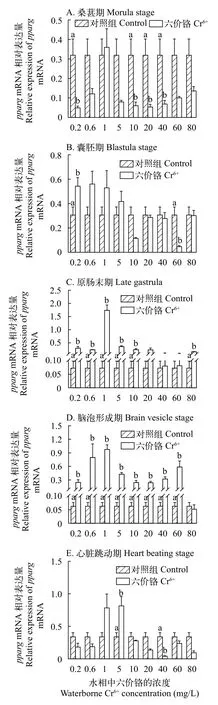
图 5 在不同浓度Cr6+暴露下的斜带石斑鱼胚胎发育时期的pparg基因的mRNA的表达水平Fig. 5 The effect of waterborne Cr6+ exposure on peroxisome proliferator-activated receptor gamma (pparg) gene expressions in the grouper embryos
3 讨论
3.1 斜带石斑鱼胚胎对六价铬吸收和累积
环境中Cr6+通过细胞膜离子通道进入细胞并产生危害[23]。本实验设置更大区间的Cr6+暴露, 并通过计算动力学参数首次量化了斜带石斑鱼胚胎对重金属的吸收和生物累积作用。发现石斑鱼胚胎在Cr6+暴露下的生物累积量随浓度的增加而增加,暴露浓度越高, 其胚胎的生物累积量越高; 有研究报道, 鱼类组织中Cr6+的浓度升高是导致每个营养级水平的生物放大作用产生根本原因, 尤其是底栖肉食性鱼类[24]。同时Cr6+及其化合物为剧毒物且容易进入细胞产生毒性[23], 随着暴露时间的增加, 胚胎的生物累积量逐渐增加并达到饱和状态, 因此随着胚胎的发育其吸收率也随之降低; 另一方面, 随着胚胎内Cr6+的累积, 重金属的生物毒性会导致胚胎内的生命活动减弱直至停止, 相应的胚胎对Cr6+的吸收率也随之降低。
3.2 六价铬暴露影响了斜带石斑鱼胚胎胰岛素样生长因子
igf2基因是胚胎发育的促进因子[13]。斜带石斑鱼桑葚胚期、囊胚期、原肠末期和脑泡形成期胚胎在低浓度(0.2—5 mg/L)Cr6+暴露下,igf2基因mRNA表达水平显著高于对照组(P<0.05)。生长激素会影响棕点石斑鱼(Epinephelus fuscoguttatus)中的igf2基因水平, 低浓度1和10 nmol/L促进igf2 mRNA显著高于高浓度100 nmol/L处理组[25]。在石斑鱼胚胎心脏形成期,igf2基因mRNA水平显著低于对照组(P<0.05)。我们推测Cr6+对石斑鱼胚胎igf2基因mRNA表达具有剂量效应, 即低剂量Cr6+短时间暴露刺激而高剂量以及长时间暴露则抑制该基因在胚胎发育期间的表达。在本次实验结束后不同保留浓度的孵化率也间接验证了这一推断。在实验结束时, 经过28h的孵化对照组及低浓度暴露组(0.2、0.6、1和5 mg/L)胚胎全部孵化成仔鱼,而高浓度组(10、20、40和80 mg/L)胚胎孵化率极低(<30%), 说明高浓度Cr6+暴露严重阻碍了石斑鱼的胚胎发育。因此从本实验igf2基因表达的结果来看, 高浓度Cr6+(10—80 mg/L)暴露会抑制斜带石斑鱼胚胎igf2基因mRNA表达进而延长胚胎发育时间。
3.3 六价铬暴露影响了斜带石斑鱼胚胎发育营养物质的代谢
glut2基因能促进葡萄糖转运效率, 该基因表达量主要受激素水平, 饥饿及胁迫水平[26]的影响。比如武昌鱼(Megalobrama amblycephala)饥饿4d后,glut2基因的mRNA的表达水平高于饥饿1d和2d的表达水平[27]。本研究发现在中低浓度Cr6+(0.2—5 mg/L)暴露下, 石斑鱼胚胎发育期间暴露在glut2基因mRNA水平显著高于对照组(P<0.05), 特别是浓度为1 mg/L的Cr6+暴露下,glut2基因的mRNA的水平在整个胚胎发育过程中几乎是最高的, 说明低浓度Cr6+暴露能刺激glut2基因mRNA的表达水平。这可能是由于低剂量Cr6+诱发的细胞内抗氧化等解毒反应额外增加了细胞的能量消耗, 进而刺激glut2基因增加表达以提供更多能量。
激素会干扰pparg基因在各种生物中的调节功能[28]。Cr6+是一种“金属雌激素”[29], 在河鳟(Salmo trutta fario)幼鱼中分离的原代肝细胞暴露在不同浓度的雌二醇和睾酮中, 发现低浓度的雌二醇会干扰pparg基因的mRNA的表达水平, 而高浓度的睾酮也会干扰pparg基因的mRNA的表达水平[30]。在本研究中, 低浓度的Cr6+暴露会刺激原肠末期和脑泡形成期的石斑鱼胚胎pparg基因的mRNA的表达水平。这有可能是由于重金属污染对鱼类胚胎发育器官形成期前的影响最大[31], 所以在斜带石斑鱼胚胎的原肠末期和脑泡形成期时低浓度的Cr6+暴露,刺激了pparg基因的mRNA的表达来抵御由Cr6+引起的应激反应。
4 结论
为探讨斜带石斑鱼胚胎发育不同时期在水相中Cr6+的暴露, 对其生物累积量、吸收率、细胞生长基因igf2、营养水平基因glut2和pparg的mRNA水平的影响。本研究发现Cr6+生物累积量和吸收率不仅随暴露浓度的增加呈线性增加, 还延长了胚胎孵化时间。相比其他胚胎发育时期, 桑葚期吸收水中Cr6+最强。在转录水平上我们发现igf2、glut2和pparg基因在浓度为0.2、0.60、1和5 mg/L的Cr6+暴露下, mRNA的表达水平更显著。我们推测低浓度的0.2、0.60、1和5 mg/L的Cr6+暴露就能引起石斑鱼胚胎在细胞生长水平和营养代谢水平的干扰作用。
