构巢曲霉产植酸酶的酶学特性分析
2020-12-10高兆建杨培玲宋玉林赵宜峰
高兆建,杨培玲,杨 芳,宋玉林,赵宜峰,焦 魏,陈 腾,*
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221018;2.长江桂柳食品睢宁有限公司,江苏徐州 221000;3.邳州市金大地肥料有限公司,江苏徐州 221300)
植酸酶是催化植酸及植酸盐水解成肌醇与磷酸或磷酸盐的一类酶的总称,它能将植酸分子上的磷酸基团逐个切下,形成中间产物肌醇五磷酸、肌醇四磷酸、肌醇三磷酸、肌醇工二磷酸、肌醇一磷酸,终产物为肌醇和磷酸[1]。在禾本科和豆科植物中植酸盐是磷酸的主要贮存形式,它是食品营养素碳水化合物、蛋白质、金属离子的强螯合剂。人体消化系统缺乏植酸酶,因此不能代谢植酸盐,限制了营养素在肠道的吸收[2],降低了食品的营养价值[3]。在植物性食品原料中添加植酸酶,释放植酸中的磷,可以提高食品中磷的吸收利用率,并降解植酸盐蛋白质络合物,减少植酸对微量元素的螯合。植酸酶在自然界中分布广泛,目前,在动物、植物和微生物中都发现过植酸酶[4]。植酸酶种类丰富,结构和性质差异较大,催化机理也各不相同。根据植酸酶的最适pH可将其分为碱性植酸酶和酸性植酸酶,酸性植酸酶由真菌以及绝大多数的细菌和植物分泌,而少部分细菌和植物能产生中性或偏碱性植酸酶[4]。对微生物植酸酶的广泛研究表明,植酸酶在人体健康、动物营养、环境保护等方面具有重要的应用价值。目前植酸酶的研究报道较多,如Puppala等[5]报道的Streptomycessp.酸性耐热植酸酶能促进植物生长;Rocky-Salimi等[6]报道的Bacillussubtilis植酸酶耐碱、耐热,在环境修复方面有应用潜力,但对影响植酸酶在食品中应用的重要特性即底物催化特性未见报道。目前已经有商业化的植酸酶应用于动物饲料中,但应用于食品加工的还较少,并且报道的植酸酶在最适催化条件、稳定性、底物催化特性、酶活力等方面仍存在较多缺陷。Sanni等[7]报道的Aspergillusfumigatus植酸酶在中性偏碱性条件下稳定性较好但耐热性不高,50 ℃下保温1 h酶活只剩48%;Sapna等[8]报道的Aspergillusoryzae植酸酶具有良好的抗蛋白酶降解特性,但酸碱及热稳定性不足,pH7.0孵育2 h酶活降为约40%,80 ℃保温30 min酶活几乎全部丧失。从报道文献看出,植酸酶在酶学特性方面仍然存在诸多不足,寻找开发性能更好的适用于食品加工产业的新型植酸酶有着持续的市场需求。
根据查阅的文献,本研究首次从构巢曲霉中分离出植酸酶并对其特性研究。本研究采用实验室筛选到的一株产植酸酶菌株,从其发酵液中分离纯化植酸酶,并对该酶的酶学特性进行研究,确定其作为食品添加剂对改善食品营养的适宜性。该酶有希望应用于谷类食品加工或动物饲料等领域。
1 材料与方法
1.1 材料与仪器
菌种:本研究所用产植酸酶菌株 为前期实验室筛选获得,经过生理生化及分子生物学鉴定确定为构巢曲霉(Aspergillusnidulans)AnP-16;DEAE-Sepharose Fast Flow、Phenyl Sepharose 6 Fast Flow 瑞典Amersham pharmacia公司;蛋白质标准分子质量Marker、牛血清白蛋白 美国 Sigma公司;考马斯亮蓝R-250 美国Bio-Rad公司;其他试剂 均为国产分析纯;PDA斜面培养基:马铃薯20 g/100 mL,葡萄糖2 g/100 mL,琼脂1.5 g/100 mL,pH自然,121 ℃灭菌20 min;种子培养基:在PDA 培养基基础上添加,NH4NO30.2 g/100 mL,MgSO4·7H2O 0.05 g/100 mL,KCl 0.05 g/100 mL,琼脂1.5 g/100 mL,pH6.0。121 ℃蒸汽灭菌15 min;发酵培养基:玉米淀粉2.0 g/100 mL,葡萄糖1.0 g/100 mL,植酸钙0.5 g/100 mL,NH4NO30.5 g/100 mL,MgSO4·7H2O 0.05 g/100 mL,KCl 0.05 g/100 mL,CaCl20.01 g/100 mL,pH6.0,121 ℃蒸汽灭菌15 min。
UV-2450型紫外可见光分光光度计 日本岛津公司;Hoefer 2-D Electrophoresis电泳系统 美国HOEFR公司;AKTA Explorer 100型蛋白质纯化系统 美国GE公司;SIGMA3K30型台式冷冻离心机 德国Sigma公司;JS-680D凝胶成像系统 上海培清科技有限公司;DYY-6B凝胶水平电泳仪 北京市六一仪器厂。
1.2 实验方法
1.2.1 植酸酶的发酵制备 将培养好的构巢曲霉AnP-16制成浓度为1×107个/mL孢子悬液,按1%(v/v)的接种量接种于液体发酵培养基,30 ℃、180 r/min培养6~7 d,发酵液过滤所得滤液10000 r/min离心15 min,收集上清液即粗酶液。
1.2.2 植酸酶的纯化
1.2.2.1 离子交换层析 将发酵所得粗酶液按照20%~60%盐析,充分透析脱盐后的透析液上样于用pH6.5,20 mmol/L磷酸缓冲溶液平衡的DEAE-Sepharose Fast Flow,用含0~0.8 mol/L NaCl同种缓冲液线性梯度洗脱,洗脱速度1.0 mL/min,3 mL/管自动收集,280 nm波长下在线检测蛋白浓度。
1.2.2.2 疏水层析 离子交换层析后的样品进一步Phenyl-Sepharose 6 Fast Flow疏水层析纯化。pH6.0、20 mmol/L的柠檬酸-磷酸氢二钠缓冲液(含0.4 mol/L(NH4)2SO4)充分平衡层析柱后上样,继续用相同缓冲溶液洗脱至流出液OD280至0.1以下。再用含2.0~0 mol/L浓度的(NH4)2SO4相同缓冲液线性梯度洗脱,流速0.8 mL/min,3 mL/管收集洗脱液,测酶活以检测纯化情况。
1.2.3 植酸酶活性检测 参考De Oliveira Ornela等[9]的方法并稍作改动测定植酸酶活力。将酶液用pH4.0、20 mmol/L的乙酸钠缓冲液稀释至合适浓度。取50 μL于55 ℃预热5 min,加入50 μL的2.5 mmol/L植酸钠溶液,55 ℃恒温反应30 min后立即加入100 μL的15%三氯乙酸终止反应,再加入300 μL去离子水,900 μL显色液(H2SO40.76 mol/L,维生素C 10 g/100 mL,钼酸铵2.5 g/100 mL),50 ℃温浴20 min,820 nm下测吸光值,然后与标准磷酸钾溶液对照计算酶活力。植酸酶活性的定义为[9]:在最适宜条件下,每分钟从一定浓度的植酸钠溶液中释放1 μmoL的无机磷所需要的酶量为一个酶活力单位。
1.2.4 酶纯度分析及分子量测定 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)测定纯化情况。分离胶为12%,浓缩胶为4%,电压为120 V,考马斯亮蓝R-250染色。以标准蛋白质分子量的对数对相对迁移率作图,得到标准曲线,lgMr=K-bmR,Mr蛋白质分子量;K为常数,b斜率,相对迁移率mR=样品迁移距离(cm)/染料迁移距离(cm)。
1.2.5 植酸酶特性分析
1.2.5.1 最适pH及酸碱稳定性 以植酸钠为底物,pH2.0~10.0的反应体系,55 ℃下酶解反应,分别测定纯化后适当稀释的植酸酶活性,确定酶的最适pH。纯化后的植酸酶37 ℃下在以上不同pH下孵育3 h,测定残余酶活力,未处理的酶液酶活力定义为100%,计算相对酶活力,确定酶的pH稳定性。

表1 构巢曲霉AnP-16产植酸酶的纯化过程
1.2.5.2 最适温度及热稳定性 参照文献[7],并稍作修改。将纯化后的植酸酶在pH4.0,温度20~80 ℃下测定酶活力,确定最适反应温度。植酸酶在40~80 ℃下,分别热处理1~4 h。再在55 ℃,pH4.0下测定植酸酶的活性,确定酶的热稳定性。
1.2.5.3 金属离子及抑制剂对植酸酶的影响 参照文献方法[8],并适当修改。取纯化后的适当酶液,向其中分别加入金属盐、表面活性剂、抑制剂和有机溶剂等溶液。37 ℃保温1 h后,测定残余酶活力。以上均以不加任何试剂的酶液作为空白对照。
众所周知,我国的文字属于象形文字,而对“酒”字的演变进行考察后不难发现,酒字的甲骨文中就包含了陶罐的表现形式,也就是说,在酒出现的初期,就是被保存在陶罐之中的。
1.2.5.4 底物特异性测定 选取植酸钠、植酸钙、对硝基苯酚磷酸酯、三磷酸腺苷、二磷酸腺苷、一磷酸腺苷、葡萄糖-1-磷酸、葡萄糖-6-磷酸、果糖-6-磷酸做为测定酶活的底物。所有底物的浓度均为3 mmol/L。具体测定方法参照1.2.3植酸酶活性检测方法。以植酸钠为底物的酶活记做100%,以相对酶活表示酶对不同底物的水解特异性。
1.2.5.5 酶的动力学分析 在20 mmol/L、pH4.0的乙酸钠缓冲体系中,55 ℃条件下,分别以浓度为0.5、1.0、1.5、2.0、3.0、4.0和5.0 mmol/L的植酸钠为底物,与纯化得到的植酸酶反应,测定酶活力,并计算相应的反应速度,利用双倒数作图法求得Lineweaver-Burk常数Km值及Vmax。
1.3 数据统计与分析
所有实验均以一式三份的形式进行,实验数据用Microsoft Excel进行统计分析并作图,结果用“平均值±标准差”表示。
2 结果与分析
2.1 植酸酶的分离纯化
2.1.1 离子交换层析 离子交换层析洗脱曲线如图1所示,经洗脱得到四个蛋白洗脱峰,其中,P3峰有酶活性,25号管对应的酶活性最高,对应的NaCl洗脱浓度约为0.3 mol/L。洗脱曲线看出在该分离条件下,植酸酶与杂质分子实现了较好分离。经层析纯化,酶比活力达到12.24 U/mg,纯化倍数为10.2倍,回收率为66.1%。
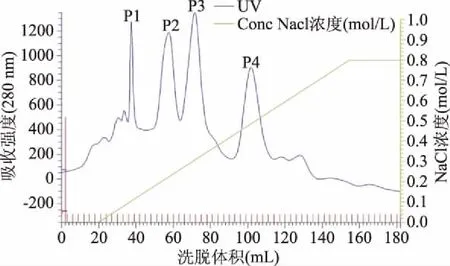
图1 植酸酶的离子交换层析
2.1.2 疏水层析 疏水层析洗脱曲线如图2所示,经洗脱得到六个蛋白洗脱峰,其中P4蛋白峰检测到酶活力,对应管数34~43,其中38号收集管酶活力最高,对应(NH4)2SO4浓度约1.0 mol/L。收集含酶活性收集管层析液并测定蛋白浓度和酶活性。各步纯化情况见表1,疏水层析后酶比活力达72.9 U/mg,纯化倍数60.8,回收率41.6%,远比Casey等[10]、Dutta等[11]、Boyce 等[12]报道的植酸酶纯化倍数高。本研究建立的一步离子交换层析,一步疏水层析纯化植酸酶的方法,不仅简化了纯化步骤,还避免了酶活损失,为研究植酸酶性质奠定了基础。
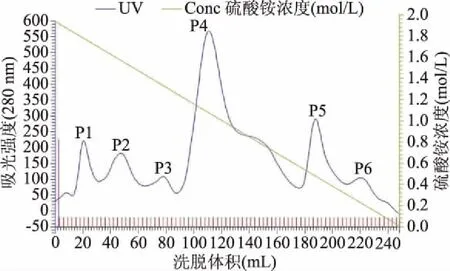
图2 植酸酶的疏水层析
2.1.3 蛋白电泳检验纯度 经过系列纯化的样品SDS-PAGE凝胶电泳分析,结果如图3所示。经疏水层析后,植酸酶组分达到电泳纯,显示单一电泳条带,表明植酸酶为单亚基蛋白。根据标准蛋白相对迁移率及其分子量测得植酸酶的分子量约为52 kDa,相比Neira-Vielma等[13]报道的黑曲霉(89 kDa)、Zhang等[14]研究的无花果曲霉(65.5 kDa)、Lee等[15]研究的草酸青霉(65.5 kDa)等霉菌来源的植酸酶分子量偏小,但远比Casey等[16]从根霉分离的植酸酶(124 kDa)要小。不同来源的植酸酶表观分子量差异较大,但报道的植酸酶的分子量大多在60~90 kDa之间。本研究的植酸酶同报道分子量差异较大,推测为新的植酸酶蛋白分子。

图3 植酸酶的SDS-PAGE
2.2 植酸酶的特性分析
2.2.1 pH对植酸酶活性的影响 不同pH条件下测得植酸酶活性见图4。pH2~7范围内有70%以上的活性,pH10时相对酶活仍有30%,在pH4测得酶活25.2 U/mL,具有最高活性,与Escobin-Mopera等[17]研究的肺炎克雷伯菌9-3B植酸酶最适pH相一致;但相比报道来源于黑曲霉[10]、毛霉[12]、黄曲霉[18]植酸酶最适pH要高。而报道的无花果曲霉[14]植酸酶最适pH为1.3,比本研究的pH要低。不同来源的植酸酶最适作用pH存在差异,表面酶蛋白分子结构不同。本研究植酸酶在低pH时酶活性较高,说明更适合酸性环境下使用。
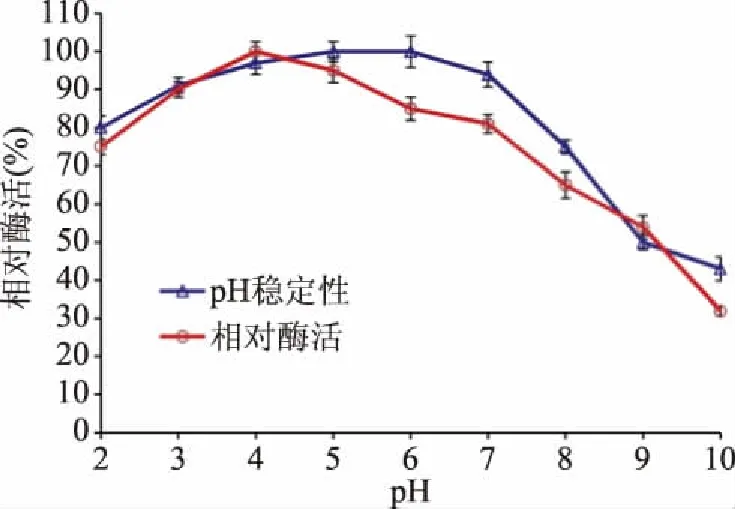
图4 不同pH条件下植酸酶的活性
pH稳定性结果表明,在pH3.0~7.0范围内,具有90%以上的相对酶活。在pH2.0时酶活20.2 U/mL,活性略有下降,但仍有80%。但在碱性pH9.0、10.0,酶活大幅度下降,降至50%以下。Sann等[7]从烟曲霉得到的植酸酶在pH6.0的条件下保温6 h后,其酶活只剩约50%。Sapna等[8]报道的米曲霉植酸酶pH5.0孵育1 h,酶活即下降至80%。而Escobin-Mopera等[17]关于肺炎克雷伯菌的研究表明,在pH6.0的条件下保温6 h几乎完全丧失酶活。从植酸酶用作食品添加剂的角度来看,该酶同食品一起从口腔(pH5.0)经胃(pH2.0~4.0)最后到大肠上部(pH4.0~6.0)所经消化道pH约在2~6之间,该酶在消化道的pH范围内可表现出显著的活性和高稳定性[13]。因此,本研究的植酸酶同其他文献报道的相比,在人体消化道中更容易对植酸降解,确保食品在肠道中更好消化,促进肠道对营养物质吸收。
2.2.2 植酸酶的最适反应温度及热稳定性 温度是影响酶活性的重要因素。从图5中可知,不同的温度对植酸酶活性具有明显的影响,在20~55 ℃的范围内,随着温度的升高,酶活性增强,随后酶活力逐渐降低,当温度80 ℃时酶活力还能达到16.1 U/mL。故酶的最适作用温度为55 ℃,最大酶活力26.7 U/mL,这与泡盛曲霉[19]、草酸青霉[16]最适作用温度一致;但明显高于粘滑罗斯菌[4]、烟曲霉菌[19]、无花果曲霉[8]植酸酶最适温度。
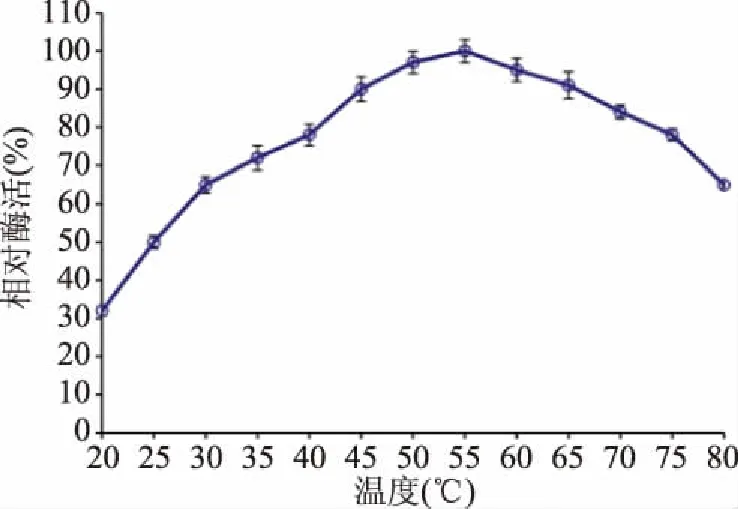
图5 植酸酶的最适反应温度
植酸酶的热稳定性实验表明,植酸酶在40~50 ℃条件下保温2 h酶活仍有90%以上,60~70 ℃保温1 h时,剩余酶活80%以上(图6),表明植酸酶有相对较好的热稳定性,比文献报道的源于Eupenicilliumparvum[20]、Aspergillusjaponicus[21]、Aspergillusflavus[18]的植酸酶热稳定性高;但相比Bacillussubtilis[6]和Bacillusamyloliquefaciens[22]的植酸酶热稳定性低。在人体营养中,植酸酶不仅需要在胃的pH环境下保持高活性,并且在储存、加工和通过胃肠道的过程中必须保持稳定。耐热性是植酸酶的优良酶学特性,本研究的植酸酶在需要加热处理的饲料加工造粒以及食品巴士杀菌中能够保持良好的稳定性[23],可以满足这些工艺要求。
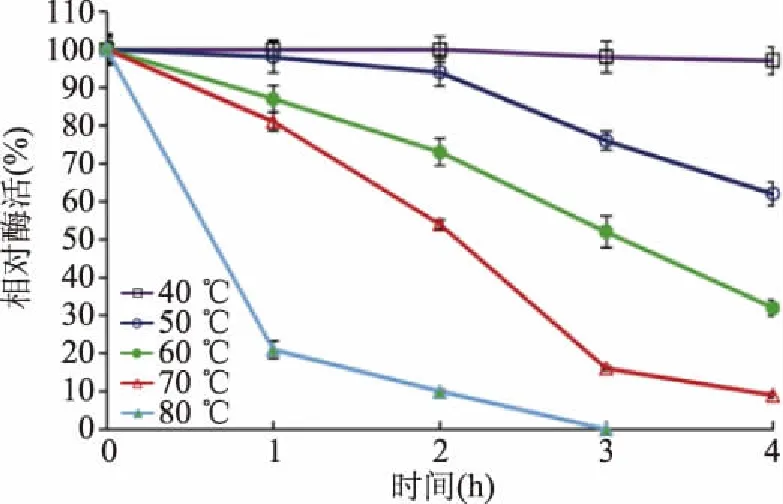
图6 植酸酶的热稳定性
2.2.3 金属离子及抑制剂对植酸酶的影响 各试剂对植酸酶作用效果如表2所示,Ca2+和Mg2+在1和5 mmol/L离子浓度下对酶均有明显激活作用,这与报道的其他植酸酶相一致,如Bacillusamyloliquefaciens[22]植酸酶严格依赖Ca2+;AspergillusoryzaeSBS50植酸酶Ca2+可使其活性提高至121.7%,推测Ca2+可以减少活性位点裂隙周围的负电荷,使植酸更容易靠近酶活性中心[22],由此激活酶活性。K+、Na+、Co2+和Ba2+对酶活力无显著影响。5 mmol/L的Cu2+和Mn2+对植酸酶有强烈抑制作用,而Neira-Vielma等[13]报道的10 mmol/L Cu2+和Mn2+则可使Aspergillusniger植酸酶活性分别提高至135%和128%。推测本研究构巢曲霉植酸酶催化中心结构同报道的结构不同,Cu2+和Mn2+与活性中心关键氨基酸的侧链结合导致底物不能正常和酶催化中心靠近,导致酶活性受到强烈抑制。Hg2+对酶活力有强烈的抑制作用,在5 mmol/L Hg2+浓度下,植酸酶酶活力几乎完全丧失。
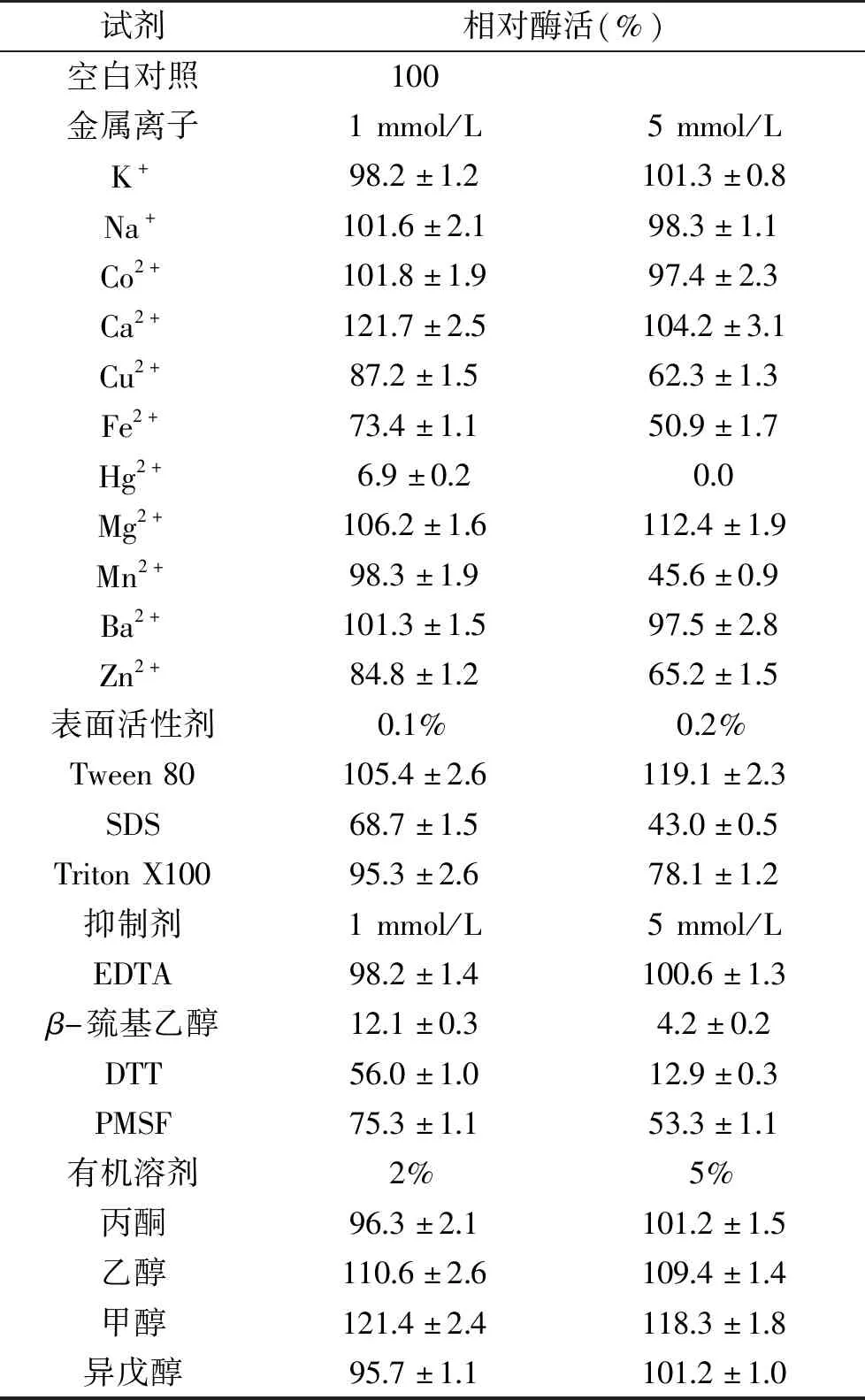
表2 金属离子、表面活性剂、抑制剂及有机溶剂对植酸酶活性的影响
Tween 80对酶有激活作用,而阴离子表面活性剂SDS和Triton X100则对酶有抑制作用,且SDS的抑制作用较Triton X100更强,据报道,SDS对其它来源的植酸酶也有强的抑制作用,嗜热链球菌[24]植酸酶被SDS强烈抑制,5 mmol/L的SDS可以使Aspergillusfumigatus[7]植酸酶丧失约50%的活性,0.1%的SDS可以使黑曲霉[25]的植酸酶其丧失92%的活性。这种抑制作用可能由于带有负电荷的去污剂和带有正电荷的植酸酶活性位点之间相互作用,导致底物难以进入酶的催化活性位点。
抑制剂EDTA对酶没有明显作用,表明酶的催化活性不需要金属离子,这与大多数植酸酶相似[25]。还原剂β-巯基乙醇和DTT对酶有强烈抑制作用,说明酶蛋白半胱氨酸残基-SH基团位于酶的催化活性中心并参与酶的催化活性。蛋白酶特异性抑制剂PMSF对植酸酶有较强的抑制作用,浓度0.2%时酶活性残余53%,这与其他植酸酶类似,如A.niger植酸酶在使用0.5 mmol/L PMSF时其活性大部分丧失[26];另一种来自嗜热链球菌的植酸酶5 mmol/L PMSF能使酶丧失28%的活性[27]。
有机溶剂甲醇和乙醇都有激活作用,而丙酮和异戊醇基本没有影响。有机溶剂的分子结构改变了酶分子周围的微环境,从而影响酶的二级和三级结构,进而影响催化性能。文献报道丁醇、异戊醇和己烷对Aspergillusoryzae[8]和Sporotrichumthermophile[24]植酸酶都有轻微的激活作用。
2.2.4 植酸酶底物特异性 由于酶对不同底物的结合能力不同,表现出不同的酶活,表3显示植酸酶可对多种底物有催化活性,以对硝基苯酚磷酸酯为底物催化活性最高,可达到132.5%,这与很多文献报道的结果相一致,如Fugthong等[20]报道的Eupenicilliumparvum植酸酶、Singh等[1]报道的Sporotrichumthermophile植酸酶。植酸酶对植酸钙的水解活性同植酸钠基本一致,有96.4%的水解活性;对葡萄糖-1-磷酸和葡萄糖-6-磷酸也有较高的水解活性,分别达到82.3%和67.6%。对其他底物水解活性略低,相对酶活为32.5%~38.0%。不同生物来源的植酸酶其底物特异性往往区别较大,来源Rhizopusmicrosporus[9]的植酸酶对植酸钠有强的水解活性,而对其他底物水解活性极低,Aspergillusflavus[18]植酸酶除了对植酸钠和对硝基苯酚磷酸酯活性高外,其他底物无水解活性,而源自Aspergillusoryzae[8]、Aspergillusniger[13]、Aspergillusficuum[14]、Sporotrichumthermophile[1]等真菌的植酸酶对多种有机磷酸盐表现出宽广的底物特异性。底物特异性较宽的植酸酶与底物特异性较窄的植酸酶相比,更适合用做食品添加剂,可以在不同种类的粮食产品中使用。

表3 植酸酶的底物特异性
2.2.5 植酸酶的动力学分析 利用不同浓度的植酸钠为底物测定植酸酶的反应初速率,以酶促反应初速率倒数1/v为纵坐标,底物浓度倒数1/[S]为横坐标,用Lineweaver-Burk双倒数作图法作图,经线性回归计算反应动力学参数。植酸酶对植酸钠的水解作用符合米氏方程,求得植酸酶的表观米氏常数Km为0.576 mmol/L,最大反应速率Vmax为29.35 μmol/min。该植酸酶的米氏常数Km和草酸青霉[15]植酸酶Km=0.545 mmol/L比较接近。比黑曲霉[15]植酸酶Km=0.660 mmol/L、乳酸杆菌[3]植酸酶Km=0.773 mmol/L和米曲霉[8]植酸酶Km=1.14 mmol/L等要低,说明本研究的植酸酶与植酸钠的亲和能力更强,但与嗜热霉菌[1]植酸酶Km=0.156 mmol/L、曲霉NTG-23[14]植酸酶Km=0.295 mmol/L和克雷伯氏菌[28]的植酸酶Km=0.300 mmol/L要高。
3 结论
本研究报道了来源于构巢曲霉AnP-16的植酸酶。经过一系列的分离纯化,得到了单一组分的植酸酶。酶比活力达到72.9 U/mg,纯化倍数60.8倍,显现了优良的纯化效果。植酸酶在广泛的酸性环境(pH2~6)及较高温度范围内酶活力高、稳定性强,说明在人体消化道中可充分发挥酶的催化功能,并可以耐受食品加工环节的高温工艺过程。金属离子Ca2+与Mg2+可分别使酶活提高至121.7%和112.4%;表面活性剂Tween 80可激活酶活性至119.1%,0.1%浓度的Triton X100及2%和5%的丙酮、乙醇、异戊醇等有机溶剂对酶活性无显著影响,而2%的甲醇能增强酶活性至121.4%。植酸酶具有宽泛的底物特异性,用做食品添加剂方面有着突出优势。总体而言,本实验从构巢曲霉AnP-16发酵液分离纯化的植酸酶酶学特性特别是其优良的在酸性环境下的稳定性及耐热性使其开发食品添加剂方面有较大潜力。
