氧化铈-二氧化硅介孔材料制备及对铜离子的吸附性能
2020-12-10李友凤敖克厚樊磊磊黄志刚
李友凤,敖克厚,樊磊磊,黄志刚
(遵义师范学院化学化工学院,贵州遵义563000)
重金属废水是重金属离子迁移并造成污染的一种主要废水形式。 迄今为止国内外已研发了多种重金属废水的处理方法,如化学法、沉淀法、铁氧体法、吸附法、离子交换法、膜过滤法、浮选法和物理化学法等[1-8]。 与其他方法相比,吸附法由于是利用多孔性固体材料对废水中的重金属离子的吸附作用而将重金属除去的方法,适应于各种不同的重金属废水,特别是低浓度废水和废水的深度处理, 且其操作简单、成本相对较低,因此是一种经济有效、具有推广应用价值的重金属废水处理方法[9-10]。
采用吸附法处理重金属废水,关键在于吸附剂的性能。 一般来说,优异的吸附剂必须具备大的比表面积、高的吸附容量以及良好的选择性、稳定性及再生性等特征[11]。 稀土基吸附剂性能稳定且吸附容量较高,但其成本较高限制了其广泛应用。 氧化铈是一种含量丰富、价格相对便宜且在酸性条件下溶解度最低的稀土氧化物,同时氧化铈对水中的部分金属离子有很好的亲和力,是一种很有前途的去除水中重金属离子的吸附剂[12]。 田志茗等[13]采用溶胶-凝胶法制备的球状CeO2, 在吸附苯酚时表现出优异的性能。 李荣辉等[14]采用溶剂热法制备了氧化铈纳米晶粒,用来吸附水中的As(Ⅴ),2h 之内将水中的As(Ⅴ)处理到质量浓度低于10μg/L 以下,并研究了其吸附动力学过程。 张金洋等[15]比较了浸渍法和水热法制备的纳米CeO2对六价铬吸附性能的影响,结果表明浸渍法制备的片状CeO2具有更好的吸附能力和更快的吸附速度,80min 时基本达到吸附平衡。 通常CeO2纯组分的比表面积较小,表面活性位较少,吸附性能较差。 而介孔氧化硅具有很大的比表面积和孔道体积、尺寸可控调节及分布较窄的孔径、可控均一的形貌等,被广泛应用于吸附剂材料。 但是,由于SiO2骨架中晶格缺陷少、水热稳定性较差,限制了其应用和发展。 将CeO2负载在SiO2上, 利用CeO2和SiO2的协同作用可提高其吸附性能和水热稳定性。 王帆等[16]以多孔二氧化硅微球为载体, 采用旋转蒸发技术制备CeO2@SiO2新型吸附剂,对氟离子有很好的去除效果。 但是将CeO2@SiO2应用于废水中重金属离子的脱除鲜有报道。
笔者主要研究共沉淀法和沉淀浸渍法制备CeO2-SiO2吸附剂,探讨其对水中重金属离子的吸附性能,并研究了制备方法、溶液pH、溶液初始离子浓度、吸附剂用量、吸附时间以及铜、铁、锰等离子对CeO2-SiO2吸附性能的影响规律。
1 实验部分
1.1 样品的制备
实验原料:六水合硝酸亚铈(纯度为99.99%),正硅酸乙酯(AR),十二胺(CP),氨水(AR),尿素(AR),无水乙醇(AR),蒸馏水(自制)。
共沉淀法:将一定量十二胺(DDA)溶解于60mL无水乙醇中,加蒸馏水稀释到100mL,加入0.868g六水合硝酸铈,充分搅拌得黄色溶液(A 液);称取相应化学计量比的正硅酸乙酯(TEOS)溶于40mL 无水乙醇中,充分搅拌得均相溶液(B 液);实验过程中取Ce 与Si 物质的量比为1∶1。在快速搅拌下将B 液缓慢滴加到A 液中,继续搅拌0.5h 得到沉淀,将沉淀在室温下陈化、离心、过滤,并用蒸馏水和无水乙醇洗涤, 将沉淀置于烘箱内在80℃干燥10h 得到前躯体, 将前躯体置于马弗炉中在500℃焙烧4h得到淡黄色CeO2-SiO2粉体,记为“样品-Ⅰ”。
沉淀浸渍法: 取0.868g 六水合硝酸铈和1.0g尿素溶于100mL 蒸馏水中,置于80℃水浴中搅拌1h,反应后生成白色沉淀,沉淀冷却、过滤、洗涤、干燥,然后置于马弗炉中在550℃焙烧4h,得到CeO2粉体。 量取氨水86mL 于烧杯中,依次加入175mL无水乙醇和84mL 蒸馏水,搅拌均匀后于50℃水浴中搅拌15min,加入96mL 正硅酸乙酯(TEOS),充分搅拌得到均相溶液。 在均相溶液中加入化学计量比的CeO2粉体(Ce 与Si 物质的量比为1∶1),继续磁力搅拌2.0h,将沉淀冷却、过滤、洗涤、干燥,然后于500℃焙烧1.0h 得到CeO2-SiO2粉体,记为“样品-Ⅱ”。
1.2 样品的性能表征
用D8Advance 型X 射线衍射仪(XRD)检测样品的物相结构; 用JSM-6380LV 型扫描电子显微镜(SEM)观察粉体的形貌和结构特性;用ASAP2020型自动吸附仪采用BET 方法分析样品的比表面积和孔结构特性;用Lambda 35型紫外-可见光谱仪测量水溶液中重金属离子的吸光度。
1.3 吸附实验
称取2~20mg 的CeO2-SiO2吸附剂加入到100mL重金属离子溶液中,室温下磁力搅拌进行吸附实验。测量不同时刻吸附后滤液中重金属离子的浓度,可通过平衡吸附量(Qe)和去除率(η)分析吸附效果。

式中:ρ0为溶液初始离子质量浓度,mg/L;ρt为t 时刻溶液离子质量浓度,mg/L;ρe为吸附平衡时溶液离子质量浓度,mg/L;V 为离子溶液体积,L;m 为吸附剂用量,g;Qt为t 时刻吸附量,mg/g; 实验中所取的重金属离子有Cu2+、Fe2+、Mn2+。
2 结果与讨论
2.1 XRD 分析
图1为两种方法制备的CeO2-SiO2粉末的XRD谱图。 从图1可见,粉末样品主要为立方萤石CeO2结构, 在2θ 为28.5、33.0、47.5、56.5°处有4个较强衍射峰,分别对应(111)(200)(220)(311)晶面,其晶型与JCPDS 34-0394谱图一致[17]。 从图1可见非晶质SiO2锯齿线,应该是CeO2和非晶质SiO2复合体。从图1还可以看出, 共沉淀法制备样品的衍射峰较宽、强度低,表明颗粒较小;但是沉淀浸渍法较共沉淀法制备样品的衍射峰强度要大,结晶强度要好,颗粒要大。 根据Scherrer 公式计算出共沉淀法和沉淀浸渍法制备样品的颗粒大小分别为27.34nm 和58.56nm。
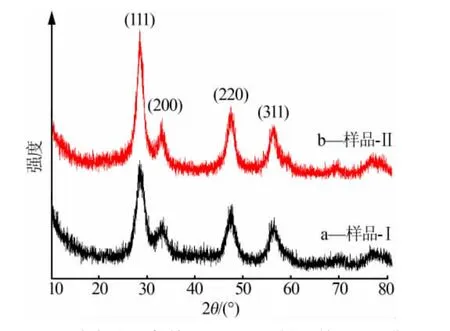
图1 两种方法制备的CeO2-SiO2 样品的XRD 谱图
2.2 SEM 形貌分析
图2为两种方法制备的CeO2-SiO2样品的SEM照片。 从图2可以看出制备的CeO2-SiO2样品为球形颗粒,共沉淀法制备的球形颗粒的粒径为20~30nm,分散性较好;沉淀浸渍法制备的球形颗粒的粒径为50~60nm,颗粒间有部分团聚。 SEM 表征结果与XRD 表征结果基本一致。这可能是由于在共沉淀法制备过程中, 高分子化合物十二胺和正硅酸乙酯起到了空间位阻效果,对颗粒间有良好的分散性,因此制备的CeO2-SiO2颗粒较小,分散性较好。

图2 两种方法制备的CeO2-SiO2 样品的SEM 照片
2.3 BET 比表面积和孔结构特性分析
表1列出了两种方法制备的CeO2-SiO2样品的比表面积、孔容和平均孔径。从表1可见,样品-Ⅰ的比表面积和孔容较大,其值分别为147.5996m2/g 和0.2338cm3/g,孔径为6.336nm;而样品-Ⅱ的比表面积、 孔容相对较小, 其值分别为112.1547m2/g 和0.2146cm3/g,孔径为17.771nm。这可能是由于沉淀过程和煅烧过程中有机分散剂受热分解时分解的温度、 释放气体和释放热量的速度及量不同导致所形成的孔结构和比表面积有差别。

表1 两种方法制备的CeO2-SiO2 样品的组织结构特性
图3为两种方法制备的CeO2-SiO2样品的孔径分布情况。 从图3可以看出,样品-Ⅰ的孔径集中在4~15nm,最可几孔径约为5.5nm;样品-Ⅱ的孔径分布不均匀,以小孔居多,最可几孔径约为13.5nm。孔结构直接受颗粒大小与分布的影响, 样品颗粒较大孔径也会较大,并且分布不均匀,孔结构直接影响吸附性能。
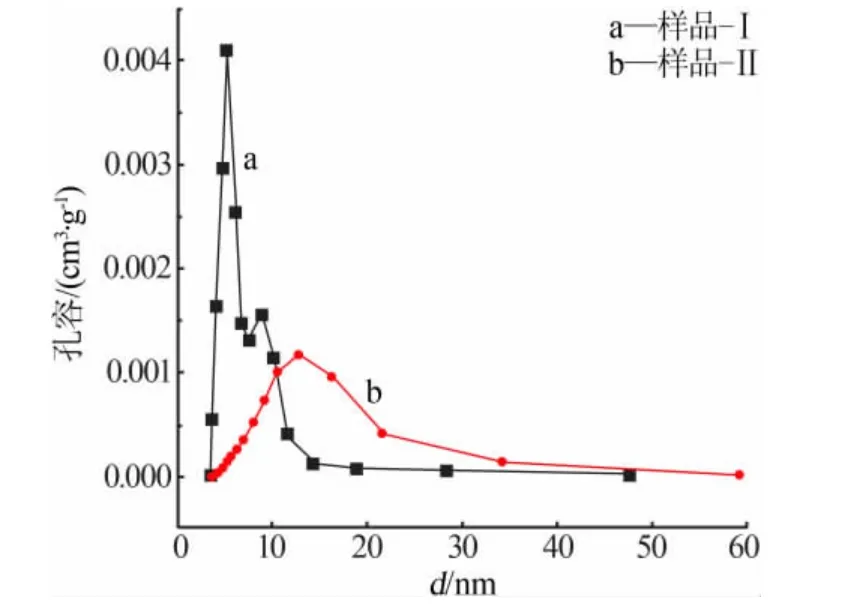
图3 两种方法制备的CeO2-SiO2 样品的孔径分布曲线
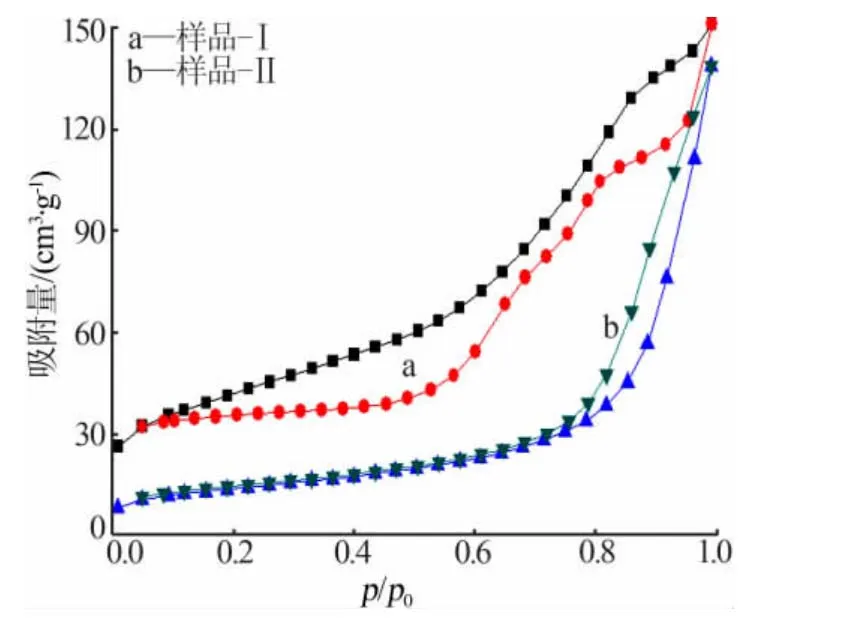
图4 两种方法制备的CeO2-SiO2的N2 吸附-脱附等温线
图4为两种方法制备的CeO2-SiO2的N2吸附-脱附等温线。 由图4可见,样品呈现出介孔材料(2~50nm)特征的吸附-脱附等温线。同时由于毛细管凝聚现象, 孔径大小形状不完全均一所导致的样品有滞后环,样品-Ⅰ的滞后环较明显,形状为瓶型;样品-Ⅱ的孔形状为夹缝型,吸附曲线在相对压力(p/p0)为0.8~1.0处的吸附量急剧上升,这可能是由于是由于样品具有较大的平均孔径, 且分布在介孔范围内。 样品-Ⅰ具有较小的孔径,比较集中的孔径分布,比表面积大,吸附-脱附能力要好,其结果与图3的孔径分布基本吻合。
2.4 吸附性能
2.4.1 pH的影响
CeO2-SiO2对Cu2+的吸附效果随溶液pH 的变化见图5。 CeO2-SiO2吸附剂用量为0.20g/L, 初始Cu2+质量浓度为20μg/mL,吸附时间为60min。从图5可以看出, 随着溶液pH 增大,Cu2+吸附率和吸附量逐渐增大然后趋于稳定。 共沉淀法制备的CeO2-SiO2(样品-Ⅰ)对Cu2+的吸附效果较好,当溶液pH为7.0时Cu2+去除率达到92.58%, 其值是沉淀浸渍法的3.17倍; 当溶液pH 为9.0时,Cu2+去除率达到97.80%。 而两步法所得CeO2-SiO2(样品-Ⅱ)对Cu2+的吸附效果较差,当溶液pH 为7.0时,Cu2+去除率只有29.67%;当溶液pH 为9.0时,Cu2+去除率为81.48%,此时溶液中有大量沉淀生成,Cu2+不是被CeO2-SiO2吸附,而是生成了沉淀。 由于共沉淀法制备的CeO2-SiO2比表面积较大、孔径小且分布均匀、孔体积较大,对目标物的吸附性好,其表面的活性位也多,所以对Cu2+的吸附效果更好。
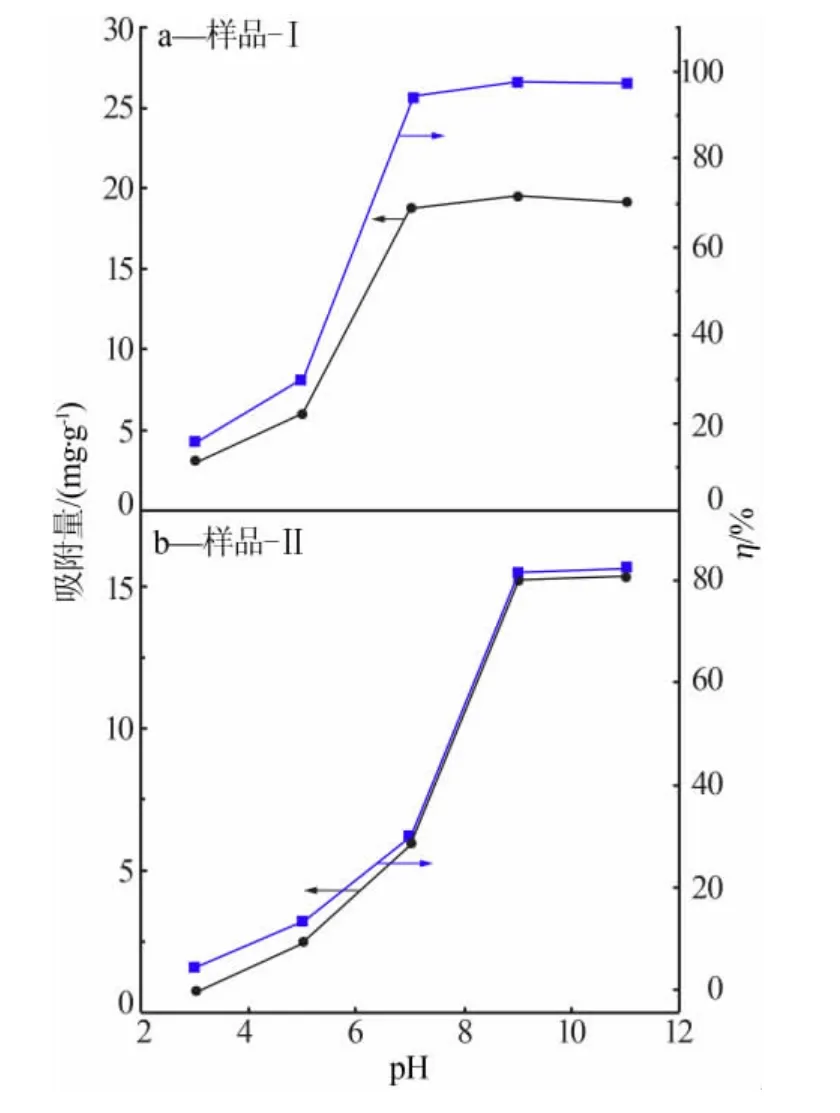
图5 溶液pH 对Cu2+吸附效果的影响
总的来说, 当溶液pH 为7.0时CeO2-SiO2对Cu2+的吸附基本达到平衡。 CeO2-SiO2吸附剂表面的电荷影响其对Cu2+的吸附性能, 而溶液pH 直接影响吸附剂表面的电荷,CeO2在酸性条件下羟基会发生质子化使吸附剂表面带正电荷M—OH2+, 该电荷会排斥吸附剂表面的Cu2+从而降低吸附速度。 CeO2在碱性条件下羟基会发生质子化使吸附剂表面带负电荷M—O-[16][见式(4)],该负电荷会吸引溶液中的Cu2+而提高吸附速度,所以随着pH 增大Cu2+吸附率和吸附量逐渐增大。
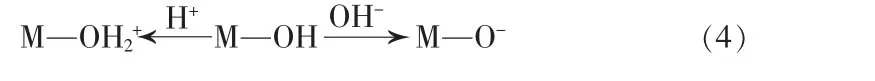
2.4.2 溶液初始Cu2+浓度的影响
图6为共沉淀法制备的CeO2-SiO2对Cu2+的吸附效果随溶液初始Cu2+质量浓度的变化曲线。CeO2-SiO2吸收剂用量为0.20g/L,吸附液pH 为7.0,吸附时间为60min。从图6可知,随着溶液初始Cu2+质量浓度增大Cu2+去除率明显降低, 但是Cu2+累计吸附量呈增大趋势。在初始Cu2+质量浓度为50μg/mL 的高浓度下,CeO2-SiO2对Cu2+的吸附量还在增加,说明吸附剂对Cu2+的吸附还没有达到饱和, 但是此时水溶液中Cu2+的去除率较低。
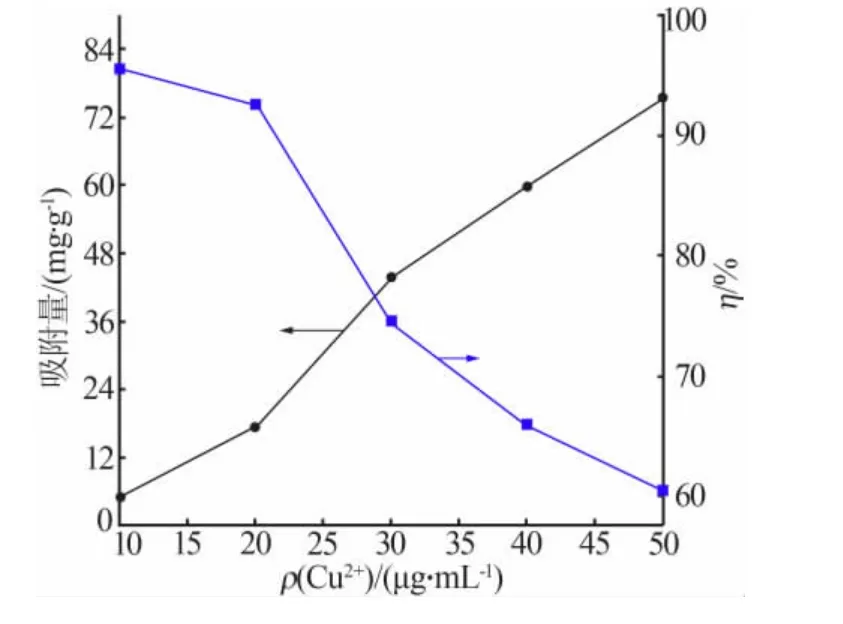
图6 溶液初始Cu2+质量浓度对Cu2+吸附效果的影响
2.4.3 吸附剂用量的影响
图7为共沉淀法制备的CeO2-SiO2对Cu2+的吸附效果随吸附剂用量的变化曲线。 溶液初始Cu2+质量浓度为20μg/mL,吸附液pH 为7.0,吸附时间为60min。 从图7可以看出,随着吸附剂用量增加Cu2+去除率增大;当CeO2-SiO2用量为0.15g/L 时Cu2+去除率达到较好状态, 之后随着吸附剂用量进一步增加Cu2+去除率变化不大。 但是, 随着吸附剂用量增加,单位质量吸附剂对Cu2+的吸附量减小,可以看出吸附剂用量过大,吸附剂表面没有得到充分利用。这可能是由于随着吸附剂用量增加,吸附面积增大,吸附活性中心增多,吸附效果越好;但是吸附剂用量进一步加大时,吸附剂颗粒间碰撞机会增加,使颗粒团聚在一起,有效吸附活性位被覆盖,吸附剂粒径逐渐增大,吸附表面积逐渐减小,吸附率下降。因此,从经济角度来看不宜采用高浓度的吸附剂用量。

图7 CeO2-SiO2 吸附剂用量对Cu2+吸附效果的影响
2.4.4 吸附时间的影响
图8为共沉淀法制备的CeO2-SiO2对不同金属离子的去除效果随吸附时间的变化。 吸附剂用量为0.20g/L,吸附液初始金属离子质量浓度为20μg/mL,吸附液pH 为7.0。 由图8a 可知,随着吸附时间延长Cu2+去除率增大; 当吸附时间为20min 时基本达到吸附平衡状态,此时Cu2+去除率为92.58%。 从图8b看出,CeO2-SiO2吸附剂对Fe2+的吸附速度较Cu2+大大降低, 吸附时间延长, 当吸附时间为100min 时CeO2-SiO2对Fe2+的吸附基本接近平衡状态,Fe2+去除率为99.13%。 由图8c 看出,CeO2-SiO2对Mn2+的吸附效果最差,当吸附时间为45min 时CeO2-SiO2对Mn2+的吸附基本接近平衡状态,Mn2+去除率只有48.63%。 这说明CeO2-SiO2适合吸附水溶液中的Cu2+,其次为Fe2+,不适宜吸附Mn2+。

图8 吸附时间对Cu2+、Fe2+、Mn2+吸附性能的影响
2.5 吸附动力学研究
用准一级动力学方程[式(5)]和准二级动力学方程[式(6)]来模拟吸附过程的控制步骤以及吸附机理[18-20],分别模拟了样品-Ⅰ吸附Cu2+的一级动力学过程、 样品-Ⅰ吸附Cu2+、Fe2+、Mn2+的二级动力学过程,拟合结果见表2。 由表2看出,吸附结果采用准一级动力学模型拟合时样品-Ⅰ吸附Cu2+过程的相关系数R2为0.4062, 并且由模型计算出的平衡吸附量与实验结果相差较大,低于实验所得的吸附值。 而采用准二级动力学模型拟合时,R2分别为0.9999、0.9976、0.9989,拟合度很好,且吸附不同离子的平衡吸附量的理论值和实验结果相差甚小,因此采用准二级吸附动力学模型适合描述CeO2-SiO2吸附重金属离子的吸附过程与机理。


表2 CeO2-SiO2 对Cu2+的准一级动力学模型及对Cu2+、Fe2+、Mn2+的准二级动力学模型
3 结论
用共沉淀法和沉淀浸渍法均可制得纳米级CeO2-SiO2介孔材料,共沉淀法制备的CeO2-SiO2具有更高的比表面积、孔容和较小的孔径,应用于废水中Cu2+的吸附有更好的去除效果。 当吸附液pH 为7.0、吸附剂用量为0.15g/L、吸附液初始金属离子质量浓度为20μg/mL、吸附时间为20min 时,共沉淀法制备的CeO2-SiO2吸附剂对Cu2+的吸附获得较好的效果。 制备的CeO2-SiO2吸附剂对Cu2+、Fe2+、Mn2+的吸附性能:Cu2+效果最好,其次为Fe2+,Mn2+的效果最差。 该吸附过程符合准二级动力学模型。
