土壤因子对棉花黄萎病拮抗菌Bacillus velezensis BHZ-29数量及抑菌活性的影响
2020-12-10党文芳李雪艳杨红梅霍向东欧提库尔李玉国史应武
党文芳,李雪艳,杨红梅,楚 敏,高 雁,曾 军,霍向东, 张 涛,林 青,欧提库尔,李玉国,娄 恺,史应武,3,4 *
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830052;2. 新疆农业科学院微生物应用研究所,新疆 乌鲁木齐 830091;3. 新疆特殊环境微生物实验室,新疆 乌鲁木齐 830091;4. 农业农村部西北绿洲农业环境重点实验室 新疆 乌鲁木齐 830091)
【研究意义】近年来,棉花黄萎病的生物防治已成为研究热点[1-2]。生防细菌因其对环境无污染、病原菌特异性强、人类和动物伤害小等优点成为生物防治中的优势菌群[3-4]。在生物防治中,由于生防微生物的生防效果受环境等多种因素的影响,使生防微生物的防效存在不稳定性[5]。棉田土壤环境的复杂性和土壤理化性质等土壤条件都将成为制约生防细菌在棉花根际土壤环境中稳定定殖的关键因素[6-9],研究土壤理化性质对生防细菌数量的影响,有助于了解生防细菌在土壤中的定殖情况,进而为生防细菌的大田应用提供理论基础。【前人研究进展】梁宏等[10]评价了在大田环境中生防菌能否在棉株根际稳定繁殖,并在根际微生物群落中是否占据优势地位决定了生防菌对棉花黄萎病的防治效果。赵鸣等[11]评价了拮抗微生物只有在活体形式下才能发挥防病作用,而拮抗微生物所处的环境条件会严重影响拮抗微生物的存活和繁殖情况,进而影响其防病效果;并且评价了不同环境条件下拮抗微生物的防病效果存在明显差异:很多微生物在灭菌土壤或温室内防病效果较好,但在田间自然土壤中防病效果却很差。有关拮抗微生物在植株内定殖及其防效研究较多,而拮抗微生物与土壤环境的相关性研究报道却很少[12-14]。高圣风等[15]研究了生防芽孢杆菌VD18R19在香草兰上定殖数量的时间动态变化, 且通过田间试验检测 VD18R19 在自然发病的条件下对香草兰根腐病的生防效果。【本研究切入点】棉花黄萎病拮抗微生物的分离以及防病机理的研究不断深入[16-19],很多研究人员也把棉花黄萎病拮抗研究方向转移到了生物防治的应用方面[20-21]。【拟解决的关键问题】以新疆农业科学院微生物应用研究所史应武团队已分离的棉花黄萎病拮抗细菌BacillusvelezensisBHZ-29为基础,旨在研究平皿条件下土壤理化性质对棉花黄萎病拮抗细菌BacillusvelezensisBHZ-29和V.dahliensis数量的影响,揭示拮抗细菌在土壤不同理化条件下的定殖能力和对V.dahliensis的抑制能力。为进一步的盆栽及大田应用提供数据支撑,为棉花黄萎病生物防治的实际应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 土样 取自乌鲁木齐安宁渠试验场灰漠土。由中国科学院新疆生态与地理研究所胡明芳老师测定该土壤的理化性质,其中有机质含量15.2 g/kg,全氮0.868 g/kg,全磷0.667 g/kg,全钾19.8 g/kg,碱解氮55.2 mg/kg,速效磷3.4 mg/kg,速效钾288 mg/kg,缓效钾1567 mg/kg,pH 8.1,CEC 16.2 mg/100g土,土壤容重平均为1.25 g/cm3。
1.1.2 供试病原菌V.dahliensis(Verticilliumdahliae)由新疆农业科学院植物保护研究所刘海洋副研究员馈赠。
1.1.3 供试拮抗菌BacillusvelezensisBHZ-29为实验室已分离筛选获得的1株棉花健康相关优势内生拮抗细菌。
1.1.4 供试培养基 NB培养基:蛋白胨10 g,牛肉浸出粉3 g,氯化钠5 g,蒸馏水1000 mL,pH 7.2±0.2。121 ℃灭菌15 min。
NA培养基:蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂15 g,蒸馏水1000 mL,pH 7.3±0.1。121 ℃灭菌15 min。
孟加拉红培养基:蛋白胨5 g,葡萄糖10 g,磷酸二氢钾1 g,MgSO4·7H2O 0.5 g,琼脂20 g,孟加拉红0.0333 g,氯霉素0.1 g。121 ℃灭菌15 min。
Czapek’s培养基:NaNO33 g,K2HPO31 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,蔗糖30 g,蒸馏水1000 mL,pH 6.5。121 ℃灭菌15 min。
1.1.5 主要试剂 0.85 %氯化钠溶液:称取0.85 g氯化钠用蒸馏水定容至100 mL。
尿素、KH2PO4、碳酸钠、重碳酸钠、氯化钠、氯化钙、氯化镁、硫酸镁、硫酸钠、盐酸、氢氧化钠。
以上试剂均为分析纯。
1.1.6 主要仪器 仪器:ZHWY-211B型落地普通型大容量全温度恒温培养振荡器(上海智诚分析仪器制造有限公司);SWCGCO型超净工作台(苏州净化设备有限公司);SPX-250BF-2型生化培养箱精密液晶型(上海福玛实验设备有限公司);YXQ-LS-75SⅡ型立式压力蒸汽灭菌器(上海博迅实业有限公司)。
1.2 方法
1.2.1 土样的灭菌、病原菌种子液制备、拮抗细菌BHZ-29种子液制备同文献[22]。
1.2.2 土壤理化性质对拮抗细菌BacillusvelezensisBHZ-29数量的影响 土壤水分对拮抗细菌BHZ-29数量的影响。试验设3个土壤水分处理,土壤相对含水率分别为 25 %、37.5 %、50 %。每个土壤含水率处理中有3个处理,不加菌、加V.dahliensis和BHZ-29、只加BHZ-29,其中不加菌为对照。每个处理重复3次。称量10,15,20 mL灭菌水于培养皿中,其中V.dahliensis3 mL,BHZ-29 1 mL,摇匀后再称取40 g土壤于培养皿中,放入28 ℃培养箱中培养,每隔10 d进行平板计数,确定V.dahliensis和BHZ-29的数量。试验开始后,每天下午6:00用称重法测定土壤容积含水量,补充当天失去的水分,使各处理保持设定的含水量。
土壤肥力对生防细菌BHZ-29数量的影响。试验设3个土壤肥力处理,分别为1 T、2 T、3 T,(由尿素和KH2PO4通过从大田中换算在培养皿中的比例混入蒸馏水中灭菌后使用)。每个肥力处理中有3个处理,不加菌、加V.dahliensis和BHZ-29、只加BHZ-29,其中不加菌为对照,每个处理重复3次。称量15 mL灭菌肥力水于培养皿中,其中加V.dahliensis3 mL,BHZ-29 1 mL,摇匀后再称取40 g土壤于培养皿中,培养方式同土壤水分处理,其中用灭菌肥力水补充当天失去的水分。
土壤盐分对拮抗细菌BHZ-29数量的影响。试验设3个土壤盐分处理,含盐率分别为 0 %、0.3 %、0.6 %(由碳酸钠、重碳酸钠、氯化钠、氯化钙、氯化镁、硫酸镁、硫酸钠 7 种盐类成分等比例混入蒸馏水中灭菌后使用)。每个盐分处理中有3个处理,不加菌、加V.dahliensis和BHZ-29、只加BHZ-29,其中不加菌为对照,每个处理重复3次。称量15 mL灭菌盐分水于培养皿中,其中加V.dahliensis3 mL,BHZ-29 1 mL,摇匀后再称取40 g土壤于培养皿中,培养方式同土壤水分处理,其中用灭菌盐分水补充当天失去的水分。
土壤pH对拮抗细菌BHZ-29数量的影响。试验设3个土壤pH处理,分别调灭菌水pH于5,7,9。每个pH处理中有3个处理,不加菌、加V.dahliensis和BHZ-29、只加BHZ-29,其中不加菌为对照,每个处理重复3次。称量15 mL灭菌水于培养皿中,其中加V.dahliensis3 mL,BHZ-29 1 mL,摇匀后再称取40 g土壤于培养皿中,培养方式同土壤水分处理,其中用已调过pH的灭菌水补充当天失去的水分。
土壤温度对拮抗细菌BHZ-29数量的影响。试验设3个温度处理,温度分别为15、20、30 ℃。每个温度处理中有3个处理,不加菌、加V.dahliensis和BHZ-29、只加BHZ-29,其中不加菌为对照,每个处理重复3次。称量15 mL灭菌水于培养皿中,其中加V.dahliensis3 mL,BHZ-29 1 mL,摇匀后再称取40 g土壤于培养皿中,放入15、20、30 ℃培养箱中培养,培养方式同土壤水分处理。
1.2.3 数据处理与分析 本研究采用SPSS Statistics 22、GraphPad Prism 6和Excel软件对数据进行分析并作图。
2 结果与分析
2.1 土壤水分含量对拮抗细菌BHZ-29数量的影响
从图1可知,在不同土壤水分含量下,棉花黄萎病拮抗细菌BHZ-29随着时间的延长均呈下降趋势。只接种棉花黄萎病拮抗细菌BHZ-29的土壤中,在土壤含水量在37.5 %时BHZ-29的数量下降趋势最缓慢,接着是土壤含水量在50 %时,而在土壤含水量在25 %的土壤中下降速度最快。从图2可知,接种棉花黄萎病拮抗细菌BHZ-29后V.dahliensis在土壤不同含水量条件下的数量均比只接种V.dahliensis的土壤中的数量高,随着时间的延长,不同土壤含水量条件下土壤中V.dahliensis数量变化呈25 % > 37.5 % > 50 %,而图1中,不同土壤含水量条件下土壤中BHZ-29的数量变化呈37.5 % > 50 % > 25 %。总体而言,接种V.dahliensis和BHZ-29两种菌后BHZ-29在不同土壤含水量条件下的数量变化较只接种棉花黄萎病生防细菌BHZ-29的土壤中BHZ-29在不同土壤含水量条件下的数量变化较慢,且根据数量变化推测在3种土壤含水量条件下土壤含水量在37.5 %左右时更适宜BHZ-29的生长。
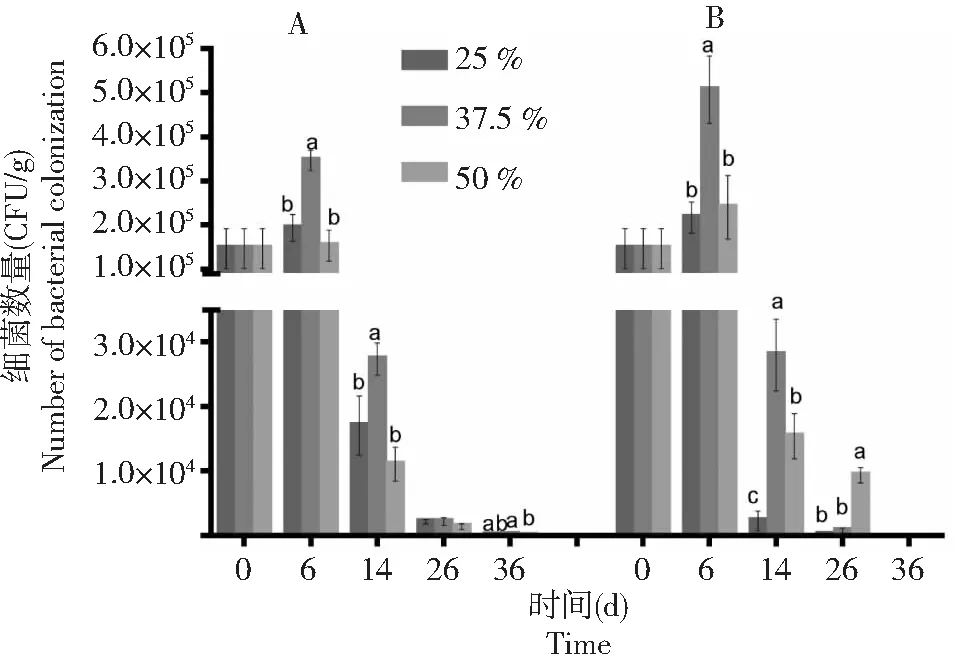
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的小写字母代表同一时间下不同处理间BHZ-29数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different lowercase letters represent significant differences in the number of BHZ-29 changes between treatments at the same time (P<0.05)图1 不同土壤水分含量下棉花黄萎病拮抗细菌BHZ-29的数量变化Fig.1 Variation of number of biocontrol bacteria BHZ-29 against cotton verticillium wilt under different soil moisture content
2.2 土壤肥力对拮抗细菌BHZ-29数量的影响
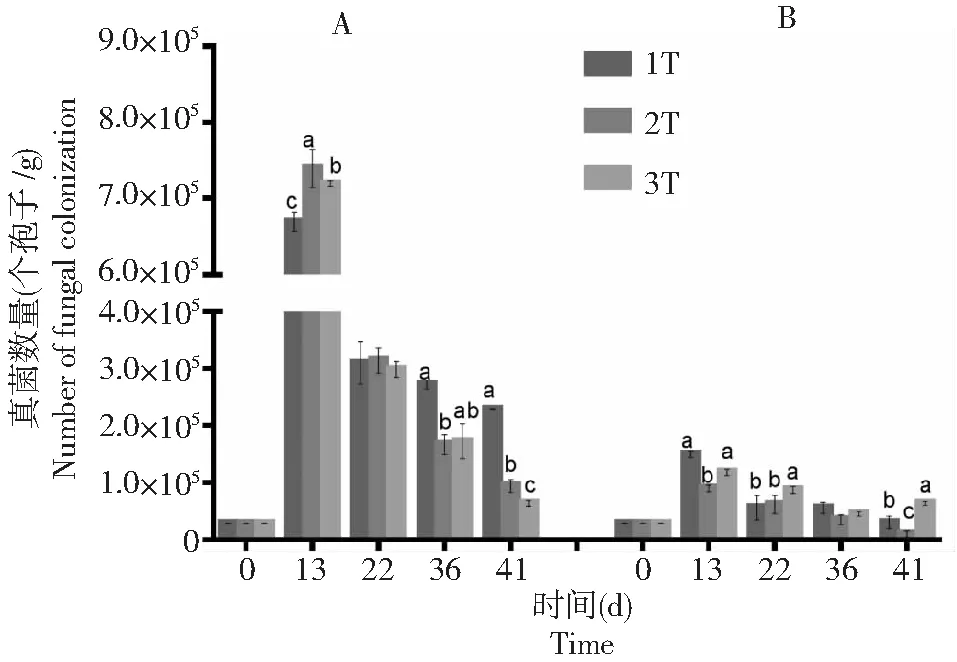
从图3可知,不同土壤肥力条件下,棉花黄萎病拮抗细菌BHZ-29随着时间的延长均呈下降趋势。只接种棉花黄萎病拮抗细菌BHZ-29的土壤中,在土壤肥力在3T时BHZ-29的数量下降趋势最缓慢,接着是土壤肥力在2T时,而在土壤肥力在1T的土壤中下降速度最快。从图4可知,接种棉花黄萎病拮抗细菌BHZ-29后V.dahliensis在土壤不同肥力条件下的数量均比只接种V.dahliensis的土壤中的数量高,随着时间的延长,在不同土壤肥力下土壤中V.dahliensis数量变化呈3T >1T >2T,而图3中,在不同土壤肥力下土壤中BHZ-29的数量变化呈3T>2T>1T。总体而言,接种V.dahliensis和BHZ-29两种菌后BHZ-29在不同土壤肥力条件下的数量变化相较只接种棉花黄萎病生防细菌BHZ-29的土壤中BHZ-29在不同土壤肥力条件下的数量变化较慢,且根据数量变化推测在3种土壤肥力条件下土壤肥力含量在3T时更适宜BHZ-29的生长。
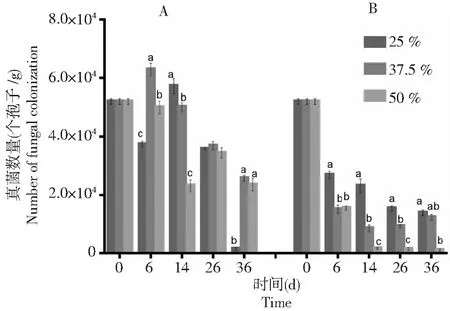
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的字母代表同一时间下不同处理间大丽轮枝菌数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different letters represent significant differences in the number of V. dahliensis changes between treatments at the same time(P<0.05)图2 不同土壤水分含量下V. dahliensis 的数量变化Fig.2 Variation of number of V. dahliensis under different soil moisture content

A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的小写字母代表同一时间下不同处理间BHZ-29数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different lowercase letters represent significant differences in the number of BHZ-29 changes between treatments at the same time (P<0.05)图3 不同土壤肥力条件下棉花黄萎病拮抗细菌BHZ-29的数量变化Fig.3 Variation of number of biocontrol bacteria BHZ-29 against cotton verticillium wilt under different soil fertility
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的字母代表同一时间下不同处理间大丽轮枝菌数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different letters represent significant differences in the number of V. dahliensis changes between treatments at the same time(P<0.05)图4 不同土壤肥力下V. dahliensis 的数量变化Fig.4 Variation of number of V. dahliensis under different soil fertility
2.3 土壤盐分对拮抗细菌BHZ-29数量的影响
由图5可知,在不同土壤盐分条件下,棉花黄萎病拮抗细菌BHZ-29随着时间的延长均呈下降趋势。只接种棉花黄萎病拮抗防细菌BHZ-29的土壤中,在土壤盐分含量在0.3 %时BHZ-29的数量下降趋势最缓慢,接着是土壤盐分含量在0.3 %时,而在无人为施加盐分的土壤中下降速度最快。从图6可知,接种棉花黄萎病拮抗细菌BHZ-29后V.dahliensis在土壤不同盐分施加下的数量均比只接种V.dahliensis的土壤中的数量高,随着时间的延长,土壤盐分含量在0.6 %的土壤中V.dahliensis数量相较土壤盐分含量在0.3 %而言,其数量较大且变化较快,而图5中,土壤盐分含量在0.3 %土壤中BHZ-29的数量相较土壤盐分含量在0.6 %而言,其数量变化较缓慢。总体而言,接种V.dahliensis和BHZ-29两种菌后BHZ-29在不同土壤盐分条件下的数量变化较只接种棉花黄萎病生防细菌BHZ-29的土壤中BHZ-29在不同土壤盐分条件下的数量变化较快,且根据数量变化推测在3种土壤盐分条件下土壤盐分含量在0.3 %更适宜BHZ-29的生长。
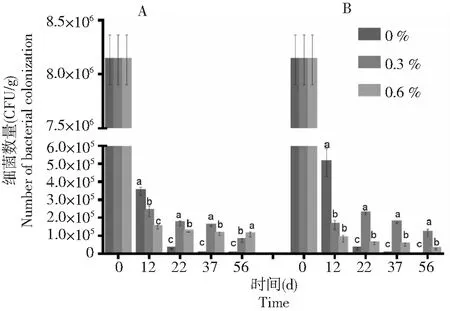
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的小写字母代表同一时间下不同处理间BHZ-29数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different lowercase letters represent significant differences in the number of BHZ-29 changes between treatments at the same time (P<0.05)图5 不同土壤盐分下棉花黄萎病拮抗细菌BHZ-29的数量变化Fig.5 Variation of number of biocontrol bacteria BHZ-29 against cotton verticillium wilt under different soil salinity
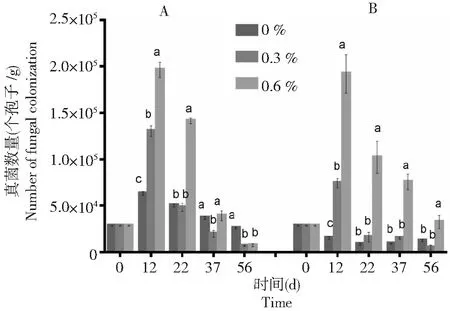
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的字母代表同一时间下不同处理间大丽轮枝菌数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different letters represent significant differences in the number of V. dahliensis changes between treatments at the same time(P<0.05)图6 不同土壤盐分下V. dahliensis 的数量变化Fig.6 Variation of number of V. dahliensis under different soil salinity
2.4 土壤pH对拮抗防细菌BHZ-29数量的影响
由图7可知,在不同土壤酸碱处理下,棉花黄萎病拮抗细菌BHZ-29随着时间的延长均呈下降趋势。只接种棉花黄萎病拮抗细菌BHZ-29的土壤中,在土壤pH 5时BHZ-29的数量下降趋势最缓慢,接着是pH 9时,而在pH 7的土壤中下降速度最快。从图8可知,接种棉花黄萎病拮抗细菌BHZ-29后V.dahliensis在土壤不酸碱处理下的数量均比只接种V.dahliensis的土壤中的数量高,随着时间的延长,pH 9的土壤中V.dahliensis数量相较pH 5而言,其数量较大且变化较快,而图7中,pH 9土壤中BHZ-29的数量相较pH 5而言,其数量变化较缓慢。总体而言,接种V.dahliensis和BHZ-29两种菌后BHZ-29在土壤不同酸碱处理下的数量变化相较只接种棉花黄萎病生防细菌BHZ-29的土壤中BHZ-29在土壤不同酸碱处理下的数量变化较缓慢,且根据数量变化推测在3种土壤酸碱处理下pH 9更适宜BHZ-29的生长,即在碱性条件下更适宜BHZ-29的生长。

A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的小写字母代表同一时间下不同处理间BHZ-29数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different lowercase letters represent significant differences in the number of BHZ-29 changes between treatments at the same time (P<0.05)图7 不同土壤pH下棉花黄萎病拮抗细菌BHZ-29的数量变化Fig.7 Variation of number of biocontrol bacteria BHZ-29 against cotton verticillium wilt under different soil pH
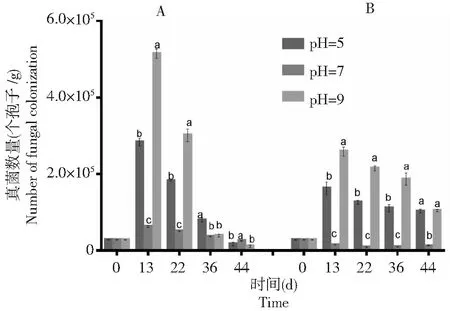
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的字母代表同一时间下不同处理间大丽轮枝菌数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different letters represent significant differences in the number of V. dahliensis changes between treatments at the same time(P<0.05)图8 不同土壤pH下V. dahliensis 的数量变化Fig.8 Variation of number of V. dahliensis under different soil pH
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的小写字母代表同一时间下不同处理间BHZ-29数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae.Different lowercase letters represent significant differences in the number of BHZ-29 changes between treatments at the same time (P<0.05)图9 不同土壤温度下棉花黄萎病拮抗细菌BHZ-29的数量变化Fig.9 Variation of number of biocontrol bacteria BHZ-29 against cotton verticillium wilt under different soil temperture
2.5 土壤温度对拮抗细菌BHZ-29数量的影响
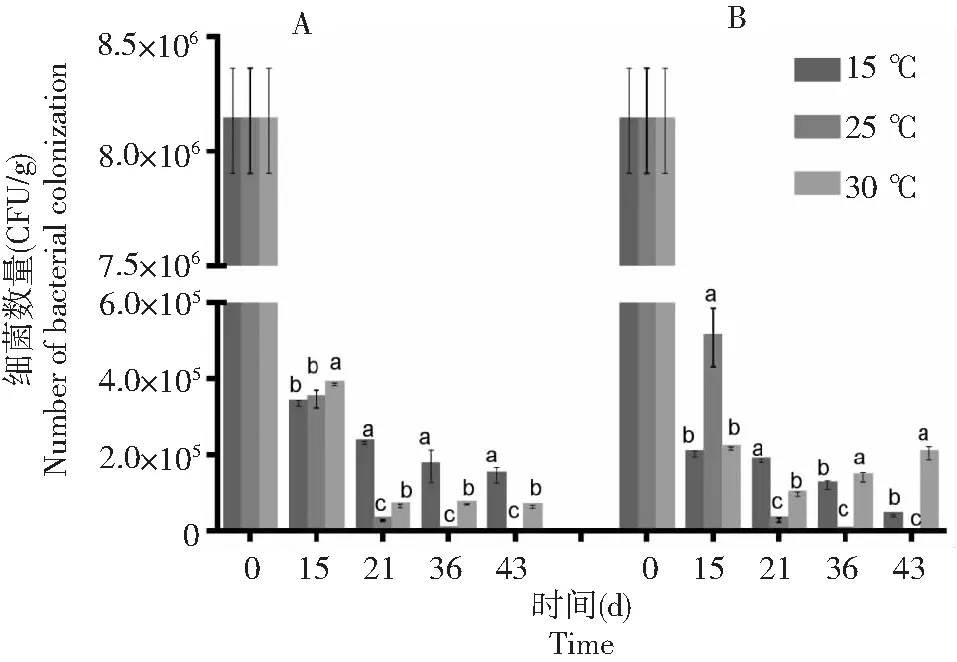
由图9可知,在不同土壤温度下,棉花黄萎病拮抗细菌BHZ-29随着时间的延长均呈下降趋势。只接种棉花黄萎病拮抗细菌BHZ-29的土壤中,在土壤温度为15 ℃时BHZ-29的数量下降趋势最缓慢,接着是30 ℃,而在25 ℃土壤中下降速度最快。结合图10棉花黄萎病V.dahliensis在土壤不同温度下的数量变化来分析接种V.dahliensis和BHZ-29两种菌后BHZ-29在土壤不同温度下的数量变化。由图10可知,随着时间的延长,25 ℃土壤中V.dahliensis数量相较30 ℃而言,其数量变化较缓慢,而图9中,30 ℃土壤中BHZ-29的数量相较25 ℃而言,其数量变化较缓慢。总体而言,接种V.dahliensis和BHZ-29两种菌后BHZ-29在土壤不同温度下的数量变化相较只接种棉花黄萎病生防细菌BHZ-29的土壤中BHZ-29在土壤不同温度下的数量变化较迅速,且根据数量变化推测在3种土壤温度中30 ℃更适宜BHZ-29的生长。
3 讨 论
生防菌能否成为较好防治棉花黄萎病的微生物菌剂,除了生防菌具备稳定性和持久性 的特点以外,更重要的是生防菌的定殖作用研究,定殖涉及了寄主植物、细菌、病原与土壤环境因子等对生防菌的影响。陈英化等[23]研究了棉花黄萎病内生拮抗细菌C-28在棉苗根部的定殖状况及其在棉花体内的传导作用。鹿秀云等[24]研究了棉花黄萎病内生拮抗细菌L-4-2在棉苗根、茎内的数量变化。目前,对于生防菌适应棉田土壤理化环境的相关报道很少,且研究较零碎,缺乏系统性。王涛等通过盆栽试验,对棉花黄萎病拮抗细菌在土壤和棉花根际、根内的定殖情况进行了分析,且指出拮抗细菌在灭菌土中的定殖数量高于自然土中的数量[25-26]。
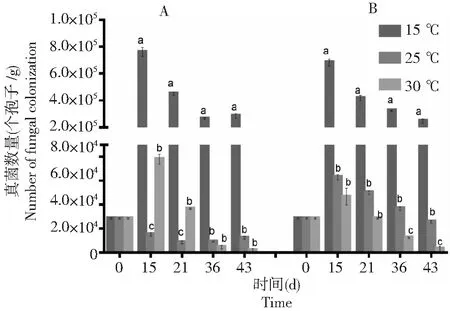
A:只施BHZ-29;B:同施BHZ-29和大丽轮枝菌。不同的字母代表同一时间下不同处理间大丽轮枝菌数量变化的差异显著(P<0.05) A: Single application of BHZ-29 bacteria; B: BHZ-29 bacteria and V. dahliae. Different letters represent significant differences in the number of V. dahliensis changes between treatments at the same time(P<0.05)图10 不同土壤温度下V. dahliensis 的数量变化Fig.10 Variation of number of V. dahliensis under different soil temperture
在实验室培养皿土壤环境中通过测量棉花黄萎病拮抗细菌BHZ-29和V.dahliensis的数量变化来进行拮抗细菌适应土壤理化环境及其抑菌活性的相关分析。为拮抗防细菌BHZ-29进一步就盆栽及棉田土壤理化环境的研究提供理论依据。
4 结 论
以实验室培养皿土壤环境为基础,进行了棉花黄萎病拮抗细菌BHZ-29在不同土壤理化条件下的定殖研究。本文初步分析了棉花黄萎病拮抗细菌BHZ-29在新疆土壤不同理化性质下的数量变化,研究结果表明:土壤理化性质对拮抗细菌BHZ-29的定殖能力影响较显著,综合分析得出棉花黄萎病拮抗细菌BHZ-29更易在土壤温度为30 ℃、相对含水量在37.5 %、土壤肥力为3T、土壤盐分含量在0.3 %、碱性土壤中定殖;且棉花黄萎病拮抗细菌BacillusvelezensisBHZ-29会使V.dahliensis在土壤中的定殖能力变弱。从拮抗细菌BHZ-29的数量变化趋势来确定拮抗细菌BHZ-29的适宜环境生长因子较单一,有待于进一步根据新疆棉田的特点来进行拮抗细菌BHZ-29的定殖能力研究。
