根癌农杆菌介导荸荠秆枯病菌转化体系构建及突变体筛选
2020-12-10黄伟华吴碧球颜梅新
黄伟华,吴碧球,颜梅新
(1.广西农业科学院生物技术研究所,广西 南宁 530007;2.广西作物病虫害生物学重点实验室/广西农业科学院植物保护研究所,广西 南宁 530007)
【研究意义】荸荠属莎草科多年生草本植物,广泛栽培于我国和印度,美国、澳大利亚和日本等国亦有种植[1-2]。荸荠球茎含有丰富的碳水化合物,可作为水果和蔬菜食用,亦可作药物用于治疗便秘、喉炎和咽炎等[3]。然而秆枯病菌(Cylindrosporiumeleocharidis)引起的荸荠秆枯病(俗称荸荠瘟)发生普遍,引起荸荠产量和品质降低,影响荸荠产业的健康发展[4-5],但迄今对该菌分子水平的研究涉及较少,对其致病机理了解甚少,影响了防治水平的提高。因此,建立荸荠秆枯病菌的遗传转化体系及构建覆盖全基因组的突变体库,对荸荠秆枯病菌的分子机理研究及其防治工作开展具有重要意义。【前人研究进展】1962年美国首次报道荸荠秆枯病,其病原菌为C.eleocharidis[4],我国江苏省于1985年首次报道荸荠秆枯病的发生[6],随后广西报道了荸荠秆枯病的发生与危害,并建立了荸荠秆枯病的发生和流行与气温、湿度、降量、露水等环境因素密切相关的预测模型[7],湖北省报道了荸荠秆枯病的发生并对该病菌进行生物学研究[8]。目前,丝状真菌遗传转化技术已成为植物病原真菌分子遗传和基因功能研究的重要手段,由农杆菌介导的真菌遗传转化技术(ATMT)已成功应用于Fusariumoxysporum、Aspergillusjaponicus、Pseudocercosporafijiensis和Sporisoriumscitamineum等丝状真菌[9-12]。农杆菌介导的真菌转化方法相比其他几种真菌转化方法(PEG-MT、REMI和基因枪等)具有转化受体可为多种类型、转化效率较高、随机单拷贝插入多及转化子稳定等优点[13]。【本研究切入点】目前,关于根癌农杆菌介导荸荠秆枯病菌遗传转化体系建立及该菌突变体库构建的研究未见报道。【拟解决的关键问题】通过建立高效的农杆菌遗传转化体系,构建该菌突变体库,并对突变体进行表型及致病性筛选,为分子水平上研究荸荠秆枯病菌的基因功能及致病机理提供技术支持和研究材料。
1 材料与方法
1.1 试验材料
供试菌株(荸荠秆枯病病原菌菌株Ceh)与双元载体pEX4(含绿色荧光蛋白GFP)均由广西农业科学院生物技术研究所实验室保存提供。
1.2 试验方法
1.2.1 潮霉素B对菌株Ceh的抑制作用 将Ceh在PDA培养基上培养5 d,利用打孔器从菌落边缘打孔,挑取直径8 mm菌块分别接种于含不同浓度潮霉素B的PDA培养基上,28 ℃培养,7 d后观察菌落的生长情况并测量菌落直径。潮霉素B设0、10、20、50、100和150 μg/mL 6个浓度处理,每处理重复3次。
1.2.2 农杆菌介导菌株Ceh遗传转化 参照Sun等[11]的方法,并作适当修改。挑取含有双元载体的根癌农杆菌单菌落,接种于加入壮观霉素(50 μg/mL)和利福平(50 μg/mL)的MM液体培养液中,在200 r/min、28 ℃下培养48 h,用IM液体培养液稀释OD600至约0.15,分别加入或不加AS,在200 r/min、28 ℃下预诱导培养6 h,测得OD600约为0.50时即可用于共培养。分别取上述农杆菌培养液和荸荠秆枯病菌孢子悬浮液各100 μl混合液涂在加入AS并覆盖了纤维素滤膜的IM固体培养基上,28 ℃下共培养24~72 h。转移纤维素滤膜至含有潮霉素B和头孢噻肟钠PDA的平板上,28 ℃下培养8~10 d,以获得转化子。将长出的单菌落用牙签挑到含有潮霉素B的PDA上进行二次筛选。
1.2.3 农杆菌转化效率影响因素优化 设不同病菌孢子浓度(105、106、107、108和109个/mL)、IM培养基pH(2.5、5、5.3、5.6、6.0、6.5和7.0)、农杆菌诱导时间(0、2、4、6、8和10 h)、共培养介质(硝酸纤维素膜、玻璃纸、定性滤纸和Hybond-N膜)、诱导共培养时AS浓度(0、100、200、300和400 μmol/L)及共培养时间(48、72和96 h)等处理,进行优化试验,以上处理均设3次重复。试验数据采用SPSS 22.0进行方差分析。
1.2.4 病原菌转化子分子检测 随机选取荸荠秆枯病病原菌转化子,采用真菌DNA提取试剂盒(OMEGA,D3690-01)提取突变体DNA。通过引物hph1 5′-GCCGATGGCTTCTACAAGGATAG-3′和hph2 5′-CTCACGATGGCATCGCACCT-3′对转化子进行PCR检测,其PCR反应程序和Southern blotting转化子验证参考Yan等的方法[14]。
1.2.5 病原菌转化子荧光检测 用接种环刮取在PDA培养基上培养15 d的病原菌Ceh,加入无菌水制成玻片,在荧光显微镜(Carl Zeiss,德国)下检测荧光。
1.2.6 病原菌突变体菌落形态分析 将野生型菌株和转化子置于PDA培养基上培养5 d,利用打孔器分别从菌落边缘打孔,挑取直径5 mm的菌饼接种至新PDA培养基上,于28 ℃培养7 d,分析菌落形态。
1.2.7 病原菌突变体致病性测试 选取15 cm长并经75 %酒精消毒的荸荠新鲜茎秆,采用离体刺伤法,按照1.2.6中的方法挑取直径5 mm的菌饼接种至茎秆伤口处,置于搪瓷盆中加湿水滤纸保湿,室温放置,7 d后观察茎秆发病情况,测量病斑面积。病原菌野生型和突变体接种处理均设3个重复。

图1 荸荠秆枯病病原菌对潮霉素B敏感性测定结果Fig.1 Sensitivity of C. eleocharidis to hygromycin B
2 结果与分析
2.1 荸荠秆枯病病原菌菌株Ceh对潮霉素B的敏感性测定结果
从图1可看出,病菌菌株Ceh在不含潮霉素B的PDA平板上培养7 d后,菌落直径平均为55 mm,而在含10 μg/mL以上潮霉素B的PDA培养基上不能生长,说明病原菌菌株Ceh对潮霉素B较敏感。为确保农杆菌转化体系的阳性转化效率,本研究确定100 μg/mL为潮霉素最佳浓度。
2.2 不同因素对农杆菌转化效率的影响
2.2.1 农杆菌与病原菌菌株Ceh共培养时间的影响 从图2可看出,农杆菌与病原菌菌株Ceh共培养48 h时平均每个培养皿(9 cm)获得20.0个转化子,共培养72 h时获得49.7个转化子/皿,而当共培养时间延长至96 h时,可获得70.3个转化子/皿。方差分析结果表明,不同共培养时间处理间的转化效率存在显著差异(P<0.05,下同)。说明共培养时间越长,农杆菌介导病原菌菌株Ceh的转化效率越高。

图柱上不同小写字母表示差异显著(P<0.05),下同 Different lowercase letters on the bar represented significant difference(P<0.05),the same as below图2 共培养时间对农杆菌转化效率的影响Fig.2 Effects of co-cultivation time for A.tumefaciens on transformation
2.2.2 IM固体培养中AS浓度的影响 农杆菌与病原菌菌株Ceh孢子等量混匀后在IM固体培养基上共培养,结果(图3)表明,当AS浓度为0时,平板上抗性菌落数为0;当AS浓度为200 μmol/mL时,获得转化子数为31.7个/皿;当AS浓度为300 μmol/mL时农杆菌转化效率达最高值,获得转化子数为56.3个/皿,当AS浓度为400 μmol/mL时获得的转化子数反而减少(52.0个/皿),但转化效率仍较高。方差分析结果表明,不同IM固体培养基中AS浓度处理间转化效率的差异显著。说明随着共培养基中AS浓度的提高,农杆菌的转化效率也相应提高,本研究以IM固体培养中AS浓度300 μmol/mL为最佳浓度。

图3 IM固体培养基中AS浓度对农杆菌转化效率的影响Fig.3 Effects of acetosyringone(AS) concentration in IM cultivation medium on transformation efficiency
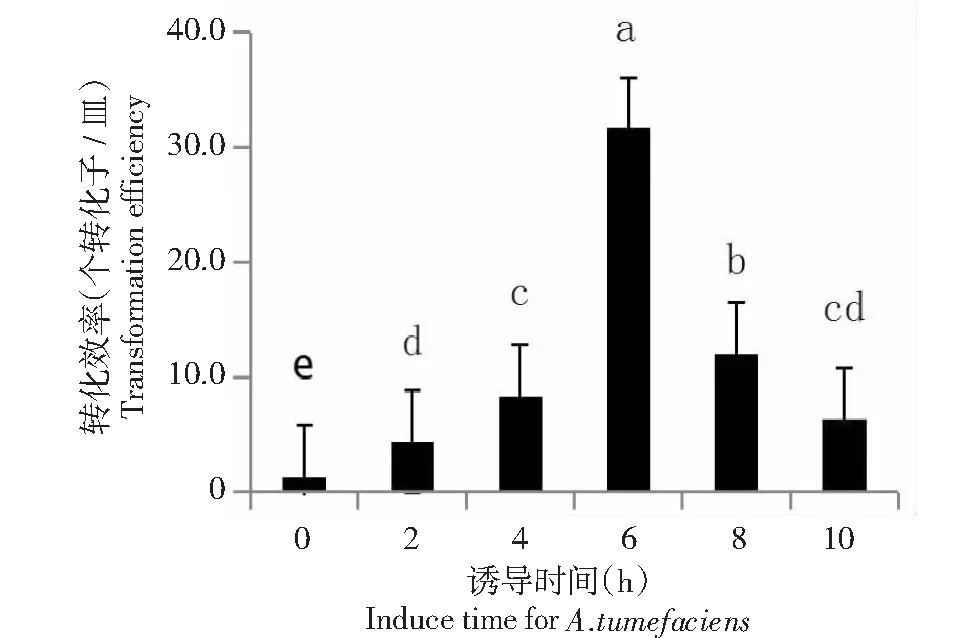
图4 农杆菌诱导时间对农杆菌转化效率的影响Fig.4 Effects of induce time for A.tumefaciens on transformation efficiency
2.2.3 农杆菌诱导时间的影响 从图4可看出,当农杆菌诱导生长6 h时病原菌菌株Ceh的转化效率最高,获得转化子数为31.6个/皿;其次是诱导8 h,可获得转化子12.0个/皿;最差的是诱导0 h,但仍可获得转化子1.3个/皿。方差分析结果表明,农杆菌诱导6 h处理的转化效率与其他诱导时间处理间的转化效率存在显著差异,诱导10 h处理与诱导2 h和4 h处理间的转化效率差异不显著(P>0.05,下同)。说明农杆菌诱导生长时间不同对病原菌菌株Ceh的转化效率存在差异,其中诱导时间为6 h对农杆菌转化效率最高。
2.2.4 病原菌菌株Ceh孢子浓度的影响 从图5可看出,农杆菌在诱导6 h时分别对105~109个/mL共5个浓度梯度的病原菌菌株Ceh孢子液进行了转化,其中孢子浓度为107个/mL的孢子液转化效率最高,可获得转化子77.7个/皿,低于或高于该浓度处理的转化率均降低。方差分析结果表明, 105~109个/mL 5个孢子浓度处理间的转化效率均存在显著差异。说明农杆菌介导荸荠秆枯病菌遗传转化的最佳孢子浓度为107个/mL。
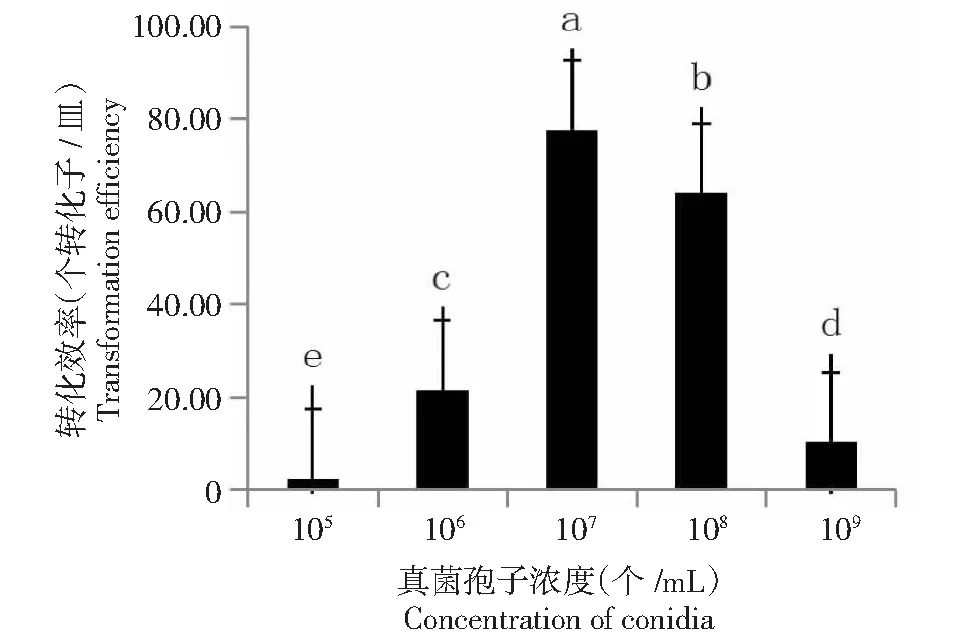
图5 荸荠秆枯病病原菌孢子浓度对农杆菌转化效率的影响Fig.5 Effects of the concentration of C. eleocharidis spore on transformation efficiency

图6 共培养基pH对农杆菌转化效率的影响Fig.6 Effects of pH in co-cultivation medium on transformation efficiency
2.2.5 共培养基pH的影响 从图6可看出,在农杆菌诱导6 h、病原菌菌株Ceh孢子浓度为107个/mL条件下,当共培养基pH为5.6时可获得转化子72.7个/皿,而pH 在6.5和7.0时未获得转化子,农杆菌转化率为0,不适合农杆菌转化;在余下所测试pH下农杆菌转化效率极低,获得的转化子数未超过12.0个/皿。方差分析结果表明,共培养基pH 5.6处理的转化效率与其他pH处理间的转化效率存在显著差异,共培养基pH 4.5、5.0、6.5和7.0处理间的转化效率差异不显著。可见,在农杆菌诱导6 h、病菌Ceh孢子浓度为107个/mL条件下共培养基pH为5.6最适宜农杆菌转化。
2.2.6 不同共培养介质对农杆菌转化效率的影响 分别使用玻璃纸、滤纸、Hybond-N膜、硝化纤维膜等4种共培养介质进行农杆菌转化。结果显示使用硝化纤维膜时转化效率最高,可获得转化子35.0个/皿,其次是使用Hybond-N膜,获转化子11.0个/皿,使用玻璃纸和滤纸的农杆菌转化效率最低,仅分别获得转化子3.0和4.6个/皿(图7)。方差分析结果表明,硝化纤维膜处理的转化效率与其他处理的转化效率均存在显著差异,Hybond-N膜处理与滤纸和玻璃纸处理的转化效率差异显著,而滤纸和玻璃纸处理间的转化效率差异不显著。说明不同滤膜对农杆菌转化效率的影响存在差异,其中硝化纤维膜作为共培养介质时农杆菌转化效率最高。

图7 不同共培养介质对农杆菌转化效率的影响Fig.7 Effects of co-cultivation substrate for A.tumefaciens on transformation efficiency
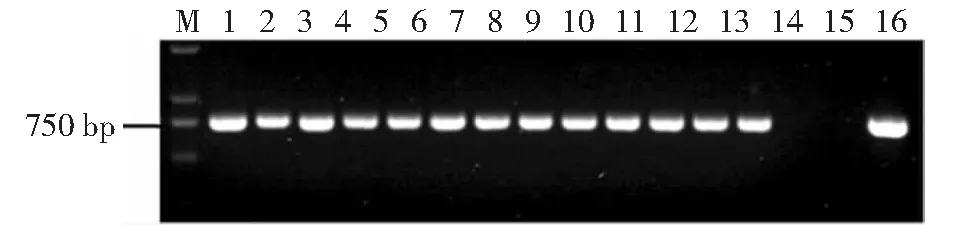
M:DNA Marker DL2000;1~13:随机挑选的荸荠秆枯病菌转化子;14:WT17即原始菌株;15:阴性对照;16:阳性对照 M:DNA marker DL2000;Lane 1-13:Randomly selectedtransformants of C. eleocharidis,Lane 14:WT17, wild type of C. eleocharidis;Lane 15:Negative control;Lane 16:Positive control图8 荸荠秆枯病病原菌转化子hph基因的PCR扩增电泳结果Fig.8 PCR detection for the presence of hph gene from randomly selected transformants of C. eleocharidis
2.3 病原菌菌株Ceh转化子的PCR验证
以双元载体pEx4上的潮霉素基因(hph)为模板设计引物hph1和hph2对转化子进行PCR扩增,结果(图8)显示转化子均能扩增出目的条带750 bp,说明T-DNA已插入荸荠秆枯病病原菌中。
2.4 病原菌菌株Ceh转化子的Southern blotting杂交验证
对随机挑选的病原菌菌株Ceh转化子及对照病原菌菌株Ceh的基因组DNA用于酶切、电泳和转膜,以hph基因片段为探针进行杂交,以检测外源T-DNA插入的拷贝数,结果(图9)发现除对照无带外,9个转化子的Southern blotting杂交结果均为阳性,进一步证实外源T-DNA片段已成功转入荸荠秆枯病菌的基因组DNA中。从图9可看出,在插入的外源T-DNA突变体中,7个突变体为单拷贝,其余2个为双拷贝,说明本研究中外源T-DNA插入的单拷贝率达77.8 %。
2.5 病原菌菌株Ceh转化子的稳定性测定结果
在所获得的病原菌Ceh转化子中随机选取10.0个,在PDA培养基上连续培养5代,再转到含有潮霉素(100 μg/mL)的PDA平板上,转化子仍能继续生长,说明插入的外源T-DNA已整合到荸荠秆枯病菌的基因组中,且能随着病原菌菌株Ceh的生长而复制。

M:1 kb marker;1~9:突变体;10:野生型菌株Ceh;11:阳性对照 M:1 kb marker;Lanes 1-9:Transformants of C. eleocharidis:Lane 10:Wild type Ceh;Lane 11:Positive control 图9 荸荠秆枯病菌转化子杂交带型分析结果Fig.9 Hybrid banding patterns analysis on transformants of C. eleocharidis
2.6 病原菌菌株Ceh转化子的荧光显微镜鉴定
将病原菌菌株Ceh转化子菌落或孢子悬浮液置于荧光显微镜下观察。从图10可看出,经农杆菌转化后的突变体在荧光显微镜紫外激发光下发出荧光(绿光),说明农杆菌的GFP基因已成功转到荸荠秆枯病原菌中并得以表达。
2.7 病原菌菌株Ceh突变体的菌落形态观察结果
通过对转化获得的6325.0个病原菌菌株Ceh转化子与野生型Ceh菌落形态进行对比,发现共有7个突变体菌落表型发生明显变化(图11),其中突变体C2 菌落形态异常(菌落形态变小),突变体C1和C3菌落颜色发生变化(由灰色变为灰白色或白色),突变体C4、C5、C7和C6菌丝密度变化明显(菌落菌丝由疏变密)。说明T-DNA的插入影响突变体形态相关基因的表达,从而导致突变体形态表现异常。
2.8 病原菌菌株Ceh突变体的致病性测定结果
本研究共测试6325.0个突变体,结果发现野生型菌株和多数Ceh突变体均能使荸荠茎秆产生水渍状病斑,同时也获得致病性缺陷突变体,其中,致病力丧失突变体4株,弱致病力突变体26株,致病力正常突变体和致病力缺陷突变体分别占总突变体数的99.53 %和0.47 %。从图12可看出,致病力丧失的突变体为C189、C625、C51和C3638;弱致病力突变体为C4281和C2367,其所致病斑面积分别为3 mm×2 mm和4 mm×3 mm,明显小于野生型菌株所致病斑面积(11 mm×5 mm)。说明以上6个突变体的致病性相关基因受到了不同程度的破坏,从而使突变体致病力丧失或降低。

A、C:紫外光条件下的荧光显微照相;B、D:明场条件下的显微照相 A,C:Fluorescence microscopy image under ultraviolet light;B,D:Fluorescence microscopy image under bright field图10 根癌农杆菌转化荸荠秆枯病菌获得的转化子荧光显微镜鉴定结果Fig.10 Fluorescence microscopy analysis of transformants of C. eleocharidis

图11 突变体与野生型Ceh菌株的菌落形态比较Fig.11 Colony morphology comparison of wild type strain Ceh1 and the mutants
3 讨 论
丝状真菌遗传转化技术是研究植物病原真菌分子遗传和基因功能的重要手段,而由农杆菌介导的真菌遗传转化技术(ATMT)已成功应用于Fusariumoxysporum、Aspergillusjaponicus、Pseudocercosporafijiensis和Sporisoriumscitamineum等丝状真菌[9-12]。农杆菌介导的真菌转化相比其他几种真菌转化方法(PEG-MT、REMI和基因枪等)具有转化受体类型多(如分生孢子、原生质体、菌丝、甚至蘑菇的菌丝体组织等)、插入随机性、阳性转化效率高及T-DNA单拷贝率高等优点[13],从而使得农杆菌转化技术成为建立覆盖全基因组突变体库的一个技术工具[10-11]。本研究运用农杆菌介导的真菌转化方法成功将含有绿色荧光蛋白(GFP)的双元载体pEX4转化到荸荠秆枯病菌野生型菌株Ceh中;通过对农杆菌转化影响因子的优化,获得最佳转化条件:共培养基中AS浓度为300 μmol/L,农杆菌诱导时间为6 h,病菌孢子浓度为107个/mL,诱导培养基pH 5.6,共培养时间为72 h,共培养滤膜为硝酸纤维素膜;通过条件优化,转化效率(转化子数)可达600~700个/107孢子。
农杆菌与病原菌混匀后进行共培养,此阶段是农杆菌将自己的T-DNA往外向病菌运输,并融合到病菌基因组DNA的过程,AS在此过程中发挥重要作用,可诱导农杆菌激活Vir基因,促进T-DNA整合到病菌基因组DNA[13,15]。本研究发现,农杆菌与病菌共培养时AS的有无是关键,在缺乏AS的情况下,未获得转化子。此外,共培养时间也是影响转化效率的重要因素,但不同真菌由于自身生长特点不同,共培养时间也存在较大差异,如在农杆菌对木霉的遗传转化中,在共培养12 h条件下未获得转化子,共培养24 h仅获得少量转化子,共培养48 h 的转化效率最高,而共培养时间高于48 h导致转化率降低[16]。而在农杆菌介导黄瓜炭疽菌的遗传转化中,用较短的共培养时间(24 ℃黑暗24 h)其转化效率反而更高。这是由于共培养时间越长,产生的菌丝越长,不容易从共培养的尼龙膜上洗掉,因而影响转化效率[17]。本研究认为,在一定的时间范围内(96 h),共培养时间越长,转化效率越高;在一定的真菌孢子浓度(107个/mL)下,共培养时间过长,转化子数量增加过多,均不利于单菌落挑取,因此本研究选择的最适共培养时间为72 h。

图12 病原菌菌株Ceh突变体离体茎秆致病性的测定结果Fig.12 Pathogenicity test of the strain Ceh mutants in vitro stem
自绿色荧光蛋白GFP出现起,GFP及其衍生物已作为标记基因被广泛应用于微生物研究领域。GFP在丝状真菌中主要有几个方面的应用:病原菌入侵寄主和致病等互作过程、调查真菌孢子中细胞核运动和分裂过程及观察病原菌调控蛋白的移位等[18-21]。本研究采用农杆菌转化方法成功将GFP基因导入荸荠秆枯病菌的基因组DNA中,因此,GFP蛋白可作为报告基因应用于荸荠秆枯病菌与寄主的互作研究中;通过多批次农杆菌转化构建突变体库,筛选表型和致病性缺陷突变体,可为突变基因克隆和功能分析提供研究材料。
4 结 论
成功建立了农杆菌介导荸荠秆枯病菌高效的遗传转化体系,并通过构建T-DNA插入突变体库,筛选得到表型和致病性缺陷突变体,可作为开展荸荠秆枯病菌基因功能和病菌与寄主互作研究的参考依据。
