高分子键合血管阻断剂与BLZ945纳米药物协同治疗肿瘤
2020-12-09汤朝晖
王 月, 沈 娜, 卫 琦, 汤朝晖
(1. 中国科学院长春应用化学研究所,长春 130022;2. 中国科学院大学,北京 100049)
血管阻断剂(VDAs)在癌症治疗中的巨大潜力引起了越来越多的关注[1-4]。康普瑞汀磷酸二钠(CA4P)是一种具有代表性的小分子血管阻断剂前药,曾进行临床III期试验,其可以选择性地靶向已建立的肿瘤脉管系统,导致肿瘤内部缺乏氧气和营养的供给,从而引发大面积肿瘤坏死[5-8]。聚(L-谷氨酸)接枝聚乙二醇单甲醚/康普瑞汀A4(C-NPs)是一种血管阻断剂纳米前药,它将CA4P的活性成分康普瑞汀A4(CA4)键合到载体上,借助纳米粒子的瘤内低渗透性,使CA4主要分布在血管周围,较CA4P具有增强的肿瘤血管靶向性;又由于CA4的作用靶点是血管内皮细胞,C-NPs的疗效显著优于CA4P[9-11]。C-NPs具有显著的抗肿瘤疗效和应用前景,然而报道表明其可导致肿瘤M2型肿瘤相关巨噬细胞(M2-TAMs)浸润[12]。M2-TAMs与不良预后相关,在肿瘤血管生成、发展、转移、免疫抑制和治疗耐药性中起着至关重要的作用[13,14]。M2-TAMs的增多,导致C-NPs治疗后肿瘤复发,限制了其应用。因此,调控M2-TAMs介导的肿瘤免疫抑制微环境,有助于提升C-NPs的抗肿瘤疗效。
BLZ945是一种高度选择性的集落刺激因子-1受体(CSF-1R)抑制剂,其通过阻断肿瘤细胞分泌的集落刺激因子-1(CSF-1)与CSF-1R的结合来降低M2-TAMs的比例[15,16]。Pyonteck等[17]报道通过BLZ945抑制CSF-1/CSF-1R信号通路能够大幅度降低M2-TAMs的数量,并促进肿瘤浸润CD8+T细胞,共同抑制肿瘤生长。因此,BLZ945有望调控肿瘤免疫微环境,增强C-NPs抗肿瘤疗效。然而,CSF-1R在肿瘤微环境中广泛表达,不仅在M2-TAMs上表达,在单核吞噬系统中大多数细胞上也高表达,使得BLZ945这种小分子CSF-1R抑制剂容易脱靶[18],甚至诱发肝脏毒性[19]。又鉴于M2-TAMs更倾向于富集在肿瘤血管周围区域[20],将BLZ945纳米化,有望提高BLZ945的肿瘤靶向能力,减小副作用,增强抗肿瘤疗效。
本文首先验证了BLZ945能够诱导M2-TAMs凋亡,并可与C-NPs协同抑制肿瘤生长。随后设计并制备了高分子键合血管阻断剂与BLZ945纳米药物(聚(L-谷氨酸)接枝聚乙二醇单甲醚/康普瑞汀A4/BLZ945,简称CB-NPs),其同样能够在肿瘤血管周围富集,释放小分子CA4破坏肿瘤血管,使肿瘤发生大面积缺血性坏死;同时,在肿瘤血管周围释放BLZ945,诱导由CA4导致浸润增多的M2-TAMs的凋亡,降低肿瘤内M2-TAMs数量,逆转免疫抑制微环境,进而协同治疗肿瘤。因此,CB-NPs纳米药物在提高BLZ945的肿瘤靶向能力的同时,增强了其协同抗肿瘤能力,为血管阻断剂的联合抗肿瘤治疗提供了理论基础。
1 实验部分
1.1 原料和试剂
通过文献[21]的方法制备聚(L-谷氨酸)接枝聚乙二醇单甲醚;CA4:化学纯,杭州瑞树生化有限公司;BLZ945:实验纯,上海笔昔化工有限公司;4-二甲基氨基吡啶(DMAP):化学纯,中国阿拉丁试剂有限公司;2,4,6-三氯苯甲酰氯:实验纯,天津市希恩思生化科技有限公司;N,N′-二异丙基碳二亚胺(DIC):化学纯,北京伊诺凯科技有限公司。
细胞培养基、培养试剂购自BI和Gibco公司;重组小鼠白细胞介素4(IL-4)购自PeproTech(美国)生物科技有限公司;凋亡试剂盒购自大连美仑生物技术有限公司;FITC标记的抗小鼠CD206和PerCP/Cy5.5标记的抗小鼠F4/80抗体购自美国BD公司;雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 C-NPs的制备
C-NPs的合成路线如图1所示。首先,通过聚谷氨酸(PLG)和聚乙二醇单甲醚(mPEG5k-OH)的Steglich酯化反应制备 PLG-g-mPEG。具体方法为:将 PLG(0.413 g,0.02 mmol)和 mPEG5k-OH(1.239 g,0.248 mmol)溶解在 25 mL 二甲基甲酰胺(DMF)中,然后将 DIC(93.67 mg,0.74 mmol)和 DMAP(10 mg,0.82 mmol)加入到反应体系中。上述混合物在25 ℃下反应72 h后,将溶液用过量的冰乙醚沉降,并用乙醚洗涤2次。最后,将沉降物用蒸馏水透析(透析膜的截留分子量MCWO = 3 500)3 d,冷冻干燥后获得PLG-g-mPEG。通过酯化反应将CA4键合到PLG-g-mPEG上。具体实验方法为:将PLG-g-mPEG(900 mg)溶解于30.0 mL无水DMF中,然后将 2,4,6-三氯苯甲酰氯(330 mg,1.35 mmol)和三乙胺(TEA)(140 mg,1.39 mmol)加入其中溶解,搅拌20 min 后,将溶解于 10 mL 无水 DMF 的 CA4(215 mg,0.68 mmol)和 DMAP(100 mg,0.82 mmol)加入其中,在60 ℃下反应4 h。反应混合物用过量的冰无水乙醚沉降,将沉降物重新溶解在DMF中,并用蒸馏水透析48 h,冻干后获得最终产物C-NPs。

图1 C-NPs的合成路线Fig. 1 Synthetic routes of C-NPs
1.3 CB-NPs的制备
CB-NPs的合成路线如图2所示。通过酯化反应将CA4和BLZ945共同键合到PLG-g-mPEG上。具体方法为:将 PLG-g-mPEG(500 mg)溶于 15 mL无水 DMF中,再依次加入 2,4,6-三氯苯甲酰氯(213 mg,0.87 mmol)和三乙胺(83 mg, 0.83 mmol),反应 20 min 后将溶于 10 mL 无水 DMF 中的 CA4(80 mg, 0.25 mmol)、BLZ945(75 mg, 0.19 mmol)和 DMAP(64 mg, 0.53 mmol)加入到上述反应体系中,在 60 ℃ 条件下反应 4 h。反应结束后用过量无水乙醚对反应混合物进行沉降。沉降产物在DMF中复溶,用蒸馏水透析(MWCO = 3 500)72 h,冷冻干燥后得到最终产物CB-NPs。
1.4 CA4和BLZ945载药量测试
首先用0.1 mol/L NaOH溶液将CB-NPs完全水解,然后用1.4 mol/L H3PO4溶液进行中和,利用高效液相色谱测定其中CA4和BLZ945的质量分数(载药量)。
1.5 细胞培养
小鼠单核巨噬细胞白血病细胞(RAW264.7)用胎牛血清体积分数为10%的1640培养基进行培养;小鼠结肠癌细胞(C26)用含有10%(体积分数)胎牛血清、50 U/mL青霉素和50 U/mL链霉素的高糖DMEM培养基进行培养;所有细胞放置于含5%(体积分数)二氧化碳和95%(体积分数)空气(其中 O2的体积分数约20%)的37 ℃无菌培养箱中培养。

图2 CB-NPs的合成路线Fig. 2 Synthetic routes of CB-NPs
1.6 细胞凋亡分析
利用凋亡试剂盒检测BLZ945对RAW264.7细胞的毒性。将RAW264.7细胞置于6孔板中(每孔1×105个细胞),使其达到50%的细胞融合度。然后将培养基换成无血清1640培养基并用100 ng/mL重组小鼠IL-4刺激细胞24 h,当融合度达到80%时将细胞分为两组:一组作为对照组正常培养;另一组加入67 nmol/L的BLZ945孵育12 h,用磷酸缓冲盐溶液(PBS)洗涤收集细胞。根据细胞凋亡检测试剂盒的说明,用Annexin VFITC和Propidium iodide(PI)进行细胞染色,室温避光孵育15 min,利用流式细胞仪进行染色分析,使用FlowJo软件进行数据分析。
1.7 流式细胞分析
将原始RAW264.7细胞接种于6孔板中,每孔1×105个细胞,使其达到50%的细胞融合度。然后将培养基换成无血清1 640培养基并用100 ng/mL重组小鼠IL-4刺激细胞24 h。IL-4刺激后,加入含有BLZ945(67 nmol/L)的1 640培养基孵育12 h。药物作用结束后收集细胞,分别用CD206和F4/80抗体对细胞进行染色,利用流式细胞仪进行染色分析,使用FlowJo软件进行结果分析。
1.8 体内抑瘤评价
C-NPs与小分子BLZ945联用增强C-NPs的抗肿瘤疗效验证:将2.0×106个C26细胞接种在雌性BALB/c小鼠(体重约18 g,6~8周龄)右下腹部,构建小鼠结肠癌肿瘤模型。当肿瘤生长至约220 mm3时,将小鼠随机分为 4组:⑴ PBS;⑵ C-NPs(30 mg/kg的 CA4用量);⑶ C-NPs(30 mg/kg的 CA4用量+ BLZ945(5 mg/kg腹腔注射));⑷ C-NPs(30 mg/kg的 CA4用量+BLZ945(5 mg/kg瘤内注射))。每组 5 只 BALB/c小鼠 C-NPs最初通过尾静脉注射(i.v.)入小鼠体内,BLZ945分别在第0~4 d通过腹腔注射(i.p.)或瘤内注射(i.t.)。
高分子键合血管阻断剂与纳米药物CB-NPs的体内抗肿瘤疗效验证:利用上述C26小鼠结肠癌肿瘤模型,当肿瘤生长至约410 mm3时,将小鼠随机分为5组:⑴ PBS;⑵ BLZ945;⑶ C-NPs(30 mg/kg的CA4用量);⑷ C-NPs(30 mg/kg的 CA4用量+ BLZ945(24 mg/kg腹腔注射));⑸ CB-NPs(30 mg/kg的 CA4用量+24 mg/kg的BLZ945用量),每组5只BALB/c小鼠在t = 0,6 d进行给药。
上述抑瘤评价利用游标卡尺测量肿瘤体积,通过测量肿瘤体积和小鼠体重,评估治疗效果和药物安全性,通过以下公式计算肿瘤体积(V)和肿瘤抑制率(TSR):

其中:a和b分别表示使用游标卡尺测量的最长和最短肿瘤直径;V0、Vx分别表示对照组和治疗组的平均肿瘤体积。
当肿瘤体积超过2 000 mm3时,对小鼠实施安乐死。使用GraphPad Prism 8.0软件进行结果分析。
1.9 测试与表征
使用德国Bruker公司AVANCE 300M核磁共振波谱仪测定核磁共振氢谱(1H-NMR);傅里叶变换红外图谱(FT-IR)由Bio-Rad Win-IR红外光谱仪测定;动态光散射(DLS)由WyattQELS仪器通过垂直偏振He-Ne激光在90°条件下进行检测得到,测试的温度为25 ℃;流式细胞仪为默克密理博公司的guava easyCyte 6-2L型;高效液相色谱使用Waters 1 525泵,Waters Symmetry® C18分析柱,Waters 2 489 UV/Visible detector检测器,检测波长为305 nm,流动相为乙腈-水(体积比为4∶1),流速为1.0 mL/min。
1.10 数据分析
使用GraphPad Prism 8.0软件进行统计分析。所有实验至少重复3次,结果表示为平均值±标准偏差(SD)或平均值±标准误差(SEM)。使用one-way ANOVA分析含有多个组的数据之间的统计学差异,使用Student's t test分析了只有两组的数据之间的统计学差异。* p <0.05被认为具有统计学意义,** p <0.01被认为具有高度统计学意义,*** p <0.001被认为具有极显著统计学意义。
2 结果与讨论
2.1 C-NPs的表征
PLG-g-mPEG的1H-NMR谱图见图3。图中在化学位移3.55处的信号峰属于PLG-g-mPEG的亚甲基质子(-CH2-CH2-O-,f);C-NPs的1H-NMR 谱图中,在化学位移 6.52(k),6.38(m)和 6.21(l)处的信号峰归属于C-NPs中CA4的质子,计算得到有51个谷氨酸链节键合上CA4,其载药量(质量分数)为16.8%。GPC谱图(图 4(a))显示聚合物的数均分子量: Mn(C-NPs)>Mn(PLG-g-mPEG),证明 CA4 成功键合到 PLG-g-mPEG 上面。DLS 测得 C-NPs在水溶液中的流体力学半径(Rh)为(49 ± 16) nm(图 4(b))。

图3 PLG-g-mPEG和C-NPs在重水-氘氧化钠中的1H-NMR谱图Fig. 3 1H-NMR spectra of PLG-g-mPEG and C-NPs in D2O-NaOD
2.2 BLZ945有效诱导M2型巨噬细胞凋亡
BLZ945对巨噬细胞的抑制增殖效果评价结果见图5。首先,用IL-4刺激RAW264.7细胞使其分化为M2-TAMs。利用67 nmol/L的BLZ945处理RAW264.7细胞,RAW264.7细胞中Annexin V-FITC和PI阳性细胞的数量明显增加(Q1区域的细胞为坏死细胞,也可能包含有少数晚期凋亡细胞以及机械损伤细胞;Q2区域为晚期凋亡的细胞;Q3区域为早期凋亡细胞;Q4区域为活细胞)(图5(a)),表明BLZ945显著诱导M2-TAMs的凋亡(图5(b))。接着,用67 nmol/L的BLZ945对刺激分化后的RAW264.7细胞进行刺激处理并进行流式染色分析,从图5(c)中观察到F4/80和CD206双阳性细胞(M2-TAMs)的明显减少(Q1区域为CD206+F4/80-细胞,Q2区域为CD206+F4/80+细胞,Q3区域为F4/80+CD206-细胞,Q4区域为CD206-F4/80-细胞),证明BLZ945可以显著降低M2-TAMs的比例(图5(d))。以上数据表明BLZ945可以抑制M2-TAMs的增殖从而降低M2-TAMs的比例,有望对C-NPs治疗后引起的免疫抑制微环境进行调控,从而增强血管阻断剂纳米药物的抗肿瘤疗效。

图4 (a)PLG-g-mPEG 和 C-NPs的 GPC 谱图;(b)C-NPs的 DLS 曲线Fig. 4 (a)GPC curves of PLG-g-mPEG and C-NPs;(b)DLS curve of C-NPs

图5 BLZ945抑制细胞增殖:(a)流式细胞术分析BLZ945处理RAW264.7细胞12 h后的细胞凋亡;(b)定量分析药物作用后凋亡的细胞比例(n=3);(c)流式细胞术分析BLZ945处理后巨噬细胞上F4/80+CD206+的表达;(d)定量分析流式细胞术数据(n=3)Fig. 5 BLZ945 efficiently inhibited cell proliferation: (a)Cell apoptosis analysis of RAW264.7 cells after treated with BLZ945 for 12 h by flow cytometry; (b)The quantification analysis of the apoptotic cells after treatment(n = 3); (c)Flow cytometry demonstrating expression of F4/80+CD206+ on the macrophages after BLZ945 treatment; (d)The quantification analysis of flow cytometry data(n = 3)
2.3 C-NPs与BLZ945联合抗肿瘤疗效评价
按图6(a)的给药方案在体内评价C-NPs和BLZ945联合治疗效果。如图6(b)所示,C-NPs与不同给药方式的BLZ945联合治疗对肿瘤体积的抑制效果均明显优于C-NPs单一疗法,有效减缓了肿瘤的生长。表1给出了由图6(b)得到的肿瘤初始体积(V0)和治疗第10 d时的体积(V10)以及TSR数据结果。给药后第10 d,C-NPs与腹腔注射BLZ945或瘤内注射BLZ945联合治疗肿瘤抑制率分别达到55.6%和74.1%。图6(c)显示C-NPs治疗后小鼠的体重略有下降,但一旦完成治疗即可恢复正常,并且联合治疗组的小鼠体重与单独治疗组并无明显差异。这些结果表明C-NPs与BLZ945具有协同治疗效果,能够显著抑制肿瘤生长。

图6 C-NPs与BLZ945在C26荷瘤BALB/c小鼠上的抗肿瘤联合治疗:(a)C26肿瘤模型的治疗方案;药物治疗后(b)肿瘤体积和(c)体重变化Fig. 6 In vivo antitumor efficacy of C-NPs and BLZ945 on BALB/c mice bearing C26: (a)The treatment regimen of subcutaneous C26 tumor model; (b)Tumor volume and (c)change of body mass(n = 5) after drug treatment

表1 不同药物治疗起始肿瘤体积约为220 mm3的C26荷瘤小鼠10 d后的肿瘤抑制率Table 1 Tumor suppression rate in C26 tumor-bearing mice with initial tumor volume of 220 mm3 treated with different formulations on the tenth day
2.4 CB-NPs的表征
图7 为 CB-NPs的1H-NMR 谱。谱图中化学位移在 8.28(t)、7.91(s)、7.33(r)处的信号峰归属于 CB-NPs中BLZ945的苯环氢原子峰。另外,在图8(a)CB-NPs的FT-IR谱图中,1 591 cm-1处的特征峰对应于CB-NPs中BLZ945的C = N红外拉伸振动。通过元素分析结果表明,CB-NPs中硫的总质量分数为0.674%,证明CBNPs的确键合上了BLZ945。以上数据证明了CB-NPs的成功制备。图8(b)结果表明CB-NPs在水溶液中的流体力学半径为(56 ± 19) nm,证明其可以在水中自组装形成纳米粒子;通过HPLC(图8(c))测得的CB-NPs中CA4的载药量为10.7%,BLZ945的载药量为8.4%。
2.5 CB-NPs的体内抑瘤评价
图9(a)为CB-NPs抗C26小鼠结肠癌肿瘤的给药方案。如图9(b)所示,与PBS组相比,小分子BLZ945以及C-NPs组的肿瘤生长都受到轻微抑制,单药治疗效果受限。在相同剂量下,C-NPs与BLZ945联合治疗组和上文结果一致,表现出一定的抑制肿瘤生长能力。CB-NPs提高了BLZ945靶向血管周围M2-TAMs的能力,因此相比于与小分子BLZ945与C-NPs联合组表现出明显抑制肿瘤生长的能力。如表2所示,CB-NPs在给药第10 d对初始体积约为410 mm3的肿瘤抑瘤率达到79%。图9(c)进一步通过小鼠体重来评估药物的全身毒性,从中可以看出,与PBS组相比,药物治疗组早期体重略微下降,治疗结束后,由于肿瘤负荷的减小,小鼠体重逐渐恢复。以上结果表明,CB-NPs纳米药物提高了BLZ945的肿瘤靶向能力,减弱了CA4治疗引起的肿瘤免疫抑制微环境,增强了其与CA4协同抑制肿瘤生长的能力。因此,CB-NPs纳米药物为血管阻断剂治疗实体瘤提供了一种有潜力的联合治疗策略。
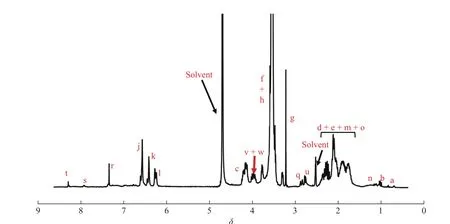
图7 CB-NPs在重水/氘氧化钠/氘代二甲基亚砜中的1H-NMR谱图Fig. 7 1H-NMR spectra of CB-NPs in D2O/NaOD /DMSO-d6

图8 CB-NPs的表征:(a)PLG-g-mPEG、C-NPs和 CB-NPs的红外光谱谱图;(b)CB-NPs的 DLS 曲线;(c)CB-NPs以及CA4+BLZ945的HPLC谱图Fig. 8 Characterization of CB-NPs: (a)FT-IR spectra of PLG-g-mPEG、C-NPs and CB-NPs; (b)DLS curve of CB-NPs; (c)HPLC spectra of CA4+BLZ945 and CB-NPs

图9 CB-NPs在C26荷瘤BALB/c小鼠上的抗肿瘤治疗:(a)C26肿瘤模型的治疗方案;药物治疗后(b)肿瘤体积和(c)体重变化Fig. 9 In vivo antitumor efficacy of CB-NPs on BALB/c mice bearing C26: (a)The treatment regimen of subcutaneous C26 tumor model;(b)Tumor volume and (c)change of body mass after drug treatment

表2 不同药物治疗10 d后C26荷瘤小鼠的肿瘤抑制率Table 2 Tumor suppression rate in C26 tumor-bearing mice treated with different formulations on the tenth day
3 结 论
(1)BLZ945能够诱导M2-TAMs凋亡,并选择性降低M2-TAMs比例。
(2)血管阻断剂纳米药物C-NPs与小分子BLZ945联合治疗,相比于单一治疗组抗肿瘤疗效提高。
(3)通过山口酯化方法制备了高分子键合CA4与BLZ945纳米药物CB-NPs。
(4)与单药联合组相比,CB-NPs纳米药物对初始体积较大的肿瘤生长具有更显著的抑制效果。