干旱胁迫对4种木兰科树种生理特性的影响
2020-12-08李娇婕廖天柱曹基武
马 斌,张 娅,吴 毅,李娇婕,廖天柱,曹基武
(中南林业科技大学 林学院,湖南 长沙 410004)
干旱是我国最主要的农业气象灾害之一,也是制约林业发展的全球性问题。在全球变暖的气候背景下,极端天气所造成的气候灾害事件频发,干旱受灾区域逐渐由我国北部地区向南部地区蔓延。如何提高植物对干旱环境的适应性一直以来都是生态学专家研究的热点,同时也是我国生态文明建设迫切需要解决的难题。干旱是限制木兰科树种推广应用最主要的逆境因素,由于这些地区水资源匮乏,限制了以灌溉途径提高推广面积,因此,提高品种的抗旱性成为木兰科育种的一个重要目标。缺少种质资源的抗旱性、形态、生理生化特性等抗旱性状信息,使木兰科抗旱育种工作进展缓慢。因此,深入研究不同种的抗旱性,鉴定抗旱相关性状及不同种的抗旱机制,成为抗旱育种的重要前提。武当木兰为落叶乔木,主产我国湖北、四川、陕西、甘肃以及河南等省区,以其生长迅速、适应性强、分布广、寿命长等优势,加之树姿雄伟、花色鲜艳、芳香四溢、材质优良等特点,成为城市绿化的重要树种[1]。乐昌含笑叶密浓绿,树姿优美,花果期长,在长江以南地区广泛种植。红花木莲树形高大、姿态优美、花繁实累、色彩鲜明,具有浓郁的芳香等,是一种优良的绿化树种,树形优美、树干通直、花大而美[2]。乐东拟单性木兰不仅为我国特有物种,而且具有极高的观赏和用材价值[3]。目前还未见干旱胁迫对这4 种树种生理特性影响的报道。采用盆栽试验和自然干旱处理获得多级土壤干旱胁迫梯度的方法,测定了4 个树种在不同程度土壤干旱下6个生理生化指标的变化。研究目的:1)明确4 个树种在不同程度干旱胁迫下主要生理生化指标水平的变化过程及其差别;2)从生理生化角度探索4 个树种的生理变化与土壤水分的定量关系及其抗旱能力与潜在机制,为深入了解4 个树种的抗旱生理生态特征、抗旱机理和能力提供参考。
1 材料与方法
1.1 试验材料
本次所进行试验的木兰科植物包括武当木兰Magnolia sprengeri、红花木莲Manglietia insignis、乐昌含笑Michelia chapensis和乐东拟单性木兰Parakmeria lotungensis,研究对象涵盖地域比较广泛,主要分布于长江以南地区,西南部以及南部,北方也有栽培。4 种木兰科植物均栽植于中南林业科技大学实验苗圃,为1年生实生苗,平均株高为25 cm,且生长状况良好。
1.2 试验方法
1.2.1 土壤干旱处理
2018年10月初将试验用的木兰科植物盆栽苗木移入室内,共设置4 个干旱胁迫处理,各处理的土壤相对含水量(土壤含水量占土壤田间持水量的百分数)分别为80%(T1)、60%(T2)、40%(T3)和20%(T4),以土壤相对含水量为100%作为对照处理(CK),每个处理12 盆,每种植物共60 盆,4 种植物共240 盆。10月下旬所有试验盆土均达到设定含水量后开始控水,每日12:00 称重,并补充当日失去的水分,以保持各处理所设定的土壤含水量。50 d 后测定各项生理生化指标。
1.2.2 指标测定
根冠比指植物地下部分与地上部分的鲜质量或干质量的比值;叶绿素含量采用80%丙酮浸提,分光光度法测定;可溶性蛋白含量采用考马斯亮蓝染色法,595 nm 比色。丙二醛(MDA)采用硫代巴比妥酸比色法;过氧化物酶(POD)活性的测定采用用愈创木酚法;过氧化氢酶(CAT)的测定采用紫外线吸收测定法。
1.3 数据分析与作图
采用Excel 2016 软件进行数据统计和绘图,应用SPSS 22.0 分析软件进行方差分析。
2 结果与分析
2.1 干旱胁迫对4 种木兰科植物根冠比的影响
土壤中常有一定的可用水,所以根系相对不易缺水。而地上部分则依靠根系供给水分,又因枝叶大量蒸腾,所以地上部水分容易亏缺,因此土壤水分不足对地上部分的影响比对根系的影响更大,植物根冠比的大小反映了植物地下部分与地上部分的相关性[4]。通过表1可以看出,随着干旱胁迫环境的的持续恶化,在T1、T2、T3梯度时,4 种木兰科植物的根冠比呈上升趋势,并且每种植物的变化趋势差异不显著(P>0.05)。在T4 梯度时,植物的根冠比明显高于对照组,差异显著(P<0.05)。其中武当木兰表现为上升最快,相对于CK 组上升188%,并在T4 梯度达到最高点。乐昌含笑在根冠比中其涨幅最低,相对于CK 组上升26%。由表得知,乐昌含笑的抗旱性相对较强,武当木兰的抗旱性相对较弱。
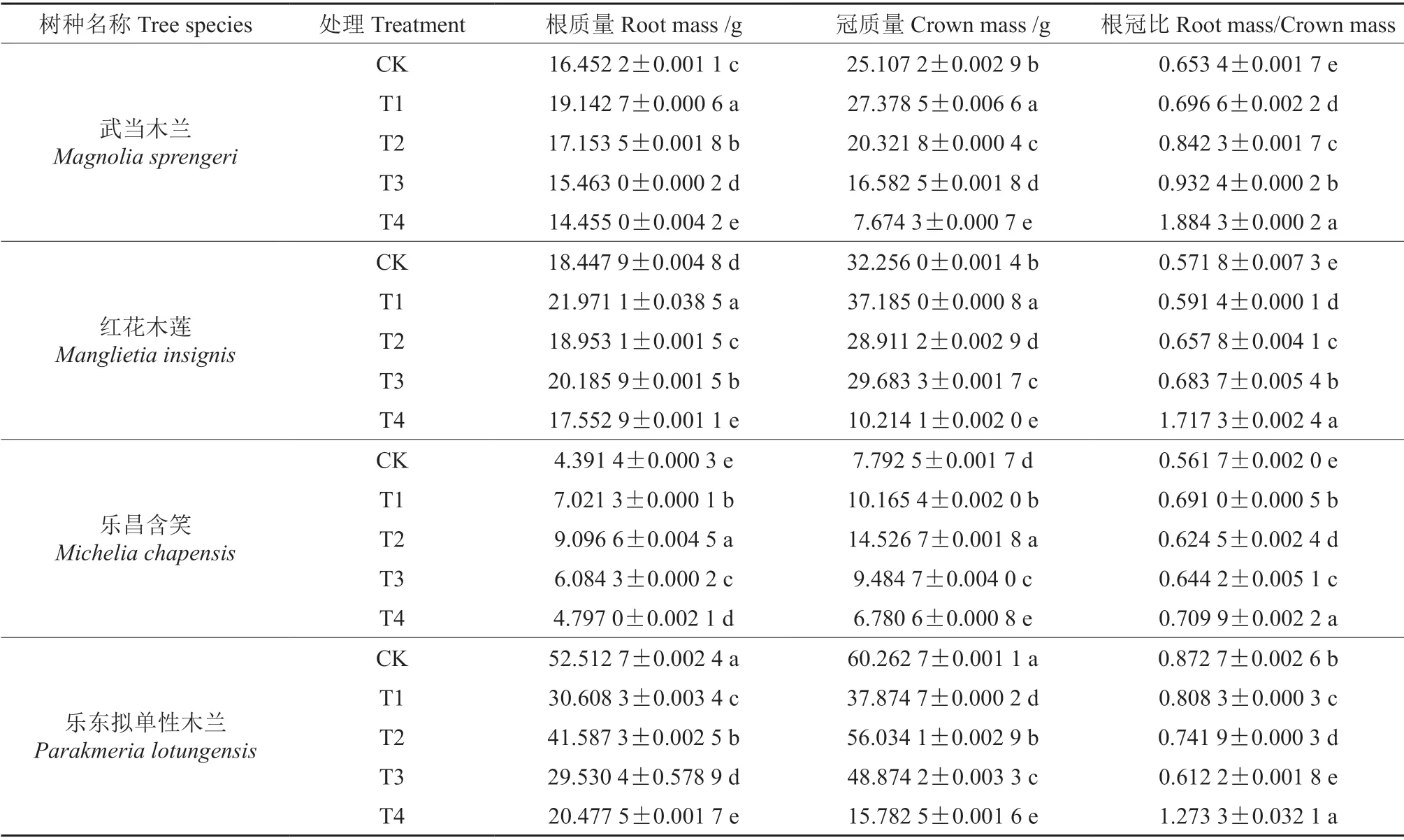
表1 干旱胁迫下根冠比的变化†Table 1 Changes of fresh weight root-shoot ratio under drought stress
2.2 干旱胁迫对4 种木兰科植物叶绿素的影响
由表2可知,随着干旱胁迫环境的恶化,4 种木兰科植物的叶绿素含量均表现出下降的趋势。在T2 梯度时,乐昌含笑的叶绿素含量水平呈上升趋势,达到其最高值后迅速下降,与其余3 种形成显著性差异(P<0.05)。在胁迫梯度T1、T2、T3 时,乐东拟单性木兰的叶绿素含量保持持平的状态,与对照组差异不显著(P>0.05)。随后在严重干旱的环境下,所有植物的叶绿素含量到达最低水平,与CK 对照组相比,武当木兰下降74.08%,红花木莲下降54.92%,乐昌含笑下降59.48%,乐东拟单性木兰下降31.33%,在胁迫环境恶化的过程中,乐昌含笑的叶绿素含量表现为先下降后升高再下降,乐东拟单性木兰表现为先上升后下降,其余3 种木兰科植物均为持续下降。因此,从叶绿素的含量变化可以看出,乐昌含笑和乐东拟单性木兰在轻度干旱的条件下抗旱能力强于其余3 种,在重度干旱条件下,4 种木兰科植物的抗旱水平趋于一致。
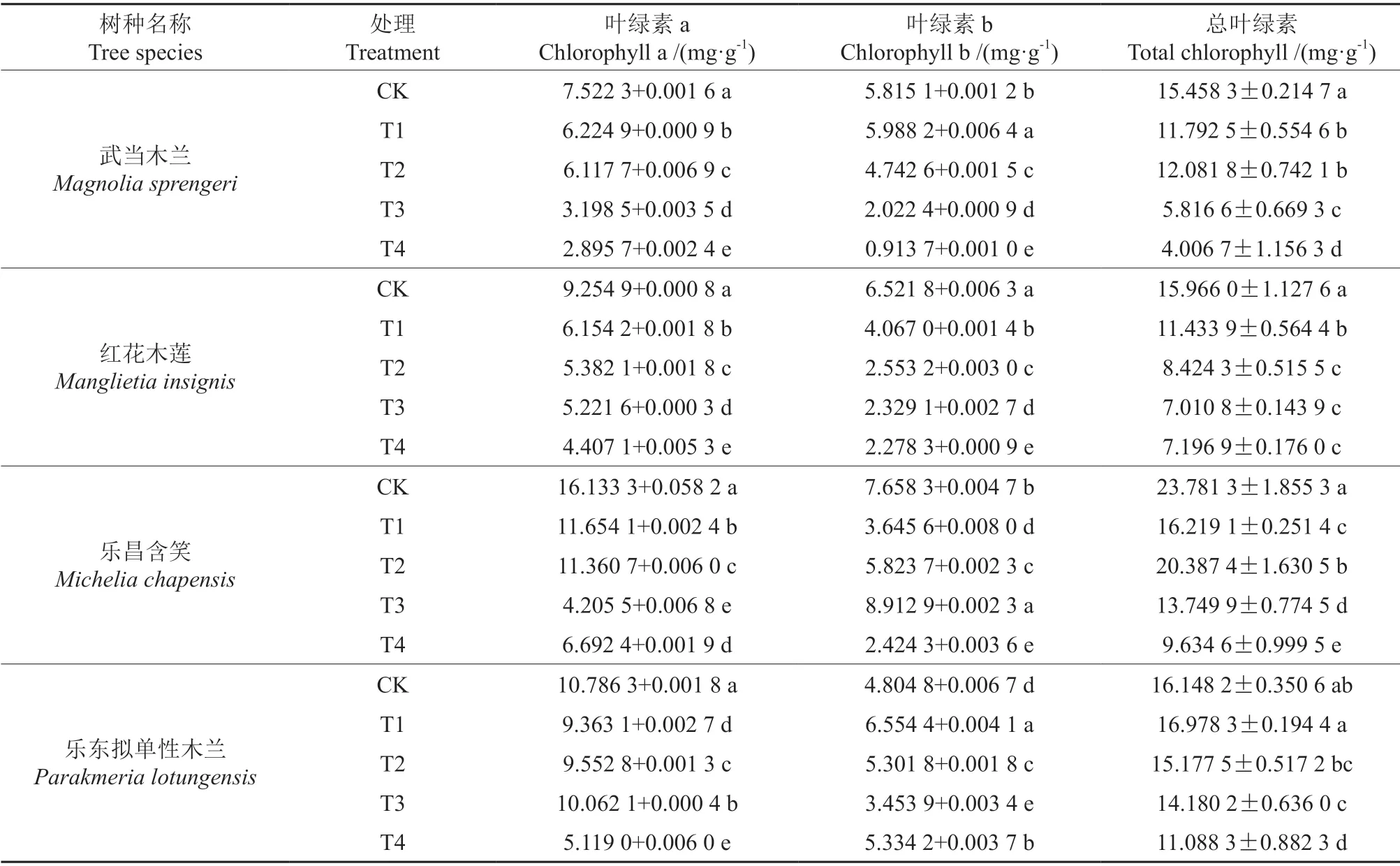
表2 干旱胁迫下叶绿素的变化Table 2 Changes of chlorophyll under drought stress
2.3 干旱胁迫对4 种木兰科植物叶片生理生化指标的影响
2.3.1 干旱胁迫对4 种木兰科植物丙二醛(MDA)含量的影响
植被在恶劣环境下遭受损伤或者组织衰老会诱发膜脂过氧化现象,而膜脂过氧化的主要产物是丙二醛[5]。由图1得知,随着土壤相对含水量的逐渐减少,5 种植物叶片丙二醛含量呈上升趋势。在T1 梯度时,红花木莲和乐东拟单性木兰一致地表现出MDA 含量轻度上升,在T2 梯度时轻度下降,在T3、T4 梯度则持续升高,这可能是因为在T2 时,是其比较适宜生长的环境,因此它们的MDA 含量降低。其中乐昌含笑在整个MDA 含量变化曲线中呈“W”型,在T4 阶段达到整个曲线的最高值。造成这种现象的原因有可能与植物自身的修复机制有关,在T1、T3 梯度植物自身的代谢使其对干旱环境做出抗性,让其MDA 含量下降,在T4 梯度时,胁迫环境已经破坏了其生理代谢修复功能,因此其含量急剧上升。武当木兰在整个曲线变化中保持稳定的上升趋势。通过植物叶片MDA 含量曲线变化,发现乐昌含笑的抗旱性较好,红花木莲的抗旱性相对较差。

图1 丙二醛含量的变化Fig.1 Changes in malondialdehyde (MDA) content
2.3.2 干旱胁迫对4 种木兰科植物过氧化物酶(POD)含量的影响
由于过氧化物酶(POD)能清除植物体内过多的H2O2等过氧化物,防止H2O2对细胞膜的伤害,是细胞内防御酶系统中重要的清除酶之一。因此它也是衡量植物抗旱能力的重要指标之一[6]。由图2得知,随着胁迫环境的恶化,4 种木兰科植物的POD 含量均表现为上升趋势,其中武当木兰和红花木莲在T4 梯度时,它们的POD 含量达到最高,均为131.67 U·g-1min-1。乐昌含笑在整个曲线变化中,在T1 梯度时它的POD 含量表现为轻度下降,随后急剧上升,并在T4 梯度时达到最高含量,为97.51 U·g-1min-1。从过氧化物酶(POD)含量曲线图可以看出武当木兰和红花木莲的抗旱性较高,乐东拟单性木兰的抗旱性较低。

图2 过氧化物酶活性含量的变化Fig.2 Changes of peroxidase (POD) activity content
2.3.3 干旱胁迫对4种木兰科植物可溶性蛋白(SP)含量的影响
可溶性蛋白质在植物逆境中是一种渗透调节物质,由图3得知,随着胁迫环境的恶化,所有植物的可溶性蛋白质含量均表现为下降趋势,并且在T4 梯度时,4 种植物的可溶性蛋白含量均下降到最低值,均在10 μg·g-1以下。在整个胁迫实验中,乐昌含笑的变化最大,T4 梯度含量比CK组含量下降69.95%,红花木莲的SP 值变化最小,T4 梯度的含量比CK 组含量下降35.71%。整体而言,5 种木兰科植物的差异性较小,从可溶性蛋白含量来看,乐昌含笑的抗旱性表现较强,红花木莲的抗旱性相对较差。
2.3.4 干旱胁迫对4 种木兰科植物过氧化氢酶(CAT)含量的影响
根据图4可以看出,植物CAT 含量与土壤含水量关系较为密切,随着干旱胁迫环境的恶化,乐昌含笑、武当木兰和乐东拟单性木兰均表现出CAT 含量先升高后降低的趋势,在T2 梯度时,乐东拟单性木兰,乐昌含笑达到其峰值,分别为3.32 U·g-1min-1,2.94 U·g-1min-1。随后迅速下降,并在T4 梯度时,达到最低,分别为1.17、0.74 U·g-1min-1。武当木兰在T1 梯度表现轻微上升后急剧下降,并在T4梯度时达到接近0 的最低值,造成这种原因可能是干旱胁迫太严重,已经破坏了植物的生理细胞的活性。红花木莲在整个过程保持持续下降。整个过程可以看到乐昌含笑在T2 时CAT 含量上升最高,幅度最大,因此抗旱性较强。

图3 可溶性蛋白含量的变化Fig.3 Changes of soluble protein (SP) content

图4 过氧化氢酶含量的变化Fig.4 Changes of catalase content
3 结论与讨论
植物所处环境的土壤含水量不仅影响植物的株高,也影响着植物的根冠比。水分越适宜,植物的增长也越快,水分不足对地上部分的影响比对根系的影响更大,使根冠比增大[4]。这与黄小辉等[7]和宋会兴等[8]的研究结果一致。通过根冠比的实验数据表明,抗旱能力最强的为乐昌含笑,其次为乐东拟单性木兰和红花木莲,抗旱性最差的为武当木兰。
光合作用是植物体内一系列复杂的化合反应,也是万物之源,是一切生物赖以生存的保障,植物在进行光合作用的时候,最重要的细胞器是叶绿体,光合作用的效率的高低与体内叶绿素含量成正向线性相关关系[9]。在轻度干旱的条件下,乐昌含笑和乐东拟单性木兰的叶绿素含量高于其余3 种,在重度干旱下,所有植物的叶绿素含量急剧下降,说明此时干旱的环境已经破坏了叶绿体从而导致叶绿素的急剧下降。这与张敏等[10]、谢小玉等[11]、姜雪昊等[12]的研究结果基本一致。实验结果表明,抗旱能力最强的为乐昌含笑,其次为乐东拟单性木兰和武当木兰,抗旱能力最差的为红花木莲。
在植物受到恶劣的干旱环境时,细胞膜就会发生一系列的化学反应,会发生膜脂过氧化,它的最终产物就是丙二醛。丙二醛的多少,它影响着细胞膜损伤程度的多少[13-14]。王雅静等[15]的研究数据表明,细胞膜的损伤程度,与修复程度两者之间,是存在一个动态平衡的。通过实验表明,乐昌含笑在T1 和T3 梯度时丙二醛含量下降,说明此时植物的抗旱能力增加,产生的丙二醛减少,即乐昌含笑的抗旱性最强。红花木莲产生的丙二醛最多,而且随着环境越干旱丙二醛含量上升的越快,说明红花木莲的抗旱性最弱。这和吴晓凤等[16]与霍建玲等[17]的研究结果基本一致。
CAT 和POD 都是植物体内膜系统的重要抗氧化酶,它们能够有效清除生物体内的自由基。随着干旱程度的加重和干旱时间的延长,生物体内的自由基和活性氧也均会增多,进而对膜系统造成危害[18]。本研究结果显示,在CAT的含量变化里,乐昌含笑随着干旱环境的恶化,它的CAT 含量急剧上升,说明其抗旱能力是最强的,这与原向阳等[19]和王启明[20]的研究结果基本一致。在POD含量变化曲线发现武当木兰抗旱性最强。
可溶性蛋白(SP)含量是植物代谢过程中蛋白质损伤的一项重要指标,韩蕊莲等[21]研究认为,轻度干旱胁迫导致植物体内可溶性蛋白含量上升,而重度或中度干旱胁迫则导致其含量下降,且胁迫程度越强,下降幅度越明显。通过实验表明,由于实验设计梯度跨度比较大,因此整个过程植物的SP 值都有所下降,但是从SP 值含量得知,乐昌含笑最大,红花木莲最小。因此乐昌含笑抗旱性较强,红花木莲较弱。
影响植物抗旱性的因素众多,同一种因素每个植物所表现的差异性也蛮大,因此同一种抗旱指标对于每个植物反应出来的结果也不尽相同。不同的干旱胁迫条件下,4 种木兰科树种的根冠比、叶绿素含量、丙二醛(MDA)含量、过氧化物酶(POD)含量、过氧化氢酶(CAT)含量、可溶性蛋白(SP)含量这6 个指标发生了显著的变化,其中根冠比、丙二醛、过氧化物酶(POD)等3个标指与土壤相对含水量呈负相关;可溶性蛋白(SP)、过氧化氢酶(CAT)、叶绿素等3 个指标与土壤相对含水量呈正相关。并且综合6 项指标得出乐昌含笑的抗旱能力最强,其次是乐东拟单性木兰和武当木兰,抗旱能力最弱为红花木莲。但本实验研究的树种数量较少,可能与实际情况存在差异,大样本的研究是否符合这种规律有待于进一步研究。本实验比较全面地分析了干旱条件下木兰科树种生长特性的变化,为其以后木兰科树种的栽培选育提供较为科学的理论依据。
