细丽外担菌侵染对油茶叶生理生化变化的影响
2020-12-08阙生全王小东喻爱林涂业苟张壹萱肖相元
阙生全,刘 鹏,王小东,喻爱林,涂业苟,张壹萱,肖相元
(江西省林业科学院,江西 南昌 330013)
油茶Camellia oleifera为世界四大木本油料植物之一,是我国特有的油料树种[1]。该物种分布于中国南方低山丘陵地区[1],主要分布于长江流域及其以南的江西、湖南、广西等14 个省(市、区),其中江西、湖南、广西占全国油茶林总面积的76.2%[2],在越南、泰国、马来西亚和日本等也有少量分布[3]。茶油是一种品质优良稳定的食用油[4]。近年来,食用油安全越来越被民众所重视,并上升到国家战略的高度[5],茶油不断受到我国各级政府的高度重视,并且出台了《全国油茶产业发展规划(2009—2020)》,得到大力推广,油茶种植面积迅速增加,极大地促进了中国油茶产业的发展速度。油茶饼病又称油茶叶肿病,主要为害叶芽、花芽、子房和幼果,致使发病器官产生肿大变形,使油茶丧失结实和光合作用的功能[6],制约油茶产业的发展。研究显示,该病的致病菌为担子菌纲细丽外担菌目的细丽外担菌Exobasidium gracile,该病发生在每年清明节前后,是影响油茶生产的主要病害之一[6-7]。
目前,学者已对油茶叶肿病的基本症状[6-10]、发病规律[7-10]、侵染循环[8-9]、肿病叶片形态结构[11]进行了较多的研究,对病原菌的了解也较为深入[6-10]。而关于油茶茶饼病病理学的研究未见报道,对于细丽外担菌对寄主的生理影响机制并不清楚。研究表明,病害胁迫属典型的生物胁迫,可引发寄主植物基因的表达、代谢、光合速率和产量变化等一系列生理生化反应[12-14]。如王雪等[15]研究显示,棉花Gossypiumspp.叶片受棉花黄萎病菌Verticillium dahliae胁迫后,其叶片蛋白质组发生明显的变化;梁芳芳[16]研究表明,黄瓜Cucumis sativus叶片受霜霉病菌Pseudoperonosppora cuhensis胁迫后,其叶片有过敏性的反应;崔宏伟等[17]研究认为烟草Nicotiana tabacum叶片接种烟野火病菌Pseudomonas syringaepv.tahacci后,其叶片蛋白质表达发生明显差异。Pins 等[18]和Gilati 等[19]发现坏损细丽外担菌侵染茶叶后,糖类物质等成份发生变化;单治国等[12]研究茶树游离氨基酸受茶饼病(坏损细丽外担菌)侵染后的种类和含量存在差异。
因此,为探讨油茶茶饼病与某些生理生化指标的响应关系,以受侵染油茶叶为研究材料,通过检测细丽外担菌侵染油茶叶片后生理生化指标的变化,探讨侵染程度与生理生化反应的相关性,为深入研究油茶与细丽外担菌的互作机理提供理论基础,以期为研究油茶叶肿病的病理学、细丽外担菌的致病机理提供参考资料。
1 材料与方法
1.1 供试材料
供试材料于2016年4月5日采集自江西省南昌市安义县万埠镇龙源油茶示范基地(28°52′02.32″N,115°40′24.76″E),该基地面积2.05 hm2。以健康叶为对照,用枝剪剪取油茶(8年生油茶)被侵染后的肉质叶(因受细丽外担菌侵害,外形肿大),拍照后放入无菌牛皮纸袋中,立即带回实验室。参照阙生全等分离外担子菌的方法分离目标菌[7]。根据油茶叶受侵染的程度,将油茶叶病程划分成4个等级。
I 级:肉质叶——14~17 mm×4~8 mm,深红色,未脱皮。
II 级:肉质叶——19~23 mm×11~14 mm,粉红色,未脱皮。
III 级:肉质叶——45~65 mm×20~26 mm,暗金黄色,部分脱皮。
IV 级:肉质叶——75~95 mm×28~34 mm,浅白色,完全脱皮。
1.2 供试试剂
超氧化物歧化酶(SOD)测试盒、过氧化物酶(POD)测定试剂盒、苯丙氨酸解氨酶(PAL)测定试剂盒和丙二醛(MDA)测定试剂盒。以上试剂盒购自南京建成生物工程研究所。丙酮、黄基水杨酸、三氯乙酸等分析纯试剂购自天津市恒兴化学试剂制造有限公司。
1.3 试验方法
丙二醛含量、叶绿素(a+b)含量、游离脯氨酸含量、可溶性糖含量的测定,参照王学奎[20]的方法。超氧化物歧化酶、过氧化物酶、苯丙氨酸解氨酶3 种酶活性的测定参考南京建成生物工程研究所出具的说明书。
以上所测得数据运用SPSS 20.0 软件和Excel 2007 软件进行统计分析。
2 结果与分析
2.1 叶绿素和类胡萝卜素含量的变化
由表1可知,油茶叶中的总叶绿素含量与对照组呈极显著差异(P<0.01)。随病程加重总叶绿素含量呈下降趋势(图1)。在I 级肉质叶中,总叶绿素含量为41.05 mg·g-1,是对照组含量的19.58%,而在IV 级中,总叶绿素含量为15.43 mg·g-1。肉质叶中的类胡萝卜素含量变化趋势与总叶绿素的变化一致(图2)。在I 级肉质叶中总类胡萝卜素含量是对照组的7.9%,而在IV 级肉质叶中类胡萝卜素含量仅为对照组的2.38%。

表 1 各生理参数不同组单因素多重比较†Table 1 Multiple comparisons of one-way ANOVA on physiological parameters of Camellia oleifera at control group and different experimental groups
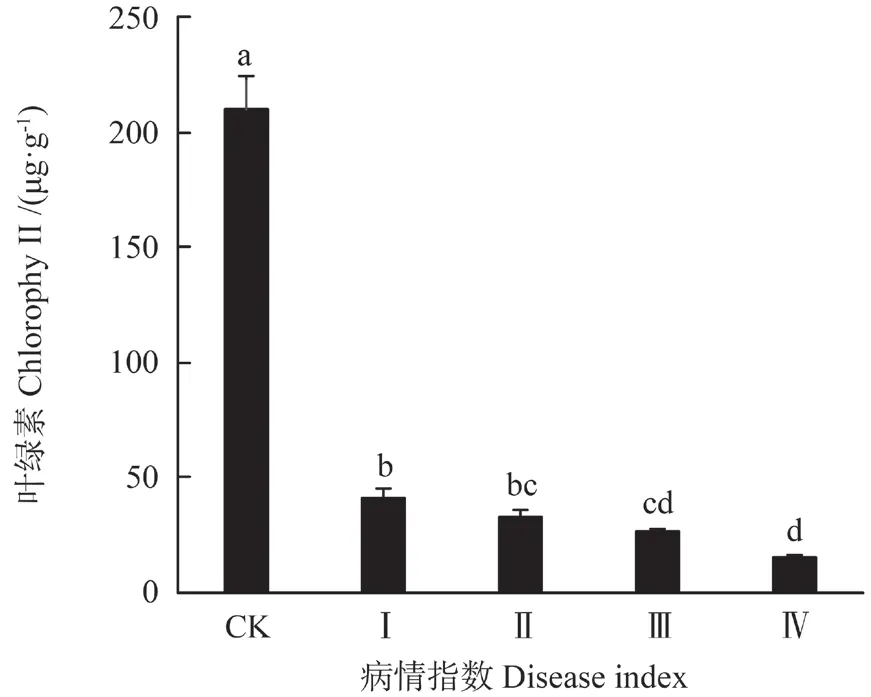
图1 油茶叶内叶绿素含量的变化Fig.1 Changes of the content of chlorophy II in the leaves of Camellia oleifera

图2 油茶叶内类胡萝卜素含量的变化Fig.2 Changes of the content of carotenoid in the leaves of Camellia oleifera
2.2 可溶性糖含量的变化
由表1可知,受细丽外担菌侵染后油茶叶可溶性糖含量显著变化(P<0.01)。本研究结果表明(图3),在I 级肉质叶中其含量为29.4 mg·g-1,是对照组的2.43 倍。在II 级其含量迅速提高,达到峰值50.23 mg·g-1,是对照组的4.15 倍。但随着病程加重含量又急剧下降,在IV 级肉质叶中仅为10.37 mg·g-1。

图3 细丽外担子菌对油茶叶中可溶性糖含量的影响Fig.3 The effect of Exobasidium gracile on the content of soluble sugars in the leaves Camellia oleifera
2.3 脯氨酸含量的变化
脯氨酸是一种细胞亲水性物质,能促进蛋白质的水和作用,形成聚合物,所以它具有一定的保水作用。由表1可知,受细丽外担菌侵染后油茶叶脯氨酸含量变化显著(P<0.01)。结果(图4)显示,在I 级肉质叶中脯氨酸含量是46.73 μg·g-1,为对照组的1.94 倍;在II 级肉质叶中,脯氨酸的含量上升,为最大值75.54 μg·g-1,是对照组的3.13倍;随着病情逐渐加重,IV 级时,脯氨酸含量下降到11.25 μg·g-1,为对照组的46.64%。
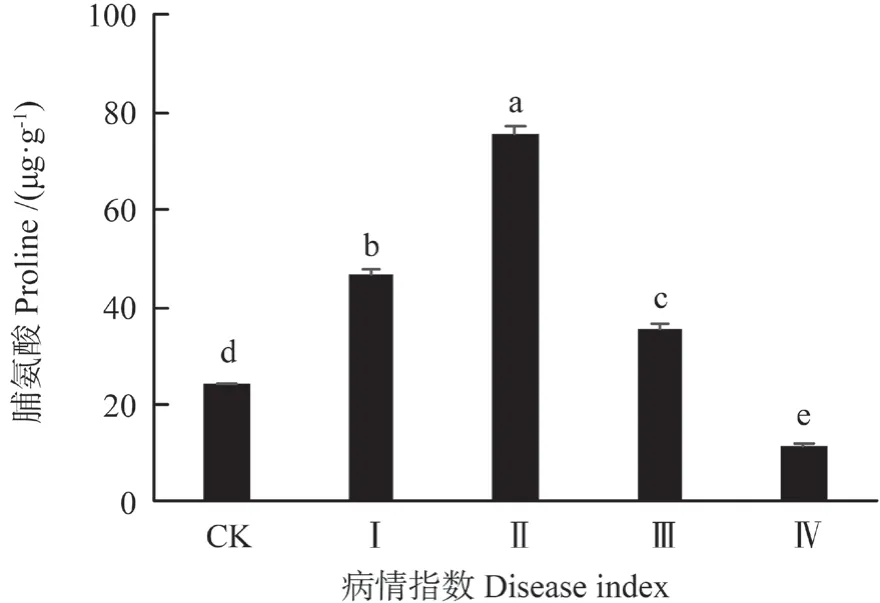
图4 细丽外担子菌对油茶叶中脯氨酸含量的影响Fig.4 The effect of Exobasidium gracile on the content of proline in the leaves of Camellia oleifera
2.4 MDA 含量的变化
当油茶叶受侵染后,丙二醛(MDA)的含量变化显著(P<0.01)(表1)。由图5知,在I级时,叶肉中MDA 含量为37.42 μmol·g-1,是对照组的2.26 倍。在II 级,MDA 含量迅速增加并达到峰值63.28 μmol·g-1,是对照组的3.82 倍。病程不断加重,MDA 含量呈下降趋势,在IV 级为24.26 μmol·g-1。

图5 细丽外担子菌对油茶叶中MDA 含量的影响Fig.5 The effect of Exobasidium gracile on the content of MDA in the leaves of Camellia oleifera
2.5 SOD 活性的变化
由表1知,油茶叶受细丽外担菌侵染后超氧化物歧化酶(SOD)活性变化显著(P<0.01)。在I 级肉质叶中SOD 活性是16.54 U·g-1,为对照组的28.15%,而在IV 级其活性是7.28 U·g-1,仅为对照组的12.39%(图6)。

图6 细丽外担子菌对油茶叶中SOD 酶活性的影响Fig.6 The effect of Exobasidium gracile on the content of SOD in the leaves of Camellia oleifera
2.6 POD 活性的变化
由表1知,油茶叶受细丽外担菌侵染后过氧化物酶(POD)活性变化呈极显著差异(P<0.01)。在I 级时,油茶叶中POD 活性是163 U·g-1,是对照组的45.03%,而在IV 级其活性是11.8 U·g-1,仅为对照组的32.6%(图7)。
2.7 PAL 活性的变化
由表1知,叶片中苯丙氨酸解氨酶(PAL)的活性变化呈极显著差异(P<0.01),受病程的不断加重,其活性先上升至峰值而后急剧下降(图8)。在I 级肉质叶中,PAL 活性为12.6 U·g-1,是对照组的2.25 倍。在II 级迅速上升,达到峰值,上升幅度为65.08%。在IV 时降至2.6 U·g-1,为对照组的46.43%。
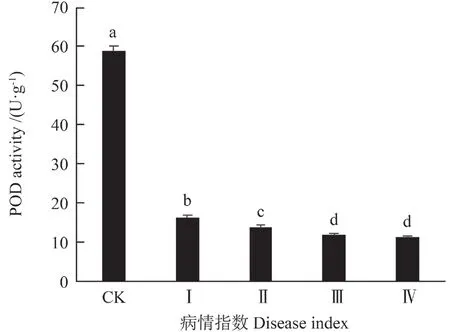
图7 细丽外担子菌对油茶叶中POD 酶活性的影响Fig.7 The effect of Exobasidium gracile on the content of POD in the leaves of Camellia oleifera

图8 细丽外担子菌对油茶叶中PAL 酶活性的影响Fig.8 The effect of Exobasidium gracile on the content of PAL in the leaves of Camellia oleifera
2.8 方差分析
单因素方差分析表明,在8 个生理参数间,除可溶性糖,对照组与IV 级病程组不存在显著性差异外(P<0.05);其余参数间,对照组与实验组均存在极显著差异(P<0.01)(表1)。
表1显示,在叶绿素四个实验组中,I 级病程组与II级、III级病程组,II级病程组与III级病程组,III 级病程组与IV 级病程组不存在显著或极显著差异(P>0.05);在类胡萝卜素4 个实验组中,III级病程组与IV 级病程组不存在显著或极显著差异(P>0.05);在SOD 4 个实验组中,III 级病程组与IV 级病程组不存在显著或极显著差异(P>0.05);其余各实验组间在选取的8 个生理参数间均存在显著或极显著差异(P<0.05,P<0.01)(表1)。
3 结论与讨论
细丽外担菌感染油茶花芽和幼叶后,使油茶植物组织增生导致一种特殊的“菌瘿”为油茶茶饼病[6]。该病发生具有明显的季节性,通常2月开始发病。油茶茶饼病在发病期,成熟孢子借风传播侵染寄主,寄主嫩叶在适宜的条件下当年春季发病,如条件不适宜,以菌丝形态和越夏方式在寄主内潜伏,并以代谢物影响寄主的叶芽和花芽,来年早春发病[9-10]。油茶茶饼病的发生与气温、日照、云量、降水等气候因子有密切关系[9],尤以茂密林分中发病较重,如通风不良、阳光不足等;此外,分蘖油茶嫩枝叶片也是最易感病[21]。特别是月平均气温对发病有显著的影响[9],如雨量充足时,细丽外担菌在平均气温20~30 ℃时生长有利,易造成很大的侵染和扩展机会[10]。
本研究从叶绿素、类胡萝卜素、可溶性糖等8 个生理生化指标来有探讨病害胁迫与寄主植物间的响应关系。叶绿素是植物光合作用的物质基础。本试验结果表明,油茶病变叶片的叶绿素和类胡萝卜素含量显著的低于对照组,其含量随油茶叶片病程不断严重而显著的减少。细丽外担菌侵染寄主时,叶绿素和类胡萝卜素含量从感染部位到未感染部位区域,有明显的下降梯度,与病变的程度存在一定的相关性。由于寄主同一叶片上的感染部位可逐渐发生,在正常叶片与感染叶片的过渡区域,叶片含有叶绿体[11],所以叶绿素和类胡萝卜素的含量是随感病程度的增加而减少,存在显著或极显著差异。感病叶无栅栏组织和海绵组织的分化,无叶绿体,有别于正常的叶肉细胞,或存在叶绿体,但叶绿体的双膜结构被破坏,基粒片层数减少或消失[11,14],使叶片丧失光合作用和结实功能,油茶显著减产。病原菌逐渐感染,破坏膜结构,导致细胞膜发生过氧化作用或脱脂作用而形成丙二醛(MDA),与对照组相比,实验组的MDA 的含量增多,MDA 含量在油茶叶片侵入中度时,其含量最大。糖类物质可参与植物的抗病性表达[22-23],病变中前期叶片可溶性糖含量极显著地高于对照组,这是因为病菌刚开始时侵染寄主叶片时,感病部位需要较多的糖类物质以抵抗病菌的侵入,但随着病菌大量生长繁殖,加剧了对寄主叶片中叶绿素的破坏,使得感染叶片的光合作用下降,可溶性糖含量随之下降;另一方面病原菌为异养生物,其自身的生长繁殖需要吸取叶片内糖类物质,受害叶片糖类物质减少。基于于此,可溶性糖在病原菌入侵初期,含量显著增加,在侵入后期含量显著下降。前人研究也显示,不同病变位置甜味存在差异,叶“瘿体”富含水分,鲜食时甜味比子房“瘿体”略淡,清鲜,微涩[12]。但后期叶“瘿体”由于失水枯干,其甜味会有所上升。
植物受病原菌侵染后会产生防御反应,抗病相关蛋白的表达会显著变化[24-25]。超氧化物歧化酶(SOD)、过氧化物酶(POD)作为细胞抵御活性氧伤害的酶保护系统的重要成员[26-27],本试验显示,SOD、POD 酶活性随着细丽外担菌侵入的不断深入,其酶活性不断减少,与对照组存在显著差异(表1)。有研究显示,研究材料接种病原菌后,植物体内抗病反应与POD 活性之间呈正相关,如在油茶软腐病Colletotrichum camelliae研究中[28],而有关SOD 酶活性变化与抗病性关系尚未取得一致的结论[29],如常明山等研究显示SOD表现各异,超SOD 在感病后的陆川油茶植株叶片降低,但普通油茶、岑软2 号油茶感病后的植株叶片体内升高[30]。本试验结果为SOD、POD 2 种物质在受病原菌侵染后,其酶活性与病程呈负相关。说明寄主叶片受病原菌侵染后,体内组织代谢发生紊乱,植物自我调节和恢复能力减弱,也可能在发病后发病组织体内蛋白水解酶活性提高[31],分解或降低了所测2 种酶的活性。苯丙氨酸解氨酶(PAL)在植物中起到酚类物质聚集、木质素积累、植保素合成等的关键酶和限速酶的功效[32]。本试验结果表明,油茶叶受病原菌侵染后,PAL 活性发生显著性变化。油茶叶刚受侵染时,PAL 活性急剧升高;随着病程继续加重,PAL 的活性呈逐渐下降。这可能是油茶叶在轻度病害胁迫下体内诱导了这类保护酶的基因表达,PAL 活性表现出增加;随着油茶叶病程加重,其体内代谢趋于紊乱导致抑制了这类保护酶基因表达,PAL活性表现出下降。以上原因的解释,还需进一步的实验验证。植物蛋白质的变化必然引起蛋白质构成基本单位氨基酸的变化[12]。脯氨酸与植物抗逆性关系密切,游离脯氨酸含量是植物体抗逆性生理生化指标之一[29]。本研究表明,寄主叶片受病原菌侵染后,其叶片中的游离脯氨酸含量迅速增加,对照组和实验组脯氨酸含量进行比较,发现存在极显著差异;脯氨酸在叶片侵入II 级病程时含量最多,随着细丽外担菌对寄主叶片破坏不断的加深,其叶片合成脯氨酸的能力下降。在细丽外担菌侵入茶树Camellia sinensis叶片后,茶树叶片氨基酸含量也会发生变化[12]。单治国等研究显示,茶树叶片受茶饼病危害后,游离氨基酸总量出现了不同程度的上升,但叶片中苯丙氨酸的含量下降[12]。本试验显示,细丽外担菌侵染油茶叶片,叶片中PAL 活性先上升至峰值而后急剧下降,关于叶片中苯丙氨酸的含量需下一步研究中深入探讨。
油茶叶片受细丽外担菌侵染后,其叶片组织内的生理代谢活动受到影响,致使油茶叶片光合作用、物质代谢、生长和品质等造成负面影响。本研究再次证实了病原菌胁迫能引起寄主植物体内的生理生化代谢活动出现不同程度的变化,对这一现象进行深入研究,则有可能把该规律用于油茶茶饼病的早期预测。
