多基因风险评分在复杂性状疾病中的应用进展
2020-12-08耿旭强徐沪济
吴 歆,耿旭强,徐沪济
(海军军医大学第二附属医院风湿免疫科,上海 200003)
随着精准医学的提出以及基因组医学研究的不断深入,人类基因组信息可有效辅助临床进行更精确的疾病诊断,并帮助医师制定个体化的治疗方案,同时也可被用于大范围的人群筛查,并根据个体差异而采取相应措施,阻止疾病的发生。复杂性状疾病(complex disease)发病由多个基因位点共同参与且与环境因素相互作用决定疾病表型的遗传疾病,如心血管疾病、肿瘤性疾病、自身免疫病等。人类基因组信息中,遗传风险评分作为研究单核苷酸多态性(single nucleotide polymorphism,SNP)与复杂性状疾病间关系的方法,其综合了若干SNP的微弱效应,大幅提升了基因多态性对疾病的预测效能。多基因风险评分 (polygenic risk score,PRS)可量化多个基因或位点的累积效应,将大量的基因组变异信息浓缩成能够衡量个体疾病易感性的分值,从而发挥其对高风险人群的预测、筛查及干预作用,实现精准预防复杂性状疾病的目标。本文将就PRS在各类复杂性状疾病中的作用及相关国内外最新研究进展进行综述,为后续的研究提供思路和参考。
PRS的基本作用及流程
基因组医学是以人类基因组为基础,根据个体的基因型来预测其患遗传疾病的风险,可使基因组数据高效地被转化应用于临床实践。目前,全基因组遗传数据检测已成为预测疾病的常见方法,许多疾病如冠心病、2型糖尿病、风湿病及其他自身免疫病等都有明确的风险基因位点,且可能包含许多遗传决定因素,但因效应较弱,目前这些风险基因位点的效应无法体现在全基因组检测结果上。在这种情况下,PRS采用将与某种表型相关联的一组风险SNP的基因型效应加权的方法,来计算个体对该种表型的遗传倾向,故常被作为预测复杂性状疾病风险的策略,是目前研究复杂性状疾病遗传易感性的突破点。
一、PRS的作用
PRS是一种基因分析策略,可整合多个位点的遗传信息来实现以下临床目的。①根据多种信息(包括遗传、临床信息等)来预测个体罹患疾病(或特定临床性状)的可能性;②评估相关变异预测疾病的效能。应用PRS能够根据现有的基因信息预测个体是否可能患上某种疾病,以及个体对药物的反应或其他结果。目前,国内外研究均已证实,在不同疾病领域的疾病风险预测、前期优化筛查方案以及风险分层等方面,PRS均展示出了良好的应用前景(见表1)。

表1 近5年PubMed数据库中关键词为“PRS”加“疾病名”的文献数量
二、PRS的流程
PRS的基本流程见图1[1],其预测精度通常采用受试者操作特征曲线下面积(area under curve,AUC)来评估。AUC相当于一个患病个体的预测风险高于一个健康个体预测风险的总体概率,并不能预测任何个体或个体亚组的绝对风险信息。AUC采用比较灵敏度和特异度占预测模型总体性能的比率,使得PRS能够筛选存在患病风险的患者,这将为预防医学以及精准干预提供机会和信息。
PRS的临床中应用研究进展
一、心血管疾病
PRS很早就已被用于冠状动脉粥样硬化性心脏病(以下简称冠心病)的研究,近几年的相关研究进展更是突飞猛进,其主要被应用于以下几个方面。
1.预测药物疗效:2015年Mega等[2]发表在柳叶刀杂志上的报道具有里程碑式的意义,该研究纳入了48 421名个体和3 477个事件,基于27个单核苷酸变异,评估了接受他汀类药物治疗患者的PRS,结果发现,就他汀类药物治疗的益处而言,在PRS低、中、高遗传风险类别中,患者罹患冠心病的相对风险呈显著的降低梯度(13%、29%、48%,P=0.027 7)。同样,在遗传风险较高(PRS高)的人群中,接受他汀类药物治疗后,患者罹患心血管疾病的绝对风险降低幅度更大(P=0.010 1),这也导致一级预防中高PRS人群采用他汀类药物治疗减少冠心病所需的治疗次数是低得分人群的3倍。当PRS评估体系增加到大于50个单核苷酸变异后,则具有更大的预测能力,涵盖家族史信息分析后,HR=1.4,95%CI为1.29~1.53;无家族史信息分析后,HR=1.87,95%CI为1.63~2.14,差异没有统计学意义,即无需依赖家族史信息即可预测[3]。苏格兰西部冠状动脉预防研究的回顾性分析也表明,他汀类药物在冠心病一级预防中的效果在不同多基因风险类别中有显著差异[4]。
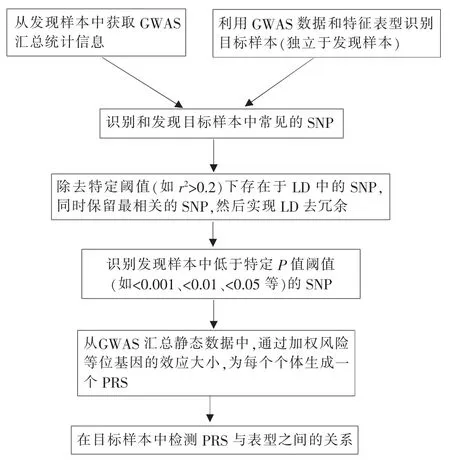
图1 建立一个典型的P值阈值PRS的基本步骤[1]
2.预测心血管疾病的发生风险:Khera等[5]基于50个单核苷酸变异的PRS研究发现,遗传风险最高的个体在改善生活方式和调整饮食后,能使自身冠状动脉事件的相对发生风险降低46%。该研究表明,遗传风险不是不可改变的,进行PRS危险分层来指导生活方式干预策略,可使高风险人群获益。
随着对PRS研究的深入,人们对冠心病遗传机制的认识也不断深入。Xu等[6]将炎症基因[白细胞介素-6受体(interleukin-6 receptor,IL-6R)、肝细胞核因子1α(hepatocyte nuclear factor 1 alpha,HNF-1α)和环氧化酶2(cyclooxygenase-2,COX-2)]的单核苷酸变异整合到PRS中,用于预测冠心病患者左冠状动脉主干病变 (left main coronary artery disease,LMCAD),根据冠心病患者的PRS分为高、中、低风险3组,结果发现,高风险组的LMCAD发生率是低风险组的2.81倍,在对冠心病相关临床变量(如年龄、性别、体质量指数、吸烟状况、高血压、高脂血症、糖尿病、慢性肾功能不全、慢性阻塞性肺疾病等)进行校正后,与低风险组相比,高风险组的LMCAD发生率仍明显增高(校正OR=2.78,95%CI为1.69~4.58,P=0.02)。该研究显示,PRS对LMCAD遗传风险的预测价值显著高于SNP模型。2018年,Khera等[7]分析了迄今为止最大规模的PRS研究 (包括660万个单核苷酸变异),发现高PRS的患者一生中患冠心病的风险是正常人的3倍,相当于单基因突变(如家族性高胆固醇血症)所带来的风险,故提出应将PRS预测疾病风险纳入临床策略,同时采取预防性对策,作者认为这势在必行。
二、肿瘤性疾病
肿瘤性疾病是指机体已经发育成熟或正在发育过程中的正常组织细胞在致癌因素和促癌因素的长期刺激作用下,发生基因突变,导致过度增生或异常分化,从而形成的机体新生物,其具有生长自主性、局部浸润性和远处转移性[8]。我国恶性肿瘤的发生率和死亡率在过去20年中明显上升,已成为危害人体健康和生命的主要疾病。2020年2月,美国肿瘤临床学会发布的《2020年临床肿瘤学进展年度报告》中指出,在未来10年内,美国新增癌症病例数量将增加约1/3,而癌症的预防和癌症患者的护理是目前最紧迫的研究重点[9]。目前在肿瘤风险预测的领域中,PRS相关研究值得关注。
1.肺癌:基于癌症现有的大数据库,PRS在风险预测、分层及提高人群在预防性干预中获益方面独占优势。Dai等[10]基于中国肺癌大样本人群的全基因组关联分析(genome-wide association study,GWAS)研究(包括13 327例非小细胞肺癌患者和13 328例对照者),筛选出19个独立的中国人群肺癌易感基因位点,并构建了PRS-19评分。随后作者在我国慢性病前瞻性研究项目纳入的近10万人群(中位随访时间10.4年)中评价了PRS-19预测肺癌风险的效能,结果发现,PRS-19评分与肺癌发生风险间存在明显的正相关关系,PRS≥P90(90%)的人群发生肺癌的风险是PRS<P90人群的2.37倍,同时PRS与吸烟间存在显著累积效应,提示PRS可作为年龄及吸烟等因素之外的重要肺癌风险预测指标。
2.乳腺癌:之前,一些欧洲的研究均显示,与对照组相比,乳腺癌患者有着更高的PRS[11-12]。总体来说,针对欧洲人群的研究表明,在PRS最低四分之一人群与最高四分之一人群之间,发生乳腺癌的风险至少有2倍的差异[7,13],且在其他人群中(包括亚洲、非洲等)也有类似的研究结果[14-15]。由此可见,PRS是预测乳腺癌风险强有力的工具,并在乳腺癌风险评估中具有以下应用潜能。①可在不提供相关基因检测结果的前提下,为乳腺癌高危风险家庭提供疾病的风险信息;②作为单基因疾病风险评估的调节因子;③指导人群乳腺癌筛查工作。当然更多乳腺癌相关PRS的应用价值和前景仍值得进一步探索。
三、精神性疾病
精神分裂症是一种与广泛认知障碍相关的复杂性状疾病。尽管认知障碍是精神分裂症中与疾病损害较密切的因素之一,但目前的治疗策略很难解决这些认知障碍。精神性疾病领域相关研究发现,PRS与精神分裂症认知相关,基于此类研究,其可用于预测精神性疾病的易感性。Lencz等[16]将来自大规模认知GWAS荟萃分析 (9个非临床队列的认知基因组学联盟的研究,包括约5 000个研究对象的数据)的PRS应用于4个精神分裂症病例对照队列,结果发现,病例组的认知PRS明显低于对照组,同时,精神分裂症的PRS显著降低,且低认识PRS与较低的一般认知能力相关。这个结果在随后的研究中也得以被验证,Hubbard等[17]对8~22岁的欧洲人群进行了认知能力(n=4 183)及脑结构(n=516)的相关分析,采用基于全基因组纯合性和精神分裂症的PRS来计算精神分裂症的遗传易感性,研究表明精神分裂症高PRS与低操作智商(P=0.001)及低全面智商(P=0.013)有关,且操作智商的PRS与精神分裂症风险增加相关(P<0.001)。神经解剖学数据表明,精神分裂症患者的认知PRS受大脑结构调节[18]。Mallet等[19]的研究显示,当样本基于普通人群和健康受试者时,精神分裂症患者的PRS与整体认知呈负相关(P<0.001),但对3项精神分裂症的研究进行荟萃分析后,未发现两者间存在统计学相关性(P>0.05)。Hettige等[20]收集83例欧洲精神分裂症患者的抗精神病药物剂量资料,并基于精神疾病全基因组研究联盟鉴定出的风险位点计算出PRS,来预测其药物应用的剂量。尽管该研究发现PRS与药物剂量间没有统计学相关性,但仍为应用PRS分析精神分裂症临床相关表型的遗传易感性提供了一种新方法。
四、自身免疫病
1.强直性脊柱炎:1999年,自身免疫病继心血管疾病、癌症之后正式被世界卫生组织列为威胁人类健康的第三大疾病,同时还被我国列入国家中长期科技发展纲要的十类重大疾病之一。其中,近年关于类风湿关节炎(rheumatoid arthritis,RA)、强直性脊柱炎等自身免疫病的GWAS研究已取得了瞩目的成就,而如何处理大批量的遗传数据,从而更好地指导临床治疗,则是目前风湿病学所面临的重要课题。笔者所在的课题组首次利用来自15 083例强直性脊柱炎患者和20 902例健康对照的GWAS数据,在欧洲和东亚人群中开发并验证了PRS模型,发现PRS具有强大的鉴别能力和协助疾病诊断的准确性,可用于辅助诊断慢性背痛患者,也可以用于筛查具有较高罹患疾病风险的人群(未发表)。研究提示,欧洲裔自身免疫病相关PRS在背痛者中筛查早期强直性脊柱炎患者的AUC为0.92,明显优于单纯HLAB27基因检测(AUC=0.87)、MRI检查(AUC=0.89)或C-反应蛋白检测(AUC=0.70);强直性脊柱炎相关的PRS在东亚裔受试者中,也有类似结果验证(AUC=0.95)。以上研究也证实不同种族间PRS的鉴别能力不同,提示研究者在开发PRS模型时必须要考虑种族差异。
2.RA:RA是一种多系统受累的自身免疫病,而中枢神经系统受累也被视为是RA的重要并发症,尤其是认知功能受损。Jones等[21]从7 977名儿童和青少年中获取了RA相关的PRS,研究发现,RA患者的PRS增加与8岁时的总智商、表现智商、言语智商有关,与4~16岁时的多动症、注意力不集中症状也有关。Ge等[22]则提出了一种新的多基因预测方法PRS-CS(Continuous Shrinkage),其结合疾病GWAS数据以及定量特征(如身高、体重、高密度脂蛋白、低密度脂蛋白、三酰甘油、胆固醇)来预测疾病的发生风险,并在自身免疫病(如RA、炎症性肠病)中进行了验证。PRS方法的不断优化和升级,也不断推进了临床转化的精度和进程。
五、内分泌疾病
我国是糖尿病患病率增长较快的国家之一,而全球报告的糖尿病患病率也在逐年上升,预计到2030年,全球的2型糖尿病患病率将增至7.079%[23]。应用PRS能有效地筛选出糖尿病高风险人群,为降低糖尿病发病率和病死率发挥作用。Oram等[24]的研究表明,1型糖尿病相关PRS在区分1型糖尿病与2型糖尿病患者及单基因糖尿病患者方面表现出色,可以准确识别需要胰岛素治疗的年轻糖尿病患者,尤其是当临床特征和自身免疫标志物不明确时,PRS将是对糖尿病患者进行正确分类手段的重要补充。Padilla-Martínez等[25]也系统性回顾了PRS在1型糖尿病和2型糖尿病中的应用,其中12项研究是利用PRS鉴别糖尿病与健康对照者,3项研究是利用PRS区分1型糖尿病与其他亚型,发现PRS拥有足够的灵敏度和特异度来鉴别出1型糖尿病患者,这对处于混杂多种临床因素背景下进行准确分类患者非常重要,且有助于指导患者调整生活方式和医师制定药物干预策略,以延缓糖尿病进展。
PRS的现存问题和展望
尽管,当前PRS研究已经取得了突破性进展,但目前其在临床应用中依然受到研究数量、个体遗传、人口统计学和临床风险因素等限制,如基因-环境交互作用在复杂性状疾病的发生中具有非常重要的作用,而目前大多数疾病的风险预测仅考虑了遗传和环境因素的单效应,而忽略了两者之间的交互作用。未来需开发更多的动态方法,来评估个体受遗传变异及环境的影响情况,需考虑为每种疾病开发多个PRS模型,以适应不同的情况,包括在不同的情况下,评估同一事件的风险。另外,随着机器学习和人工智能的进步,利用这些技术扩展PRS模型可能是解决遗传因素与预后因素交互影响的一个更实际的解决方案。临床工作者也期待进行更多的大规模研究,来证明PRS的效用以及推动临床决策的不断优化。
