帕金森病血压管理专家共识
2020-12-08陈施吾窦荣花王玉凯王晓平陈先文屈洪党陈生弟SusanFox
陈施吾 ,窦荣花,王玉凯,王 含,王晓平,陈先文,陈 玲,王 训,屈洪党,陈生弟,Susan Fox,李 燕,王 刚
(1.上海交通大学医学院附属瑞金医院a.神经内科;b.上海市高血压研究所,上海 200025;2.河北州中西医结合医院神经内科,河北 沧州 061001;3.佛山市第一人民医院神经内科,广东 佛山 528000;4.中国医学科学院北京协和医院神经内科,北京 100730;5.上海交通大学医学院附属同仁医院神经内科,上海 200050;6.安徽医科大学第一附属医院神经内科,安徽 合肥 230022;7.中山大学附属第一医院神经内科,广东 广州 510080;8.安徽中医药大学神经病学研究所,安徽 合肥 230061;9.蚌埠医学院第一附属医院神经内科,安徽 蚌埠 233030;10.加拿大多伦多大学医学院西区医院运动障碍疾病中心,多伦多M5T 2S8)
近年来,随着临床实践及研究的进展,帕金森病(Parkinson disease,PD)已经从局限于中枢神经系统的疾病范畴扩展为可累及全身多个系统的多系统疾病,其中以直立性低血压 (orthostatic hypotension,OH)为代表的血压异常,作为一种常见的非运动症状(non-motor symptom,NMS),可发生在PD病程中的任一时间点。PD的血压异常既与患者的自主神经功能异常有关,也与抗PD药物应用的不良反应密切相关,是严重影响患者生活质量(quality of life,QoL)的关键因素。多项研究发现,在PD患者漫长的病程中,20%~50%的患者会在不同时期出现血压异常的表现[1-4],主要包括OH、卧位高血压(supine hypertension,SH)以及餐后低血压(postprandial hypotension,PPH),此外许多治疗PD运动症状的药物会加剧血压波动。其中,以OH最为常见,多表现为头晕、疲劳和颈痛等症状,血压波动幅度大者可出现跌倒、晕厥和缺血性卒中,甚至猝死等严重不良事件[5]。OH还与PD患者认知功能减退[2]以及入院率、死亡率、致残率增加有关[6]。PD患者中约45%存在SH[7],且可与OH同时发生[2],作为血流动力学的一对矛盾,对其中一方的管理不当往往加重了另一方的严重程度[2]。患者在夜间睡眠时段发生不易察觉的持续性高血压状态与其心脏[8-9]、肾脏[10]等靶器官损害密切相关,且可通过增加夜间尿钠排泄,继而加重晨间OH发作[11]。上述问题为临床上如何有效管理PD患者带来了极大的困难和挑战。基于以上背景,在国内多位知名运动障碍疾病专家及高血压专家紧密合作的基础上,结合自身临床实践经验及国内外最新进展,系统总结了PD血压管理的临床处理原则及推荐建议,并对如何判断不同类型的血压异常进行了归类和推荐,提出了针对性的干预策略,在国内推出PD血压管理的专家共识,并期待随着实践经验总结和研究进展,后续将不断更新和修订。本共识所提出的血压管理建议依据欧洲心脏病/高血压协会2018年高血压管理指南进行推荐级别和证据等级的划分[12]。
血压管理的原则和要求
非运动症状是降低PD患者QoL的重要原因[13]。血压异常作为PD患者的一种非运动症状,在进行临床管理时必须考虑到患者的整体状况,体现个体化、精准化的特点,以药物治疗为主,同时辅以必要的非药物疗法,以期使患者达到长期获益。总体而言,同PD的治疗原则一样,血压管理的原则和最终目标是立足于早期诊断、早期治疗,来改善患者的症状、消除诱因、提升QoL[14-15]。①初诊时常规对PD患者进行血压异常病史询问,了解患者有无血管危险因素及相关家族史;②初诊及病程中对PD患者进行常规血压评估监测,对于有血压异常病史的患者可推荐24 h动态血压监测(ambulatory blood pressure monitoring,ABPM),并结合病史、体格检查,确定血压异常的类型,予以对症干预,推荐有能力者进行家庭血压监测并及时与医师沟通[14];③制定及调整抗PD药物治疗方案时,需要兼顾患者的血压状况[15]及正在服用调控血压药物(如降压或升压药物种类、剂量、疗效及不良反应)的相互影响;④推荐神经内科医师和心血管科和(或)高血压科医师以多学科诊疗模式(multiple disciplinary team,MDT)协作管理PD患者的血压。
血压异常的类型、处理原则及推荐
一、OH
1.机制:OH被认为是一种代表心血管自主神经功能的障碍,常与去甲肾上腺素分泌不足有关,表现为患者直立时静脉回流的减少无法通过心血管适应机制补偿。
2.诊断标准:患者在平卧休息至少15 min后测得卧位血压,由仰卧位变成直立位或者倾斜试验60°后的3 min内测量立位血压,若收缩压下降≥20 mmHg(1 mmHg=0.133 kPa)或者舒张压下降≥10 mmHg[16],则可诊断为OH。
3.流行病学:不同研究所报道的OH发生率不同,可能系人口和方法学差异所致。65岁以上人群OH的总体发生率约为20%[17]。一项纳入25项临床研究的荟萃分析报道,PD患者中约30%伴有OH[18];另一项研究显示,有50%的PD患者符合20/10 mmHg的诊断标准,其中约33%出现明显的OH症状[19]。
4.临床处理原则及推荐建议:OH的治疗目标并非将患者的直立血压调整至正常水平,而是着重减轻其症状负担,改善生活,减少死亡率及致残率[20]。
(1)非药物治疗:①首先应寻找并去除加重因素。减少血容量的药物如利尿剂,扩血管药物如硝酸盐类药物,作用于神经血管接头阻断去甲肾上腺素释放的药物如肾上腺素α 受体(α 受体)拮抗剂、中枢性α2受体激动剂以及三环类抗抑郁药,都会加重OH及其症状。左旋多巴和多巴胺受体激动剂也会降低血压(详见四、抗PD药物相关的血压异常),应基于个体风险受益评估作出相应的剂量调整。②无症状型OH患者可能无需治疗或局限于非药物治疗,但应注意减少或避免高糖饮食以及咖啡和酒精的摄入(因其具有利尿性而可能加剧血容量的减少);改变饮食习惯,少食多餐(一次大量进食会使血液大量聚集在内脏血管床导致PPH,应予以重视)。同时要保证2.0~2.5 L/d的液体摄入,且建议在日常饮食中增加1~2匙的盐分,以维持体内的水钠含量。可规律性地进行以坐位为主的体育锻炼,如收腹、交叉下肢以及划船运动,以增强患者血压调节的能力。③缓慢而平稳地改变体位,或在由坐位和卧位变为直立位之间稍有停留。患者若有便秘症状需要积极干预[21],因为排便过程中的瓦尔萨尔瓦动作(Valsalva动作)可能导致晕厥[22]。④穿戴弹力袜可增加15~20 mmHg的血压[23],但运动症状严重的患者可能穿戴困难,此时弹性腹带可以作为替代性选择辅具。
(2)药物治疗:非药物治疗无法缓解患者的症状时,应使用合适的药物干预。①应用肾上腺糖皮质激素治疗。氟氢可的松可增加肾脏对水钠的重吸收,从而增加血容量,激活机体对内源性儿茶酚胺的压力反应。但需注意,该药可能加重SH导致的靶器官损害加重,还可造成低血钾和踝关节水肿,应用时应注意增加高钾食物的摄入。一项随机双盲交叉的Ⅱ期试验显示,在治疗PD引起的OH中,氟氢可的松效果优于溴吡斯的明,氟氢可的松可显著提高舒张压,而溴吡斯的明则无此效果[24],氟氢可的松虽可增加外周卧位收缩压,但不会影响中心动脉压,而后者与心血管风险相关性更密切[24-25]。氟氢可的松推荐最大用量为0.2 mg/d。②使用α1受体激动剂治疗。米多君可有效升高直立位血压,合并SH者应避免使用,以减低脑出血风险[26]。此药对患者的心率没有影响,因其无法透过血脑屏障,故无中枢神经系统不良反应。但早期临床研究发现,心血管自主神经功能受损严重的患者在使用米多君治疗时,直立位平均动脉血压不升反降,因此应用米多君应确保患者保留一定的自主神经反射功能[27]。一项纳入87例症状性OH患者的随机开放研究结果显示,在改善OH症状方面,单用米多君效果最优,米多君与溴吡斯的明合用效果次之,单用溴吡斯的明也有效,但是效果较前2组差[28]。推荐米多君起始剂量为2.5 mg,每日2~3次,根据药物疗效和耐受情况,可间隔3 d增加1次剂量,最大单次剂量为10 mg,每日3次。此外,为防止SH,不应在晚餐后或就寝前4 h内服用;白天服用药物后不宜短期内(3~4 h)平卧。③应用去甲肾上腺素前体药物治疗。屈昔多巴可在体内被芳香族氨基酸脱羧酶(aromatic amino acid decarboxylase,AAAD)转化为去甲肾上腺素,从而改善交感神经系统去支配化。大剂量卡比多巴可以抑制AAAD,从而阻断屈昔多巴转化为去甲肾上腺素,应避免合用[29]。在一个纳入2项短期(1~2周)治疗和1项中期(8~10周)治疗的综合分析中,共307例PD合并症状性OH患者,其中150例给予屈昔多巴治疗,另外157例给予安慰剂对照,结果显示治疗组患者OH问卷(orthostatic hypotension questionnaire,OHQ)、OH症状评估 (orthostatic hypotension symptom assessment,OHSA)以及OH日常活动量表(orthostatic hypotension daily activity scale,OHDAS)的得分均显著降低,OH引起的几乎所有症状均得到改善[30]。推荐屈昔多巴单次剂量为100~600 mg,每日3次,具体剂量根据症状进行调整,可从最小剂量100 mg开始,每隔48 h增加100 mg,同时监测血压,至症状明显改善即可。④应用选择性去甲肾上腺素重摄取抑制剂。以托莫西汀为代表的去甲肾上腺素转运体阻断剂可以减少神经血管接头去甲肾上腺素的清除。最早托莫西汀是一种用于治疗注意力缺陷的药物,但研究发现其可以有效升高直立位血压。不良反应包括食欲减退、口干、失眠、恶心呕吐,偶见严重肝炎发生。在一项纳入69例症状性OH患者的随机单盲交叉试验中,托莫西汀与米多君治疗相比,坐位收缩压和舒张压差异无统计学意义,而直立位收缩压和舒张压在托莫西汀治疗组增幅更大,约7.5 mmHg。该研究结果显示,托莫西汀较米多君可更好地改善OH症状[31]。托莫西汀常用于治疗注意力缺陷,剂量较大,用于OH治疗时推荐用量不超过18 mg/d。⑤使用胆碱酯酶抑制剂治疗。以溴吡斯的明为代表的胆碱酯酶抑制剂,可以增强自主神经节处的胆碱神经递质传递。在一项随机双盲对照交叉试验中,溴吡斯的明升压效果不如氟氢可的松,对外周舒张压提升无明显作用,现已不常用[24]。一项单盲交叉试验结果显示,单用溴吡斯的明或托莫西汀均无法改善OH及其症状,但两者合用则可起效[32]。一项纳入87例症状性OH患者的随机开放标签试验结果显示,单用米多君的效果优于米多君联合溴吡斯的明,提示后者可能拮抗米多君的升压作用,而单用溴吡斯的明改善OH症状的效果最差[28]。目前不推荐单用溴吡斯的明治疗OH,可联合其他升压药物使用,单次剂量为60 mg,每日3次。⑥应用中药治疗。某些中药如升压汤、生脉饮、黄芪口服液等具有温和持久的升压作用[33],对PD合并慢性低血压患者可能具有一定疗效,但迄今尚缺少临床试验证据。上述药物疗效及不良反应见表1。
二、SH
1.机制:PD患者发生SH的机制尚未完全清楚,目前认为SH与卧位时外周血管阻力增加有关[39],但还未有关于PD与外周血管阻力关系的研究报道。由于PD患者存在交感神经系统受损,因此SH不太可能由交感神经活性增强所致。临床上SH的发生与OH密切相关[40-41],SH上升的幅度与OH下降的幅度呈正相关(r=0.57,P<0.000 1),而与心肌迷走-压力反射增益(baroreflex-cadiovagal gain)呈负相关(r=-0.39,P=0.01)[42]。
2.诊断标准:目前SH诊断标准尚未有明确定义。本共识推荐诊断参照普通高血压的诊断标准,3次非同日诊室血压≥140/90 mmHg,或24 h ABPM中清醒状态卧位血压(最少7个读数)平均值≥135/85 mmHg,或夜间睡眠状态卧位血压(最少7个读数)平均值≥120/70 mmHg即可诊断为SH[12]。
3.流行病学:临床上由于患者就诊时较少测量平卧位血压,且很少伴有明显症状,所以SH常不易被发现。65岁以上PD患者中约26%存在动脉血压增高,不合并OH的PD患者中24 h动态血压昼夜节律消失者约占31.6%,而在合并OH的PD人群中,这一百分比高达94.7%[43]。一项纳入72例新发PD患者的横断面研究显示,SH发生率为45.8%[7]。

表1 PD患者OH的药物治疗推荐
4.临床处理原则及推荐建议:SH治疗目的是在不加重低血压的条件下尽量避免终末靶器官损害,以降低死亡率和致残率。尤其对于同时合并OH的患者,更要积极处理,避免出现恶性循环,尤其是夜间SH会通过促进尿钠排出而加重清晨OH[39]。
SH的非药物治疗以避免日间平卧位为最佳方案。患者休息时应使用倾斜座椅,双脚尽量着地,以减少回心血量。夜间休息可将床头抬高30°~45°。
SH药物治疗推荐使用中短效降压药物[44]。①血管紧张素转化酶抑制剂及血管紧张素受体阻滞剂是临床应用较为广泛的降压药物[45]。在一项纳入12例原发性自主神经功能障碍患者,包括7例多系统萎缩(multiple system atrophy,MSA)患者和5例单纯自主神经功能障碍 (pure autonomic failure,PAF)患者及7名健康者的对照研究中,50 mg卡托普利可以显著降低自主神经功能障碍患者的平均动脉压,而对健康对照者无明显影响[46]。一项纳入11例原发性自主神经功能障碍患者 (5例MSA和6例PAF)和10名健康对照的随机双盲安慰剂对照试验研究结果显示,睡前服用50 mg氯沙坦可在服药6 h后大幅降低卧位收缩压[(32±11) mmHg,P<0.05],并且该药可减少夜间尿钠排泄,不加重神经源性OH,适用于OH合并SH的PD患者[47]。②国外有报道,奈必洛尔作为第三代β 受体拮抗剂,可以有效降低患者夜间血压[48],并且不会加重晨起OH,患者能够较好耐受。选择性盐皮质激素受体拮抗剂依普利酮可以有效降低夜间血压,尚待临床证据验证其是否会加重OH。但目前这2种药物尚未在国内普及使用。③可乐定是一种α2受体激动剂,可以有效降低夜间血压,但为避免加重晨起OH,应于前1 d傍晚服用[49]。④硝酸甘油经皮贴剂常作为辅助手段治疗SH,应注意清晨需及时移除[50]。一项纳入了13例自主神经功能障碍患者的随机单盲对照试验,比较了硝酸甘油经皮贴剂和口服硝苯地平对SH合并OH的疗效,与安慰剂对照相比,两者均可降低患者卧位收缩压[(36±10)mmHg、(37±9)mmHg],但口服硝苯地平会加重晨起OH症状,而硝酸甘油经皮贴剂若及时移除则无此效果[51](见表2)。
本共识推荐,卡托普利于睡前服用,单次剂量为12.5~50.0 mg,根据血压监测情况调整用量;氯沙坦于睡前服用,单次推荐剂量50 mg,可根据药效和耐受性最大增加至100 mg;可乐定于傍晚服用,起始剂量0.1 mg,如效果不明显,可每次增加0.1 mg,最大增至0.9 mg。
三、PPH
1.机制:目前对PPH的发生机制尚未完全清楚,认为可能是由餐后内脏血池容量增加、外周血管阻力下降,而患者交感神经系统反应迟钝,无法有效代偿、维持血压稳定所致[52]。
2.诊断标准:餐后2 h内收缩压下降20 mmHg以上则可诊断为PPH。
3.流行病学:PD患者餐后血压较正常对照者更易降低,在PD合并OH的患者中,约有52.8%同时存在PPH[43]。荟萃分析显示,53.2%的PD患者存在PPH[53]。此外,女性及合并便秘者更易出现PPH[54]。
4.临床处理原则及推荐建议:PD患者应当尽早养成少食多餐、低糖摄入的饮食习惯,饭后尽量避免独自外出,以免发生意外。
有研究显示,生长抑素类似物奥曲肽[55-56]和α 葡萄糖苷酶抑制剂阿卡波糖、伏格列波糖[57-58]等可能有效阻止糖分摄入引起的低血压。①在一项纳入了10例高血压患者和10名正常血压个体的随机双盲交叉对照研究中,于口服葡萄糖测试之前给予受试人员皮下注射安慰剂和醋酸奥曲肽(50 μg)处理。结果显示,高血压患者中安慰剂处理组口服葡萄糖后的平均动脉压下降(15±1)mmHg,正常血压者安慰剂处理组口服葡萄糖后平均动脉压下降(7±2)mmHg,而皮下注射醋酸奥曲肽处理使得这种血压改变不再显著,因此餐前给予皮下注射醋酸奥曲肽50 μg可能改善PPH状况[55]。②在一项纳入13例PPH患者的临床试验研究中,首先抽取其中4例患者进行阿卡波糖和安慰剂对照的随机单盲交叉试验,以确保患者对药物有良好耐受,而后剩余患者进行随机双盲对照试验。结果显示,阿卡波糖可有效降低餐后收缩压和舒张压的下降程度(分别为17 mmHg、P=0.003和9 mmHg、P=0.001),表明100 mg阿卡波糖可有效改善自主神经功能障碍患者PPH情况[57]。③另一项临床对照研究中,从48例入组者里通过空腹血糖测验筛选出10例PPH患者(4例PD、5例MSA、1例糖尿病患者)和1名正常老年对照,同时记录血压改变,再次进行测试,并在口服75 g葡萄糖之前,给予伏格列波糖干预,继而比较在口服葡萄糖前给予伏格列波糖与非给予时(对照组)的血压变化情况。结果显示,给予伏格列波糖时口服葡萄糖后血压降低幅度[(21.0±13.0)mmHg]较对照组[(41.5±13.2)mmHg]有所减少(P<0.01),表明伏格列波糖可有效减少PPH的血压降低幅度[59](见表3)。

表2 PD患者SH的药物治疗推荐
故本共识推荐,使用奥曲肽(餐前即刻皮下注射,单次剂量0.05 mg)、α 葡萄糖苷酶抑制剂阿卡波糖(餐前即刻服用,单次剂量50~100 mg)、伏格列波糖(餐前即刻口服,单次剂量0.2 mg),但对PD患者PPH的有效性尚待充足的临床证据进一步证实。
四、抗PD药物相关的血压异常
1.机制:与抗PD药物的不良反应直接相关。
2.诊断标准:服用抗PD药物后(通常30 min内)出现的血压异常,常为OH,偶为高血压[60]。
3.流行病学:左旋多巴治疗可能导致19%~49%的PD患者出现OH[61],司来吉兰(selegiline)治疗可能导致30%~50%的PD患者出现OH[62],金刚烷胺尚未见报道有血压相关的不良反应。
4.临床处理原则及推荐建议:许多抗PD的药物都有可能扰乱自主神经功能,诱发或加重PD患者的血压异常。
(1)多巴胺前体及受体激动剂:既往有病例报道左旋多巴引起OH[25,63],多巴胺受体激动剂能够激活血管平滑肌突触后型多巴胺受体诱导外周血管扩张,引起OH,在中枢则可激活促神经型多巴胺受体,减弱交感神经系统活动,继而导致血压降低[64]。溴隐亭和普拉克索的OH发生率分别为12.5%和5.77%[65]。
(2)单胺氧化酶(monoamine oxidase,MAO)抑制剂:OH是司来吉兰常见的不良反应[66]。一项比较司来吉兰、左旋多巴及两药合用3种治疗方案对OH影响的临床试验中,纳入95例PD患者,其中10例接受司来吉兰单药治疗,49例接受左旋多巴或卡比多巴单药治疗,36例接受左旋多巴或卡比多巴联合司来吉兰治疗。结果显示,司来吉兰治疗过程中出现OH的发生率为50%,左旋多巴为49%,而两药合用其发生率达61%[67]。
(3)儿茶酚-O-甲基转移酶(catechol-O-methyltransferase,COMT)抑制剂:临床上合用恩他卡朋(entacapone)与左旋多巴可增强后者疗效,但同时OH发生风险也相应增加[68]。
(4)金刚烷胺:目前尚未有关于金刚烷胺引起血压异常的文献报道。
(5)其他:值得注意的是,某些抗PD药物与其他药物联用时也可以引起高血压,如环苯丙胺(一种非选择性MAO抑制剂)联合左旋多巴使用时有诱发高血压倾向。口服环苯丙胺30 mg/d联合左旋多巴50~200 mg/d可升高收缩压20 mmHg[69]。有报道发现,MAO-B抑制剂与大剂量(3 000 mg)多巴胺合用时可诱发高血压[70]。
故本共识推荐,对于药物引起的低血压或高血压,应及时调整剂量以使患者能够耐受,如无改善,可换用其他药物或联合升(降)压药物进行及时干预。
要点及流程总结
建议对PD患者进行分类管理,以便发现潜在的血压异常并作出及时、有效的应对措施,对PD患者首要应当加强教育,增进其对疾病的认识,积极配合治疗,以避免发生严重不良事件(见图1)。①建议对所有PD患者进行常规血压(卧、立位血压)的评估;②强烈建议对既往合并有异常血压病史的PD患者及时进行24 h ABPM,无论有无症状;③建议对确诊OH合并SH的PD患者实施24 h ABPM随访,处理时更需小心谨慎,若处理不当极易造成剧烈的血压波动,形成恶性循环;④神经内科医师,尤其是运动障碍病专科医师,需要在心内科及高血压科医师的协助下,依据监测结果对PD患者的血压进行适当干预并作为治疗效果的判定标准,从而减少血压波动造成的不良后果。

表3 PD患者PPH的药物治疗推荐
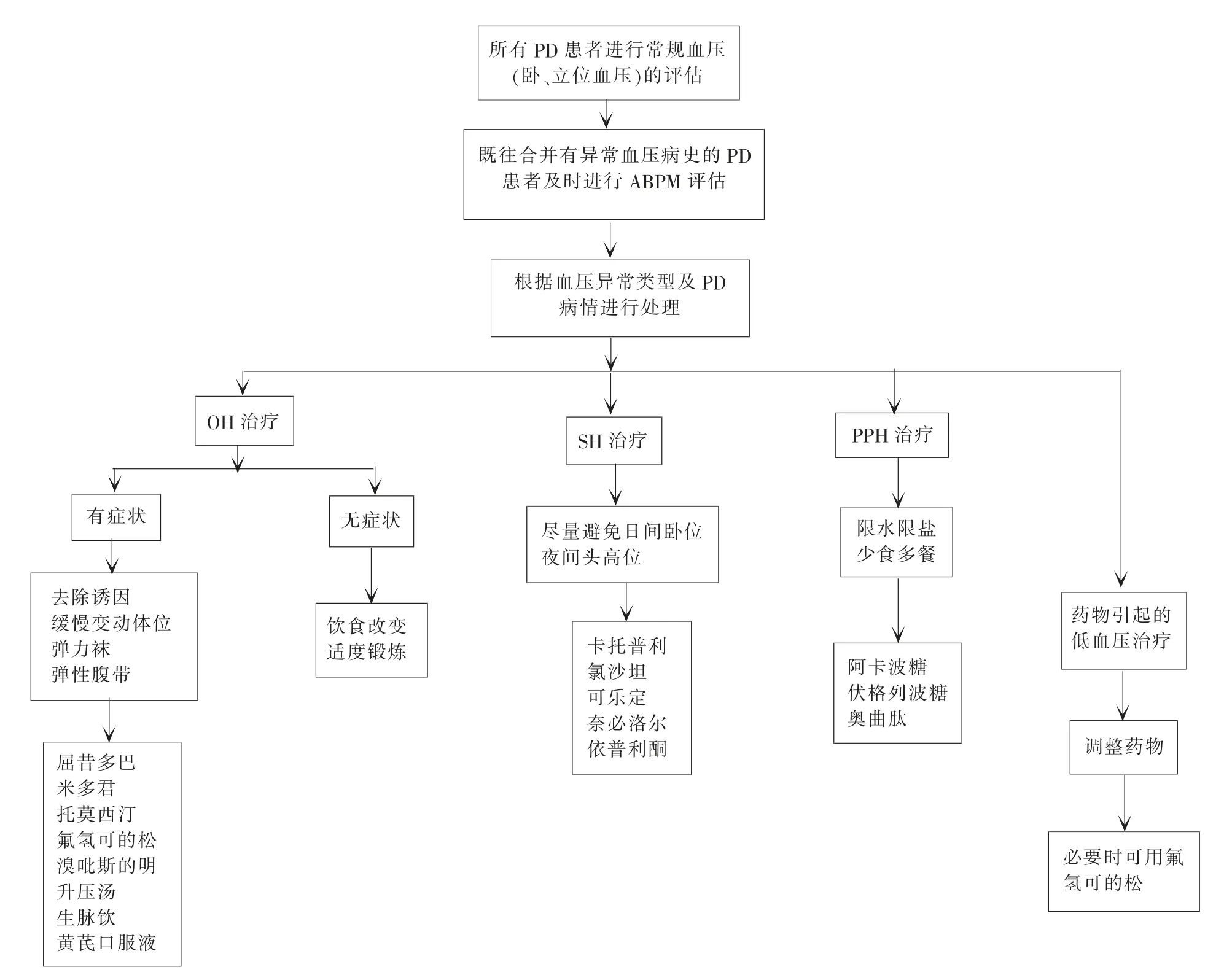
图1 PD患者血压异常的处理流程
