雷替曲塞联合伊立替康治疗晚期结直肠癌的近期疗效及对远期生存时间的影响
2020-12-06赵楠
赵楠
(中国人民解放军联勤保障部队第九八九医院结直肠乳腺疝外科 河南洛阳471000)
结直肠癌是最多见的消化系统恶性肿瘤性疾病,由于肠道血供丰富,初诊患者经规范化治疗后远期复发率仍较高。对复发性晚期结直肠癌患者,保守治疗是延长其生存时间的最主要方法,但不同化疗方案的疗效及毒副作用均存在差异,选择何种治疗方案在临床中争议较大[1]。FOLFIRI 化疗已在晚期结直肠癌中应用较多,使用伊立替康与亚叶酸钙、5-氟尿嘧啶(5-FU)进行配伍,可获得一定疗效。但由于5-FU 毒副作用发生率较高,制约了该方案的临床应用。雷替曲塞是一种胸苷酸合成酶抑制剂,目前已在晚期胃癌、胰腺癌等消化系统恶性肿瘤的治疗中获得成功应用,故有学者推荐将其用于晚期结直肠癌治疗[2]。本研究回顾性分析晚期结直肠癌患者的临床资料,探讨雷替曲塞联合伊立替康治疗的近期及远期疗效,以期为化疗方案选择提供借鉴。现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析我院2015 年9 月~2018 年1 月收治的晚期结直肠癌患者119 例的临床资料,按照化疗方案不同分为对照组57 例接受FOLFIRI 化疗,研究组62 例接受雷替曲塞联合伊立替康化疗。对照组男30 例,女27 例;年龄43~76岁,平均(58.36±12.59)岁;病种分布:结肠癌32 例,直肠癌25 例;病程6 个月~7 年,平均(3.72±0.85)年。研究组男34 例,女28 例;年龄41~75 岁,平均(58.78±11.49)岁;病种分布:结肠癌35 例,直肠癌27 例;病程5 个月~8 年,平均(3.81±0.92)年。两组患者性别、年龄、病种、病程分布等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 入组标准 纳入标准:经肠镜组织病理检查确诊原发性结直肠癌,肿瘤分期为晚期;既往治疗后复发病例;停止化疗≥30 d,且既往无雷替曲塞治疗史;预计生存时间≥3 个月;患者肝肾功能及血常规等检测结果符合化疗条件;不伴有严重精神疾病,可进行基础沟通并配合治疗;患者及其家属签署知情同意书。排除标准:合并其他原发恶性肿瘤性疾病;合并基础性自身免疫性疾病;合并全身感染性疾病;合并严重营养不良。
1.3 病例脱落标准 治疗过程中出现可危及生命的严重毒副作用,导致治疗被迫中断;未经主管医师允许、主动中断治疗;治疗期间死亡病例;拒绝治疗后随访。
1.4 治疗方案 对照组接受FOLFIRI 化疗,伊立替康(国药准字H20068128)170 mg/m2,静脉滴注(90 min 内滴注完毕),第1 天;亚叶酸钙(国药准字H20080718)0.1 g、静脉滴注,第1 天~第5 天;5-氟尿嘧啶(国药准字H31020593)500 mg/m2,静脉滴注,第1 天~第5 天。3 周为1 个疗程,持续治疗2周后评估疗效。研究组接受雷替曲塞联合伊立替康治疗,雷替曲塞(国药准字H20090325)3 mg/m2,静脉滴注(15 min 内滴注完毕),第1 天;伊立替康170 mg/m2,静脉滴注(90 min 内滴注完毕),第1 天。以3周为一个疗程,持续治疗2 周后评估疗效。
1.5 近期疗效评估 参照实体瘤治疗反应评价标准(RECIST)[3]评估晚期结直肠癌患者的近期疗效,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)四类。客观缓解率(ORR)=CR 率+PR 率;疾病控制率(DCR)=CR 率+PR 率+SD 率。
1.6 观察指标 (1)两组临床疗效比较。(2)两组治疗前后结直肠癌相关肿瘤标志物、免疫细胞分布例比较。治疗前后采集两组患者空腹外周血标本2 份(每份约5.0 ml),抗凝处理后取1 份分离血清并采用酶联免疫吸附法测定其中糖类抗原19-9(CA19-9)、糖类抗原125(CA125)、糖类抗原242(CA242)等结直肠癌相关肿瘤标志物的含量;取另1 份直接经流式细胞仪(赛默飞世尔科技公司生产,型号AttuneNxT)测定CD4+T 淋巴细胞、自然杀伤(NK)细胞、细胞因子诱导杀伤(CIK)细胞、Treg 细胞等免疫细胞的分布比例。(3)两组药物毒副作用比较。治疗期间,记录常见药物毒副作用发生情况,包括中性粒细胞减少、血小板减少、恶心呕吐、腹泻、口腔黏膜炎、肝肾功能损伤。(4)两组远期生存情况比较。化疗完成后进行为期2 年的随访,记录两组患者1 年、2 年生存率以及平均生存时间。2 年内死亡病例以死亡时间点作为随访终点,其余以治疗结束当日至其后2 年作为随访终点。
1.7 统计学方法 采用SPSS20.0 统计学软件分析处理数据。计数资料(ORR、DCR、药物毒副作用发生情况、生存率)以%表示,采用χ2检验;计量资料(肿瘤标志物、免疫细胞比例、平均生存时间)以(±s)表示,采用t检验,等级资料(近期疗效),采用秩和检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组近期疗效比较 研究组患者治疗后ORR、DCR 水平均高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组近期疗效比较[例(%)]
2.2 两组治疗前后结直肠癌相关肿瘤标志物含量比较 治疗前两组血清结直肠癌相关肿瘤标志物CA19-9、CA125、CA242 含量比较,差异无统计学意义(P>0.05)。治疗后两组血清CA19-9、CA125、CA242 含量均低于治疗前,且研究组低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后结直肠癌相关肿瘤标志物含量比较(±s)
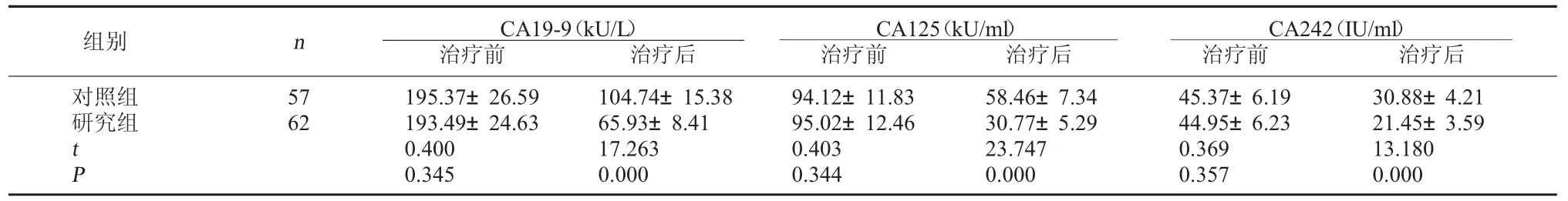
表2 两组治疗前后结直肠癌相关肿瘤标志物含量比较(±s)
CA242(IU/ml)治疗前 治疗后对照组研究组组别 n CA19-9(kU/L)治疗前 治疗后CA125(kU/ml)治疗前 治疗后57 62 t P 195.37±26.59 193.49±24.63 0.400 0.345 104.74±15.38 65.93±8.41 17.263 0.000 94.12±11.83 95.02±12.46 0.403 0.344 58.46±7.34 30.77±5.29 23.747 0.000 45.37±6.19 44.95±6.23 0.369 0.357 30.88±4.21 21.45±3.59 13.180 0.000
2.3 两组治疗前后免疫细胞分布比较 治疗前两组外周血中免疫细胞CD4+、NK、CIK、Treg 分布比较(P>0.05)。治疗后两组外周血中CD4+、NK、CIK细胞比例高于治疗前,Treg 细胞比例低于治疗前,且研究组外周血中CD4+、NK、CIK 细胞比例高于对照组,Treg 细胞比例低于对照组(P<0.05)。见表3。
表3 两组治疗前后免疫细胞分布比较(%,±s)

表3 两组治疗前后免疫细胞分布比较(%,±s)
Treg治疗前 治疗后对照组研究组组别 n CD4+治疗前 治疗后NK治疗前 治疗后CIK治疗前 治疗后57 62 t P 35.38±4.91 35.47±4.85 0.101 0.460 40.17±5.43 43.85±5.69 3.602 0.000 12.17±1.65 12.25±1.87 0.247 0.403 12.95±1.79 13.77±2.04 2.322 0.011 7.49±0.91 7.52±0.96 0.172 0.431 8.07±0.95 8.95±0.98 4.966 0.000 6.10±0.68 6.13±0.65 0.246 0.403 5.62±0.62 5.07±0.54 5.171 0.000
2.4 两组药物毒副作用比较 治疗期间,研究组出现中性粒细胞减少、血小板减少、恶心呕吐、腹泻、口腔黏膜炎、肝肾功能损伤等毒副作用发生率低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 两组药物毒副作用比较[例(%)]
2.5 两组远期生存情况比较 随访期内,研究组1年生存率、2 年生存率均高于对照组,研究组平均生存时间长于对照组,差异有统计学意义(P<0.05)。见表5。
表5 两组远期生存情况比较(±s)

表5 两组远期生存情况比较(±s)
组别 n 存活率[例(%)]1 年 2 年平均生存时间(月)对照组研究组χ2/t P 57 62 8(14.03)19(30.64)4.671 0.031 2(3.50)9(14.51)4.289 0.038 10.34±1.85 12.59±2.43 5.646 0.000
3 讨论
晚期结直肠癌的化疗方案选择恰当与否将直接决定其近期肿瘤缩小情况以及远期生存率。FOLFIRI 化疗方案在不同研究中均证实有效,方案中伊立替康属于半合成水溶性喜树碱类衍生物,通过与拓扑异构酶Ⅰ及DNA 形成复合物、引起DNA单链断裂,最终阻止DNA 复制及抑制RNA 合成[4];5-FU 是结直肠癌治疗的基本药物,与亚叶酸钙联用后可增加自身抗肿瘤作用,但大剂量长时间应用后毒副作用明显,可削弱预期疗效甚至导致患者治疗中断[5]。鉴于FOLFIRI 化疗方案存在的局限性,因此,临床需寻求高效安全的治疗方法。雷替曲塞是抗代谢类叶酸类似物,通过特异性抑制胸苷酸合成酶(TS)、阻断胸腺嘧啶脱氧核苷三磷酸盐合成过程、阻碍DNA 合成而发挥抗癌作用,其与伊立替康配伍组成的新型化疗方案目前备受关注。
本研究结果显示,研究组接受雷替曲塞联合伊立替康化疗,治疗2 个周期后ORR、DCR 水平显著高于应用FOLFIRI 化疗的对照组患者,表明雷替曲塞联合伊立替康化疗在提升晚期结直肠癌患者治疗有效性方面的积极作用。肿瘤标志物检测是临床筛查恶性肿瘤存在与否的最常规及简便手段,也是恶性肿瘤治疗后疗效评估的辅助方式之一。CA19-9、CA125、CA242 均是与结直肠癌关系较为密切的标志物,其中CA19-9 用于消化系统肿瘤筛查的敏感性及特异性均较高,CA125、CA242 属于广谱肿瘤标志物,与CA19-9 联用可提高其筛查价值。研究结果还显示,治疗后两组血清中CA19-9、CA125、CA242 的含量均呈下降趋势,且研究组下降更为显著,说明两种治疗方法均可缓解晚期结直肠癌患者病情,而雷替曲塞联合伊立替康治疗的抗肿瘤作用更为显著,这也与上文中该方案应用后ORR、DCR水平更高这一结论吻合。分析原因可能与雷替曲塞可被转化为聚谷氨酸盐形式贮存于癌细胞中,发挥强效、直接的抗TS 作用相关[6]。
免疫功能紊乱在恶性肿瘤发生发展过程中均有重要意义,国内外研究[7~9]均证实晚期结直肠癌患者存在天然免疫功能屏障以及特异性免疫应答功能的双重障碍,导致机体抗肿瘤免疫功能削弱并出现免疫逃逸,这也是癌细胞发生远处转移的免疫学机制。CD4+T 淋巴细胞是细胞免疫发挥抗肿瘤作用的主体,恶性肿瘤持续进展可导致分布比例下降、功能受抑制,机体细胞免疫功能受抑制。NK 是天然免疫屏障的主要组成部分,可不经抗原递呈途径而直接杀伤异常细胞,是机体抗肿瘤免疫的重要组成部分[9]。CIK 细胞又被称为NK 细胞样T 淋巴细胞,兼具T淋巴细胞的抗瘤活性以及NK 细胞的非MHC 限制性杀瘤优点,孔娟等[10]的研究指出CIK 细胞可有效增强机体的结直肠癌细胞杀灭作用。Treg 细胞是重要的T 淋巴细胞亚型之一,其分布比例增加是导致机体出现免疫耐受的最重要原因之一。本研究两组患者治疗后外周血中CD4+、NK、CIK 细胞比例均较治疗前增加,而Treg 细胞比例较治疗前下降,且这一变化趋势在研究组患者中更为显著,说明雷替曲塞联合伊立替康较FOLFIRI 化疗在调节患者免疫功能、增强机体抗肿瘤免疫方面的作用更为显著,这可能也是该化疗方案整体疗效更优的重要免疫学原因。
FOLFIRI 化疗方案中5-FU 是引起患者药物毒副作用高发的主要原因,具体包括骨髓抑制、胃肠道反应、皮肤损伤、重要组织脏器功能异常等。本研究结果显示,研究组患者治疗期间中性粒细胞减少、血小板减少、恶心呕吐、腹泻、口腔黏膜炎、肝肾功能损伤等发生率均较对照组低,说明雷替曲塞治疗具有相对较好的安全性。对两组患者进行为期2 年的长时间随访,发现研究组1 年及2 年生存率较高,平均生存时间较长,从远期疗效层面证实了雷替曲塞联合伊立替康治疗方案的优越性。但本研究纳入病例数相对较少,可能对该数据结果的准确性产生一定影响。
综上所述,雷替曲塞联合伊立替康用于晚期结直肠癌患者,相较于传统FOLFIRI 化疗方案,在近期疗效及用药安全性方面均更具优势,同时可优化远期治疗效果,是一种更为理想的治疗配伍方案。但本研究病例收集时间相对较短、入组病例样本量不大,可能对最终数据产生一定偏倚,有待后续大样本研究进一步展开明确上述结论。
