美极梅奇酵母T-2灌胃对小鼠的毒性作用
2020-12-01艾丹常若葵张斌于玮玮王远宏
艾丹,常若葵,张斌,于玮玮,王远宏,*
(1.天津农学院园艺园林学院,天津300384;2.天津农学院工程技术学院,天津300384)
近年来,随着生活水平的提高,人们对水果的需求与日俱增,水果采后腐烂问题也变得愈发凸显,而通过微生物控制水果采后病害作为化学保鲜剂的良好替代品,已成为当下研究的热点和发展趋势,且与传统化学农药相比,生物防治具有良好的环境相容性和生物安全性[1]。其中,酵母菌因其遗传稳定、抑菌谱广、对营养条件要求低、生长迅速、能够在水果表面定殖等诸多优点而受到广泛关注[2-3]。
本研究中的美极梅奇酵母(Metschnikowia pulcherrima)是从蓝莓果实上分离筛选出的酵母菌种,该酵母菌不仅可以对水果采后灰霉菌和链格孢菌有较强的抑制作用,还可以有效抑制青霉和芽枝霉菌,是一株具有开发潜力的采后生防酵母菌,鉴于生防酵母菌作为活体生物杀菌剂,对水果采后病原菌的抑制往往建立在菌株安全的基础上,因此其安全性是影响公众接受度的最主要因素[4]。因此,对生防菌的安全性进行评估,特别是就生防菌株本身及其代谢产物对动物和人体的毒性进行评价尤为必要[5-8]。而目前针对该酵母菌安全性的研究还未见报道,本文以昆明种鼠为实验材料,参照GB 15193.1-2014《食品安全国家标准食品安全性毒理学评价程序》[9],测定了不同剂量美极梅奇酵母菌T-2发酵液对大鼠的急性经口毒性、遗传毒性试验及30 d经口毒性的影响,对其进行安全性评价,为今后新资源的开发和商业化实践生产提供科学的理论依据。
1 材料与方法
1.1 实验菌株及实验动物
菌株:酵母菌T-2由天津农学院植物病理实验室从蓝莓果实分离并保存,经初步鉴定为梅奇酵母属(Metschnikowia sp.)。
实验动物:清洁级昆明种小鼠,雌雄各半,年龄在3~4个月之间,体重18 g~20 g;清洁级成年大鼠,雌雄各半,体重180 g~220 g。供试鼠及饲料均购于中国人民解放军军事医学科学院实验动物中心。饲养室温度20℃~25℃,自由摄食和饮水[10]。鼠笼垫料及饮水壶每2 d更换并进行清洗,以保持清洁。
1.2 药剂、试剂和仪器
AMES试剂盒:北京汇智泰康医药技术有限公司;环磷酰胺:上海源叶生物科技有限公司;吉姆萨染液、磷酸盐缓冲液(phosphate buffered salin,PBS)、苏木素、伊红:Solarbio公司;品红、酒精、甲醇、甲醛、二甲苯:分析纯,天津风船化学试剂有限公司;分化液、返蓝液:广州市凯秀贸易有限公司。
AX224ZH/E型电子天平:奥豪斯仪器(常州)公司;shinva高压灭菌锅:山东博科生物产业有限公司;DPX-9052B-2型电热恒温培养箱:上海福玛实验设备有限公司;SHP-250A型生化培养箱:上海培因实验仪器有限公司;Sigma3-16PK台式高速冷冻离心机:德国希格玛离心机公司;HI 1220烘片机、HI 1210展片机、RM2235切片机莱卡:德国徕卡公司;Microlab 300生化仪:合普机电工程(天津)有限公司;TEK-Ⅱ全自动三分群血细胞分析仪:江西特康科技有限公司。
1.3 菌株T-2发酵液的制备及浓缩
挑取在YPD平板上新鲜培养的T-2单菌落,接入到YPD液体培养基中,于28℃、200 r/min下摇培发酵48 h,菌体浓度约为1×1011cfu/mL,于12 000 r/min下冷冻离心2 min,使菌体沉淀,弃上清液,留菌体,加入0.5 mL YPD液体培养基,振荡混匀后备用;同时,将发酵液分别浓缩为10倍液(50 mg/L)、50倍原液(250 mg/L)、100倍原液(500 mg/L)和 400倍原液(2 000 mg/L),备用。
1.4 急性毒性实验
参照GB15193.3-2014《食品安全国家标准急性经口毒性试验》[11],实验按照限量法[11],取 20 只 180 g~220 g的清洁级昆明大鼠(n=10),雌雄各半,适应性饲养2 d~3 d。随机分组标号,禁食16 h后,设T-2菌体为10 g/kg剂量,按大鼠最大耐受容积(1 mL/只)对大鼠进行灌胃处理,以生理盐水为对照组,连续2次灌胃,间隔4h,观察14d,记录小鼠中毒症状和死亡时间[12-13]。
1.5 遗传毒性实验
1.5.1 Ames实验
选取经鉴定符合实验要求的4株鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100和TA102进行实验。以大鼠肝S-9混合液作为代谢活化系统,按AMES试剂盒说明书进行操作,受试物为灭活的酵母菌,实验分别设4个剂量组,各剂量组酵母菌浓度分别为 5×1010、1×1010、2×109、4×108CFU/皿,相当于 5、1、0.2、0.04 mg/皿。采用平板掺入法,每个菌株每个测试剂量均做3个平行皿,37℃下培养48 h后计数每皿回变菌落数。
1.5.2 精子畸变实验
取25只清洁级昆明成年雄鼠(n=5),适应性饲养2 d~3 d。随机分组标号,用T-2菌株的100倍原液(500 mg/L)、10倍原液(50 mg/L)、原液(5 mg/L)对小鼠进行灌胃处理(0.1 mL/只),阳性对照组灌胃环磷酰胺40 mg/(kgbw·d),阴性对照组为生理盐水组,连续5 d灌胃,末次灌胃后的第30天断颈处死;取其双侧附睾,撕开包膜,用吸管反复吸打多次,悬液制片,伊红染色。每只小鼠观察1 000个完整精子,记录各类畸形精子数,计算精子畸变率(%)[14]。
1.5.3 小鼠骨髓嗜多染红细胞微核实验
取50只18g~20g的清洁级昆明小鼠(n=10),雌雄各半,适应性饲养2 d~3 d。随机分组标号,用T-2菌株的100倍原液(500mg/L)、1/4的100倍原液(125mg/L)、1/16的100倍原液(31.25 mg/L)对小鼠进行灌胃处理(0.1mL/只),阳性对照组灌胃环磷酰胺40mg/(kgbw·d),阴性对照组为生理盐水组,连续2次灌胃,间隔24 h,末次灌胃6 h~12 h后,小鼠断颈处死,取股骨骨髓溶于小牛血清,涂片后甲醇固定,染色制片,油镜观察1000个嗜多染红细胞(polychromaticerythrocytes,PCE)及PCE微核发生率[15]。
1.6 30天经口毒性实验
取56只18 g~20 g的清洁级昆明小鼠(n=14),雌雄各半,适应性饲养2 d~3 d。随机分组标号,用酵母菌的 100倍原液(500 mg/L)、50倍原液(250 mg/L)、10倍原液(50 mg/L)对小鼠进行灌胃处理(0.1 mL/只),对照组灌胃等体积的生理盐水组,连续30 d灌胃,观察小鼠的活动和生长情况,每日记录其饮水量、摄食量,每2 d称体重1次,计算其食物利用率。30 d后眼球取血,测血液学和血液生化指标,处死后摘除指定内脏测其脏器指数,将各脏器用10%中性甲醛溶液固定,进行常规病理取材、制片和HE染色(苏木精-伊红染色法,hematoxylin-eosinstaining),显微镜下进行病理组织学检查[16]。
1.7 数据处理
统计方法采用SPSS统计软件进行分析,计量资料用均数±标准差(Mean±SD)表示,以P<0.05和P<0.01为差异,有统计学意义。
2 结果与分析
2.1 急性毒性实验
在观察期间内,灌胃T-2菌株的大鼠均未出现不良反应,72 h内各处理组未出现死亡现象,且各处理组的进食、饮水以及各种生命活动与对照相比均无明显异常;经连续饲养观察14 d,所有实验鼠生命表现依然正常。未见惊厥、被毛粗乱、行动异常等异常表现,生长情况良好,无死亡发生。结果表明,菌株T-2对大鼠的急性经口半致死剂量(LD50)>10 g/kg。表明T-2菌株的急性经口毒性为“无毒”级[11]。
2.2 遗传毒性实验
2.2.1 Ames实验
实验结果如表1所示。
加与不加S9的代谢活化系统,其自发回变组、溶剂对照组、阳性对照组均在正常范围,受试样品各剂量组回变菌落数均未见明显增加,未超过自发回变菌落数的2倍及以上,亦无剂量-反应关系(重复试验结果具有很好的重现性)。实验结果表明,在本实验条件下,该酵母菌在Ames实验中无致突变性。
表1 Ames实验结果(±s,n=3)Table 1 The results in Ames test(±s,n=3)
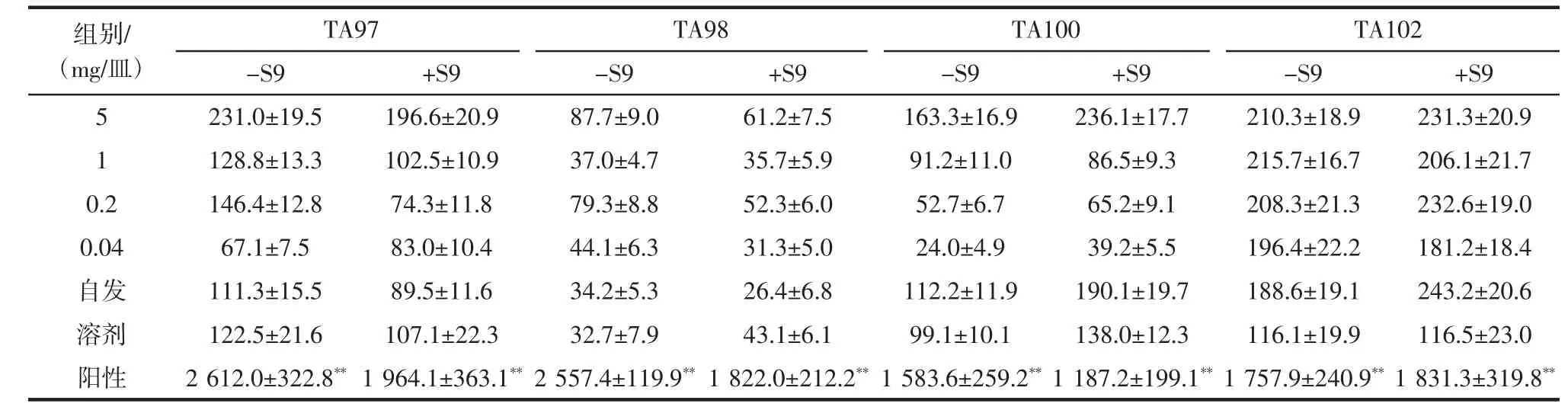
表1 Ames实验结果(±s,n=3)Table 1 The results in Ames test(±s,n=3)
注:**P<0.01,与溶剂对照组比较有极显著差异。
组别/(mg/皿)TA97 TA98 TA100 TA102-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 5 231.0±19.5 196.6±20.9 87.7±9.0 61.2±7.5 163.3±16.9 236.1±17.7 210.3±18.9 231.3±20.9 1 128.8±13.3 102.5±10.9 37.0±4.7 35.7±5.9 91.2±11.0 86.5±9.3 215.7±16.7 206.1±21.7 0.2 146.4±12.8 74.3±11.8 79.3±8.8 52.3±6.0 52.7±6.7 65.2±9.1 208.3±21.3 232.6±19.0 0.04 67.1±7.5 83.0±10.4 44.1±6.3 31.3±5.0 24.0±4.9 39.2±5.5 196.4±22.2 181.2±18.4自发 111.3±15.5 89.5±11.6 34.2±5.3 26.4±6.8 112.2±11.9 190.1±19.7 188.6±19.1 243.2±20.6溶剂 122.5±21.6 107.1±22.3 32.7±7.9 43.1±6.1 99.1±10.1 138.0±12.3 116.1±19.9 116.5±23.0阳性 2 612.0±322.8**1 964.1±363.1**2 557.4±119.9**1 822.0±212.2**1 583.6±259.2**1 187.2±199.1**1 757.9±240.9**1 831.3±319.8**
2.2.2 精子畸变实验
酵母菌株T-2对小鼠精子畸形率的影响如表2所示。
阳性对照组(环磷酰胺)小鼠精子畸形率为0.15%,畸变发生率极显著高于灌胃酵母菌的各剂量组及阴性对照组(生理盐水)(P<0.01),而酵母菌T-2各剂量组小鼠精子畸形率未出现明显增加,与阴性对照组(生理盐水)比较,无显著性差异(P>0.05)。说明在实验剂量范围内,菌株T-2对小鼠精子无致畸作用。
表2 小鼠精子畸形实验结果(±s,n=3)Table 2 Effect of T-2 on sperm abnormality rate in mice(±s,n=3)
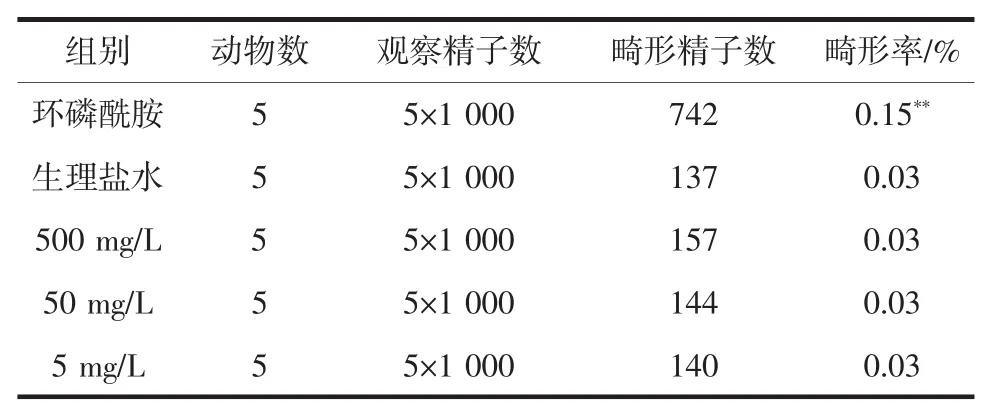
表2 小鼠精子畸形实验结果(±s,n=3)Table 2 Effect of T-2 on sperm abnormality rate in mice(±s,n=3)
注:**P<0.01,与生理盐水(阴性)对照组比较有极显著差异。
组别 动物数 观察精子数 畸形精子数 畸形率/%环磷酰胺 5 5×1 000 742 0.15**生理盐水 5 5×1 000 137 0.03 500 mg/L 5 5×1 000 157 0.03 50 mg/L 5 5×1 000 144 0.03 5 mg/L 5 5×1 000 140 0.03
2.2.3 小鼠骨髓嗜多染红细胞微核实验
菌株T-2对小鼠骨髓PCE微核实验的影响如表3所示。
表3 小鼠骨髓嗜多染红细胞微核实验结果(±s,n=3)Table 3 Effect of T-2 on microkernel rate of polychromatic erythrocytes in mice(±s,n=3)
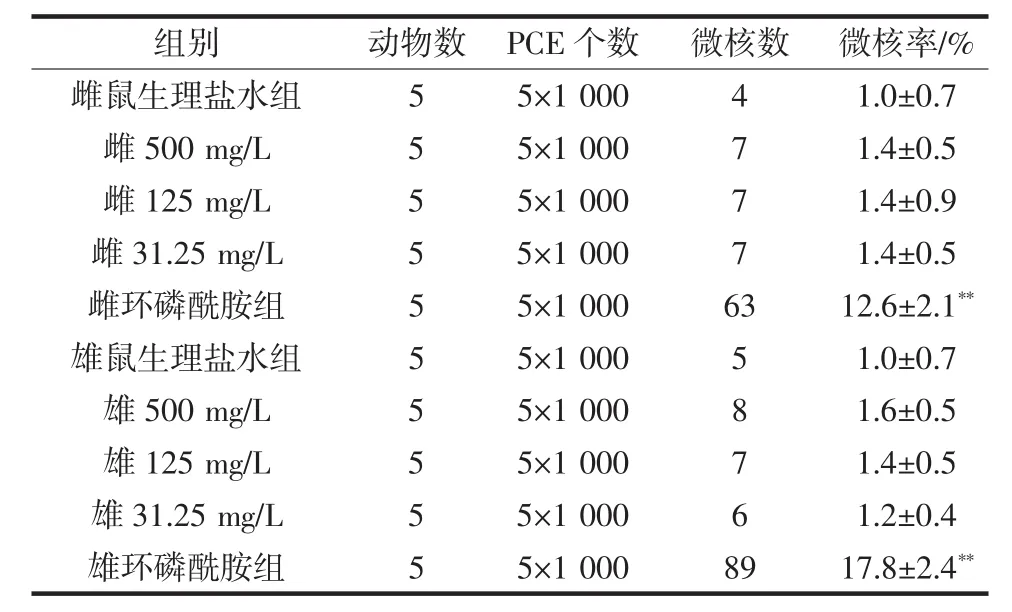
表3 小鼠骨髓嗜多染红细胞微核实验结果(±s,n=3)Table 3 Effect of T-2 on microkernel rate of polychromatic erythrocytes in mice(±s,n=3)
注:**P<0.01,与生理盐水(阴性)对照组比较有极显著差异。
组别 动物数 PCE个数 微核数 微核率/%雌鼠生理盐水组 5 5×1 000 4 1.0±0.7雌 500 mg/L 5 5×1 000 7 1.4±0.5雌 125 mg/L 5 5×1 000 7 1.4±0.9雌 31.25 mg/L 5 5×1 000 7 1.4±0.5雌环磷酰胺组 5 5×1 000 63 12.6±2.1**雄鼠生理盐水组 5 5×1 000 5 1.0±0.7雄 500 mg/L 5 5×1 000 8 1.6±0.5雄 125 mg/L 5 5×1 000 7 1.4±0.5雄 31.25 mg/L 5 5×1 000 6 1.2±0.4雄环磷酰胺组 5 5×1 000 89 17.8±2.4**
与小鼠精子畸形实验结果相似,环磷酰胺组即阳性对照组小鼠骨髓细胞的微核率极显著高于生理盐水组即阴性对照组微核率和菌株T-2各剂量组微核率(P<0.01)。各酵母菌剂量组小鼠骨髓细胞的微核率与阴性对照组比较无显著性差异(P>0.05)。说明在实验剂量范围内,菌株T-2不会对小鼠骨髓嗜多染红细胞微核造成显著影响,即菌株T-2的小鼠骨髓嗜微核实验结果为阴性。
2.3 小鼠30天经口毒性实验
小鼠生产性能实验结果见表4,小鼠血常规实验结果见表5,小鼠血生化实验结果见表6。
由表4可知,灌胃菌株T-2的高(500 mg/L)、中(250 mg/L)、低(50 mg/L)各剂量组雌鼠和雄鼠的生产性能(即体质量与摄食量)数据虽都有所增加,但变化幅度较小,未见明显的剂量依赖关系,且与对照组相比均无显著性差异(P>0.05)。说明菌株T-2对小鼠的生产性能(即体质量与摄食量)无明显影响。由表5、表6可知,灌胃菌株T-2高、中、低各剂量组小鼠的血常规指标和血液生化指标与对照组均无显著差异(P>0.05)。说明菌株T-2对小鼠的血液常规指标没有影响。灌胃菌株T-2各实验组小鼠心、肝、脾、肺、肾脏器指数与对照组均无显著差异(P>0.05),结果见表7。说明该菌株对小鼠的脏器指数没有影响。
表4 小鼠生产性能实验结果(±s,n=3)Table 4 Effect of T-2 on performance in mice(±s,n=3)
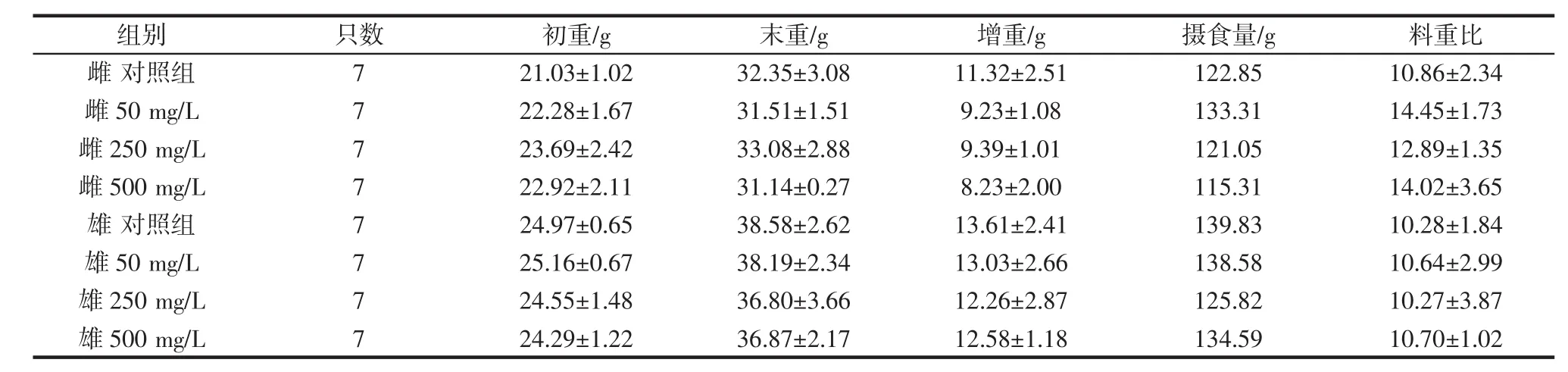
表4 小鼠生产性能实验结果(±s,n=3)Table 4 Effect of T-2 on performance in mice(±s,n=3)
注:P>0.05,与对照组比较,各处理组小鼠体重及摄食量指标无显著性差异。
组别 只数 初重/g 末重/g 增重/g 摄食量/g 料重比雌 对照组 7 21.03±1.02 32.35±3.08 11.32±2.51 122.85 10.86±2.34雌 50 mg/L 7 22.28±1.67 31.51±1.51 9.23±1.08 133.31 14.45±1.73雌 250 mg/L 7 23.69±2.42 33.08±2.88 9.39±1.01 121.05 12.89±1.35雌 500 mg/L 7 22.92±2.11 31.14±0.27 8.23±2.00 115.31 14.02±3.65雄 对照组 7 24.97±0.65 38.58±2.62 13.61±2.41 139.83 10.28±1.84雄 50 mg/L 7 25.16±0.67 38.19±2.34 13.03±2.66 138.58 10.64±2.99雄 250 mg/L 7 24.55±1.48 36.80±3.66 12.26±2.87 125.82 10.27±3.87雄 500 mg/L 7 24.29±1.22 36.87±2.17 12.58±1.18 134.59 10.70±1.02
表5 小鼠血常规实验结果(±s,n=3)Table 5 Effect of T-2 on blood routine index in mice(±s,n=3)
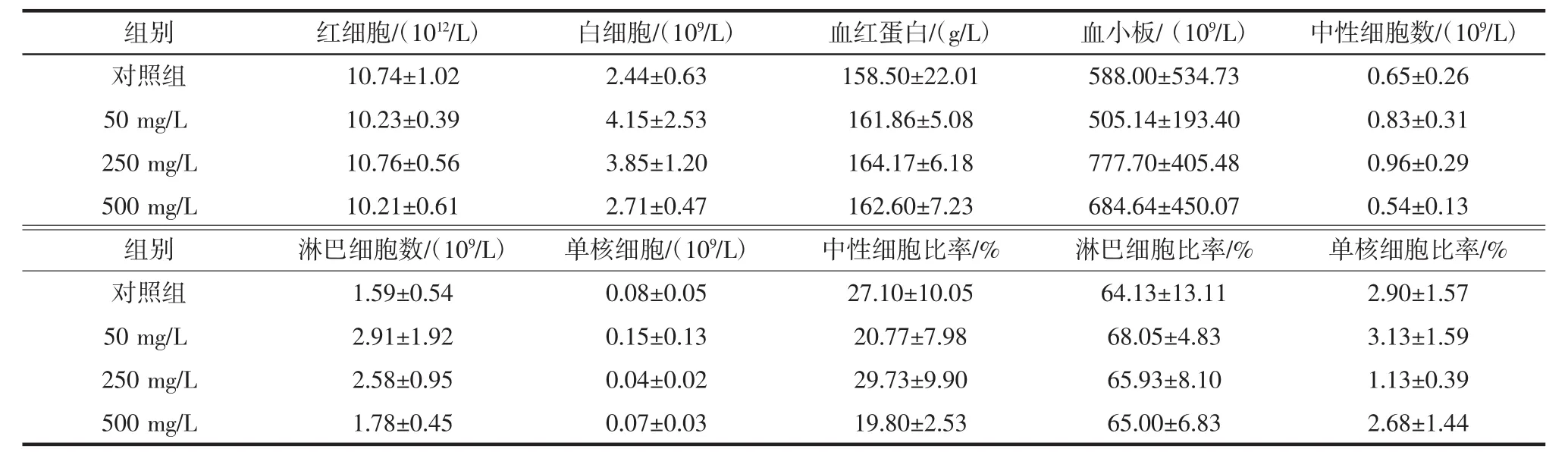
表5 小鼠血常规实验结果(±s,n=3)Table 5 Effect of T-2 on blood routine index in mice(±s,n=3)
注:P>0.05,与对照组比较,各处理组小鼠血常规指标无显著性差异。
组别红细胞/(1012/L)白细胞/(109/L)血红蛋白/(g/L)血小板/(109/L)中性细胞数/(109/L)对照组 10.74±1.02 2.44±0.63 158.50±22.01 588.00±534.73 0.65±0.26 50 mg/L 10.23±0.39 4.15±2.53 161.86±5.08 505.14±193.40 0.83±0.31 250 mg/L 10.76±0.56 3.85±1.20 164.17±6.18 777.70±405.48 0.96±0.29 500 mg/L 10.21±0.61 2.71±0.47 162.60±7.23 684.64±450.07 0.54±0.13组别淋巴细胞数/(109/L)单核细胞/(109/L)中性细胞比率/%淋巴细胞比率/%单核细胞比率/%对照组 1.59±0.54 0.08±0.05 27.10±10.05 64.13±13.11 2.90±1.57 50 mg/L 2.91±1.92 0.15±0.13 20.77±7.98 68.05±4.83 3.13±1.59 250 mg/L 2.58±0.95 0.04±0.02 29.73±9.90 65.93±8.10 1.13±0.39 500 mg/L 1.78±0.45 0.07±0.03 19.80±2.53 65.00±6.83 2.68±1.44
表6 小鼠血生化实验结果(±s,n=3)Table 6 Effect of T-2 on blood biochemistry indexes in mice(±s,n=3)
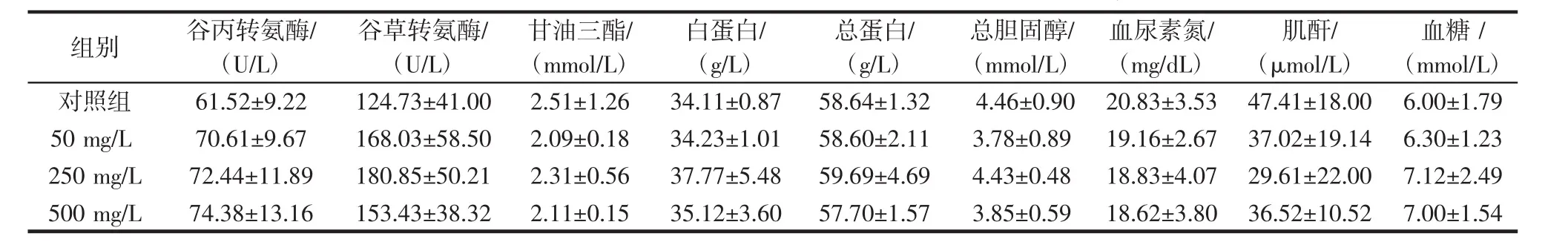
表6 小鼠血生化实验结果(±s,n=3)Table 6 Effect of T-2 on blood biochemistry indexes in mice(±s,n=3)
注:P>0.05,与对照组比较,各处理组小鼠血清生化指标无显著性差异。
白蛋白/(g/L)对照组 61.52±9.22 124.73±41.00 2.51±1.26 34.11±0.87 50 mg/L 70.61±9.67 168.03±58.50 2.09±0.18 34.23±1.01 250 mg/L 72.44±11.89 180.85±50.21 2.31±0.56 37.77±5.48 500 mg/L 74.38±13.16 153.43±38.32 2.11±0.15 35.12±3.60组别 谷丙转氨酶/(U/L)谷草转氨酶/(U/L)甘油三酯/(mmol/L)总蛋白/(g/L)58.64±1.32 58.60±2.11 59.69±4.69 57.70±1.57总胆固醇/(mmol/L)血糖/(mmol/L)4.46±0.90 20.83±3.53 47.41±18.00 6.00±1.79 3.78±0.89 19.16±2.67 37.02±19.14 6.30±1.23 4.43±0.48 18.83±4.07 29.61±22.00 7.12±2.49 3.85±0.59 18.62±3.80 36.52±10.52 7.00±1.54血尿素氮/(mg/dL)肌酐/(μmol/L)
菌株T-2对小鼠脏器病理组织学的影响见图1,实验期间各组大鼠各器官剖检均未见明显病理变化, 即对脏器组织没有损伤。
表7 脏器指数实验结果(±s,n=3)Table 7 Effect of T-2 on organ index in mice(±s,n=3)

表7 脏器指数实验结果(±s,n=3)Table 7 Effect of T-2 on organ index in mice(±s,n=3)
注:P>0.05,与对照组比较,各处理组小鼠脏器指数无显著性差异。
组别 只数 心/% 肝/% 脾/% 肺/% 肾/%对照组 8 0.57±0.07 3.83±0.53 0.28±0.04 0.61±0.14 1.03±0.25 50 mg/L 8 0.50±0.06 3.78±0.34 0.31±0.06 0.65±0.15 1.01±0.23 250 mg/L 8 0.56±0.10 3.77±0.46 0.30±0.06 0.64±0.09 1.07±0.24 500 mg/L 8 0.56±0.12 3.89±0.46 0.23±0.07 0.52±0.08 0.93±0.14
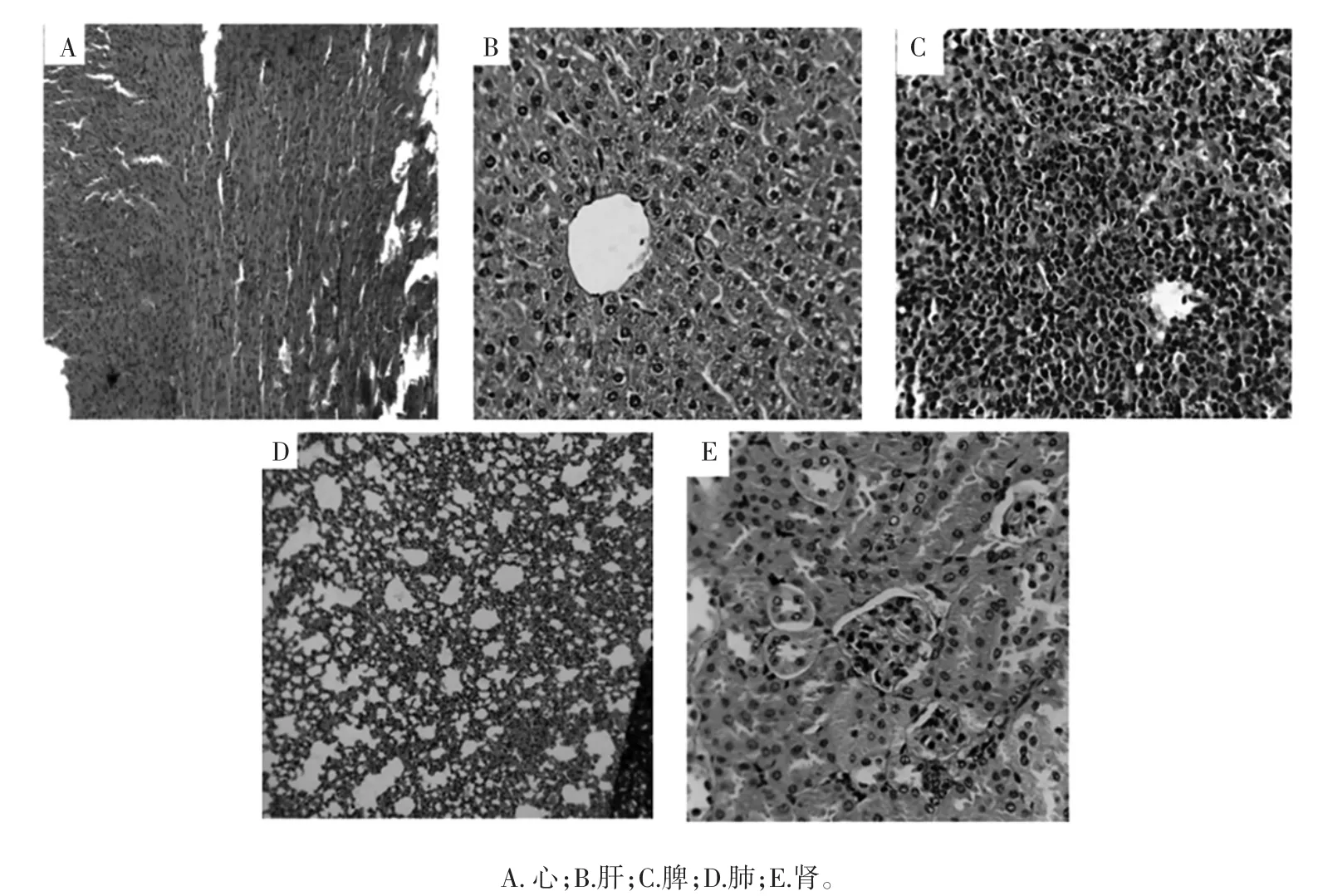
图1 菌株T-2对小鼠脏器病理组织学的影响(HE×400)Fig.1 Effect of T-2 on visceral organ changes in rats(HE×400)
3 结论
许多研究表明酵母菌是一种理想的生防制剂[17],因为它具有能够附生在植物上面,对植物和人类没有致病性且能迅速增殖、遗传稳定、有较强抗逆性等优点,更容易被人们所广泛接受[18]。而美极梅奇酵母菌T-2作为一株具有采后生防潜力的酵母菌株,将其制成生防制剂,保证菌体本身及其所产活性代谢产物对动物的安全性是最基本的要求之一[19]。本研究采用清洁级鼠,用美极梅奇酵母菌T-2对小鼠进行灌胃处理,参照GB 15193.1-2014[9]进行了致突变性评价,可进一步探明生防菌对动物体正常生理代谢的影响[20],为酵母菌作为采后保鲜生防制剂的食用安全性提供一定的科学依据。
实验结果表明,菌株T-2对大鼠的急性经口毒性属于“无毒”级(LD50>10 g/kg)[11]。酵母菌 T-2 在 Ames实验中未呈现致突变性。在小鼠精子畸形实验中,50 mg/L~500 mg/L实验剂量范围内,小鼠各剂量组与对照组相比无显著性差异(P>0.05);骨髓细胞微核实验是一种用于检测细胞内染色体损伤的化学毒物的实验方法[21],在31.25 mg/L~500 mg/L的实验剂量范围内,小鼠骨髓微核实验结果为阴性。血液学指标反映机体内环境及造血功能的变化,血清生化指标检验机体生理成分、代谢情况及重要器官的功能状态,其中肾功能及肝功能的变化是考察药物是否存在蓄积毒性。本实验结果显示酵母菌T-2在50、250、500 mg/L各剂量组血液学与血清生化结果均在正常参考值范围内,与对照组相比无显著性差异(P>0.05)。病理组织学检查也未见明显肝脏功能性损伤,脏器指数也无显著性差异,说明酵母菌T-2不会对小鼠脏器造成损害。
综上所述,可以推断出在严格控制使用剂量和使用方法的情况下,美极梅奇酵母T-2对人体不会产生不良遗传毒性影响。因此在商业化贮藏保鲜果品中使用该生防菌剂防治病害是比较安全的,具有进一步研究开发的价值。
