灰树花多糖复合酶协同微波辅助提取工艺及抗氧化性研究
2020-12-01申红林王凤玲
申红林,王凤玲
(天津商业大学生物技术与食品科学学院,天津300134)
灰树花(Grifola frondosa)是一种中温型、好氧、喜光真菌,富含多种对人体有重要保健作用的活性成分,而且多种营养素含量位于各类食用菌之首[1-2]。现代研究表明,灰树花多糖在抗病毒、免疫调节以及抵抗肿瘤等方面有显著的生物学活性[3-4],同时也起到调节血糖、血脂、血压、治疗肝炎、抗辐射、抗氧化等众多作用[5-6],因此对于灰树花多糖的各项研究具有重要意义。
对于多糖的提取,普遍的提取方法是醇沉水提法,辅助方法有超声[7]、微波[8]等。中国预防医学科学院营养与食品卫生研究所和农业部质检中心权威检测可知,灰树花干品中碳水化合物含量为21.4%。2018年季宏更等[9]比较灰树花发酵液中提取多糖的水提法、辅助提取法(超声辅助、微波辅助)和酶法提取,结果表明,水提法提取率为4.46%,辅助提取法中的微波辅助效果较好。有研究表明,在植物多糖提取过程中,添加纤维素酶、蛋白质酶可以促进多糖的溶出,从而提高提取率[10-11],但是存在单一酶使用量大、成本高等问题,从而复合酶的添加成为一种新的辅助提取方式。
本试验以灰树花干物质为原料,响应面优化复合酶(纤维素酶和木瓜蛋白酶)联合微波辅助提取灰树花多糖工艺,选用sevage法去蛋白、001×7阴离子交换树脂脱色和DEAE-52纤维素层析柱分离组分,并对初步分离纯化出的两种多糖GFP1、GFP2进行抗氧化性研究。
1 材料与方法
1.1 材料与仪器
灰树花干物质:河北省唐山市迁西县;葡萄糖:北京盛世康普化工技术研究院;抗超氧阴离子自由基及产生超氧阴离子自由基测试盒、抗羟基自由基及产生羟基自由基测试盒、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH):南京建成生物工程研究所;木瓜蛋白酶(400 U/mg):北京鼎国昌盛生物技术有限公司;纤维素酶(3 U/mg):国药化学试剂有限公司;DEAE-52纤维素:Phygene公司;无水乙醇(分析纯):天津市光复精细化工研究所;氢氧化钠(分析纯):天津海川化工有限公司;001×7大孔树脂:河北源得尔节能科技有限公司。
微波催化合成/萃取仪(XH-100A):祥鹄科技有限公司;电热恒温水浴锅(DK-8D):上海森信实验仪器有限公司;紫外分光光度仪(TU-1901):北京普析通用仪器有限责任公司。
1.2 试验方法
1.2.1 灰树花多糖提取工艺
灰树花干物质→粉碎过80目筛→加入60℃纯水→加入复合酶(木瓜蛋白酶、纤维素酶)→微波辅助提取(60℃[12])→灭酶(煮沸10 min)→冷却离心取上清液→醇沉离心(5 000 r/min,10 min)→75%乙醇洗涤沉淀→复溶于水
1.2.2 灰树花多糖纯化工艺
1.2.1 得到的醇沉冻干得粗多糖→糖链的释放(β-消除法[13])→sevage法[14]去蛋白→001×7大孔树脂脱色(将5 mg/mL的灰树花多糖溶液以1 mL/min流速上样,以蒸馏水洗脱,苯酚硫酸法跟踪收集,直至流出液无多糖为止)→过DEAE-52纤维素柱,分别用0、0.05、0.1、0.3、0.5 mol/L NaCl溶液 1 mL/min 进行梯度洗脱,绘制洗脱曲线→选择并合并洗脱效果佳的梯度醇沉,冻干得 GFP1、GFP2。
1.2.3 单因素试验
以多糖提取量为指标,在其他提取条件相同的情况下,考察不同微波功率、微波时间、料水比、酶配比(纤维素酶质量∶木瓜蛋白酶质量)、酶料比(复合酶质量∶灰树花干物质质量)5个因素[15-18]对灰树花多糖提取量的影响。
1.2.4 响应面优化
根据差异显著大小选取微波时间(3、6、9 min)、料水比[1 ∶20、1 ∶30、1 ∶40(g/mL)]、酶配比(2 ∶1、1 ∶1、1 ∶2)及酶料比(0.015、0.02、0.025 g/g)4 个因素,Box-Behnken法设计四因素三水平的试验,得出灰树花多糖提取的最优工艺。
1.2.5 多糖提取量的测定
标准曲线的制作:以干燥至恒重的葡萄糖标准品配制浓度为 0.01、0.02、0.03、0.04、0.05、0.06 mg/mL 一系列标准溶液,采用苯酚硫酸法于489 nm波长处测定吸光度,绘制标准曲线为:y=83.676x+0.026 3,线性相关系数R2=0.999 0。灰树花多糖提取量的计算:灰树花多糖提取量/(mg/g)=(ρ×V×n)/m。
式中:ρ为样品中多糖的质量浓度,mg/mL;V为溶剂体积,mL;m为灰树花干物质质量,g;n为溶液稀释倍数。
1.2.6 灰树花多糖抗氧化性测定
将灰树花多糖 GFP1、GFP2 配制成 1.0、2.0、3.0、4.0、5.0 mg/mL的水溶液,还原力测定方法按照文献[19]测定。将灰树花多糖GFP1、GFP2配制成 0.2、0.4、0.6、0.8、1.2 mg/mL的水溶液,DPPH自由基清除率测定方法按照文献[20]测定。将灰树花多糖GFP1、GFP2配制成 1.0、2.0、3.0、4.0、5.0 mg/mL 的水溶液,超氧阴离子自由基清除能力测定方法参考试剂盒说明书。将灰树花多糖GFP1、GFP2配制成质量浓度为2.0、4.0、6.0、8.0、10.0 mg/mL的水溶液,羟基自由基清除能力测定方法参考试剂盒说明书。
1.3 数据处理
试验数据采用origin 2018进行整理和绘图;利用Design-Expert 8.0.6软件中的Box-Behnken法进行回归模型方程的建立及方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 料水比对多糖提取量的影响
料水比对多糖提取量的影响见图1。

图1 料水比对多糖提取量的影响Fig.1 Effect of solid-water ratio on polysaccharide extraction
由图1中可以看出,在料水比1∶10(g/mL)~1∶50(g/mL)的范围内,灰树花多糖提取量呈现先增大后缓慢减少的趋势。这种现象可能是因为水体积过小时,多糖在水中溶解不完全而且黏度过大造成的;水体积超过30倍时,多糖在大量溶剂中的传递效果和传热效果受到影响,从而使提取量变低。因此料水比1∶30(g/mL)为宜。
2.1.2 微波功率对多糖提取量的影响
微波功率对多糖提取量的影响见图2。

图2 微波功率对多糖提取量的影响Fig.2 Effect of microwave power on polysaccharide extraction
由图2中可以看出,微波功率对多糖提取量的影响不显著,在微波功率为300 W时,多糖提取量达到59.12 mg/g。因此选择300 W作为响应面优化恒定条件。
2.1.3 微波时间对多糖提取量的影响
微波时间对多糖提取量的影响见图3。

图3 微波时间对多糖提取量的影响Fig.3 Effect of microwave time on polysaccharide extraction
由图3中可以看出,当微波时间过低时,多糖溶解不充分;当微波时间大于6 min,大多数多糖物质溶出,微波或复合酶对溶液中多糖开始降解,并对降解形成的还原糖进行进一步降解,导致脱水形成的糖醛衍生物含量降低,从而测定的多糖提取量降低。因此选择微波时间6 min为宜。
2.1.4 酶料比对多糖提取量的影响
酶料比对多糖提取量的影响见图4。
由图4中可以看出,在酶料比在0.01 g/g~0.02 g/g的范围内,通过纤维素酶降解植物细胞壁纤维素骨架、木瓜蛋白酶降解细胞膜上脂蛋白的方式,提高多糖提取量。但当酶料比大于0.02 g/g时,过量的酶不但无贡献还会产生竞争性抑制反应,导致多糖提取量降低。因此选择酶料比0.02 g/g为宜。
2.1.5 酶配比对多糖提取量的影响
酶配比对多糖提取量的影响见图5。
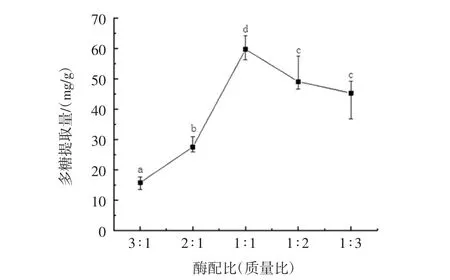
图5 酶配比对多糖提取量的影响Fig.5 Effect of complex enzymes ratio on polysaccharide extraction
由图5可知,复合酶的配比对多糖提取量的影响先升高后缓慢降低。不同的酶对多糖的提取效果不一样,酶相互作用也会影响多糖提取量。纤维素酶与木瓜蛋白酶质量比为1∶1时,酶相互作用最佳。因此选择酶配比(纤维素酶质量∶木瓜蛋白酶质量)1∶1为宜。
2.2 响应面优化提取工艺结果分析
2.2.1 试验设计和结果
根据单因素试验结果,选择微波功率300 W作为响应面优化恒定条件,对微波时间、料水比、酶配比、酶料比4个因素进一步优化。试验方案与结果见表1。
2.2.2 拟合模型方程的建立与方差分析
以表1的试验结果对其进行方差分析,结果见表2。
从表2可知,四因素拟合得到的二次多项式回归方程:Y=74.44+5.21A-0.67B+2.04C-0.64D-1.96AB-7.94AC+1.42AD-5.39BC-1.78BD-5.70CD-7.06A2-2.92B2-7.47C2-15.93D2。

表1 Box-Behnken试验方案与结果Table 1 Results of response surface experiments

表2 方差分析表Table 2 Variance analysis of regression model
该方程模型表现极显著(p<0.000 1),且失拟项不显著(p>0.05),说明所得到的方程拟合较好,回归显著,可用此回归模型推测灰树花多糖提取量并确定最优工艺。根据回归方程中各项系数的绝对值得到影响灰树花多糖提取量的因素依次为:微波时间(A)>酶料比(C)>料水比(B)>酶配比(D)。
2.2.3 响应面图分析
4个因素交互作用的响应面图如图6所示。

图6 不同提取条件对灰树花多糖提取量影响的响应面图Fig.6 Response surface diagram of the effects of different extraction conditions on the extraction of polysaccharide from grifola frondosa
由图6可看出,酶配比和时间、酶料比和时间、酶料比和酶配比的交互作用对多糖提取量的影响显著,表现为响应面坡度较大。酶料比和料水比的交互作用对多糖提取量的影响次之。料水比和时间、酶配比和料水比的交互作用对多糖提取量的影响不显著,表现为响应面图坡度趋于平缓。
经响应面优化得到灰树花多糖最佳提取工艺为微波时间 7.19 min、料水比 1 ∶27.31(g/mL)、酶配比 1 ∶1(质量比)、酶料比0.02 g/g。为试验操作方便,将灰树花多糖提取最优条件修正为微波时间7 min、料水比 1∶27(g/mL)、酶配比 1 ∶1(质量比)、酶料比0.02 g/g,此条件下,3次提取平均提取量为73.25 mg/g,与理论值的相对误差为3.17%。由此可知,响应面优化复合酶协同微波辅助提取灰树花多糖是合理可行的。本方法提取量相较顾华杰等[19]研究的水提法、超声辅助法、微波辅助法提取率分别高64%、50%、48%。
2.3 DEAE-52纤维素层析柱洗脱曲线
DEAE-52纤维素层析柱洗脱曲线见图7。

图7 多糖DEAE-52纤维素层析柱洗脱曲线Fig.7 Elution curve of polysaccharide DEAE-52 cellulose column
由图7可筛选出采用去离子水和0.5 mol/L NaCl溶液洗脱得到的灰树花多糖GFP1和GFP2,其分离效果好,两组分分离较开,且分离图形较对称,说明DEAE-52纤维素层析柱分离这两组分得到较满意的效果。
2.4 灰树花多糖抗氧化性测定
GFP1和GFP2的还原力和清除DPPH自由基、羟基自由基、超氧阴离子自由基的能力见图8~图11。

图8 GFP1和GFP2的还原力Fig.8 Reducing power of GFP1 and GFP2

图9 GFP1和GFP2对DPPH自由基的清除能力Fig.9 Scavenging ability of GFP1 and GFP2 to DPPH free radicals

图10 GFP1和GFP2对羟基自由基的清除能力Fig.10 Scavenging ability of GFP1 and GFP2 for hydroxyl radicals

图11 GFP1和GFP2对超氧阴离子自由基的清除能力Fig.11 Scavenging ability of GFP1 and GFP2 for superoxide anion
由图8~图11可知,多糖浓度为6 mg/mL时,GFP1和GFP2在700 nm处的OD值达到0.43和0.48,优于同质量浓度下的茯苓多糖OD值(0.283)[21],并且GFP2的还原力优于GFP1。浓度为2mg/mL时,GFP2的DPPH自由基清除率达到50%,优于GFP1。浓度为6 mg/mL时,GFP1和GFP2的羟基自由基清除率超过65%,而且提取物浓度大于5 mg/mL时,GFP2的羟基自由基清除率大于GFP1。浓度为5 mg/mL时,GFP1和GFP2的超氧阴离子自由基清除率都达到了80%。综上所述,GFP1和GFP2在体外表现出良好的抗氧化性,且GFP2的抗氧化效果更好,在浓度大于5 mg/mL下各指标抗氧化效果与VC相差不大。
3 结论
本研究采用复合酶结合微波辅助提取灰树花多糖,响应面优化得到最佳提取工艺为,微波时间7 min、料水比 1∶27(g/mL)、酶配比 1 ∶1(质量比)、酶料比0.02(g/g),此条件下,提取得到的灰树花多糖实际提取量为73.25mg/g,与理论值偏差较小。该方法高效、简单、提取率高,可用作灰树花多糖的提取工艺。提取得到的粗多糖经sevage法去蛋白、001×7树脂脱色和DEAE-52纤维素层析柱分离得到GFP1和GFP2,其抗氧化试验结果表明,GFP1和GFP2还原力较强,对DPPH自由基、羟基自由基、超氧阴离子自由基的清除效果良好。GFP2抗氧化性优于GFP1,且在一定浓度下,GFP2抗氧化效果与VC相当。因此灰树花多糖经一系列纯化技术后,可以成为一种天然健康的抗氧化剂。
