大孔吸附树脂纯化艾草总黄酮及其抗氧化活性研究
2020-12-01杨宇华黄艳郑宝东
杨宇华,黄艳,郑宝东
(1.武夷学院茶与食品学院,福建武夷山354300;2.福建农林大学食品科学学院,福建福州350002)
艾草(Artemisia argyi),又称遏草、医草、灸草等,是一种药食兼用的草本植物,具有独特的天然生物活性,艾草黄酮即为其天然生物活性成分之一[1-3]。为使艾草黄酮成分能够得到全面开发,本研究在艾草黄酮粗提取的基础上进一步分离纯化,黄酮类化合物分离纯化的方法已比较成熟,如溶剂萃取法、膜分离法、超临界流体萃取法、薄层色谱分离、高效液相色谱分离等,但以上方法各存在不足之处,如纯化成本高、产品纯度低、设备要求较高、生产周期长、难以实现产业化等。
大孔吸附树脂技术因其成本低、选择性好、产品纯度高、树脂可再生、工艺简单利于实现大规模生产等优点[4-6],近年来被广泛用于中草药活性成分的分离纯化研究。本文开展大孔吸附树脂对艾草总黄酮的吸附纯化研究,比较6种大孔树脂的吸附及解吸性能,筛选出最佳大孔树脂,并利用最佳大孔树脂对艾草总黄酮进行静态及动态吸附纯化研究,确定最佳纯化工艺,以期为艾草总黄酮的高效利用及性质组分鉴定提供相关理论依据。
动物机体代谢过程会产生超氧阴离子自由基(O2-·)、羟基自由基(·OH)、过氧化氢(H2O2)等伤害机体的自由基[7-9],从而引起蛋白质病变、DNA链断裂、酶失活等,因此,清除体内过多的自由基,对于维持机体健康尤为重要。本文以VC为阳性对照,从总还原力、对羟基自由基(·OH)和二苯代苦味酰基自由基(DPPH·)、超氧阴离子自由基(O2-·)、清除效果等方面开展艾草总黄酮粗提物及纯化物的体外抗氧化活性研究,以期为艾草黄酮类化合物作为天然抗氧剂的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
芦丁标准品:成都西亚试剂有限公司;DPPH:Sigma公司;过硫酸钾、水杨酸、氯化铁、硫酸亚铁、铁氰化钾、三氯乙酸、三羟甲基氨基甲烷(分析纯):国药集团化学试剂有限公司。HP-20型树脂:非极性,比表面积(m2/g)500~550;ADS 17 型树脂:中极性,比表面积(m2/g)90~150;DM-301型树脂:弱极性,比表面积(m2/g)≥330;HPD500 型树脂:弱极性,比表面积(m2/g)500~550;AB-8 型树脂:弱极性,比表面积(m2/g)≥400;D101 型树脂:非极性,比表面积(m2/g)≥550。
1.2 仪器与设备
TGL-16G型高速离心机:上海安亭科学仪器厂;UV-3200PC型紫外可见分光光度计:上海美谱达仪器有限公司;WSC-S型测色色差计:上海精密科学仪器有限公司;QYC-200型全温培养摇床:上海新苗医疗器械制造有限公司;SHZ-DⅢ型循环水式真空泵:巩义市予华仪器有限公司;RE 2000A型旋转蒸发仪:上海亚荣生化仪器厂;HL-2型恒流泵:上海沪西分析仪器厂有限公司;BSZ-100-LCD型自动部分收集器:上海琪特分析仪器有限公司。
1.3 试验方法
1.3.1 样液制备
参照前期试验艾草总黄酮的最佳提取工艺[10]:乙醇浓度 43%、提取温度 80℃、料液比 1∶69(g/mL)、超声功率350 W,提取时间40 min,在此条件下得到艾草总黄酮提取率最高为18.62%,纯度为36.1%,收集备用。
1.3.2 大孔吸附树脂预处理
将 6 种 树 脂 (D101、HP-20、ADS 17、DM301、HPD500、AB-8)用95%乙醇溶液浸泡24 h,浸泡至充分溶胀,于100目筛中用蒸馏水充分洗涤,无乙醇味且流出的洗涤液澄清不浑浊,后置于盐酸溶液(5%)中浸泡5 h用蒸馏水过100目筛充分洗涤,直至pH试纸显示流出的洗涤液呈中性,再于5%氢氧化钠溶液浸泡5 h,用蒸馏水充分洗涤,直至流出的洗涤液使pH试纸显示中性,最后将处理好的树脂置于蒸馏水中备用。
1.3.3 大孔吸附树脂筛选
分别称取上述预处理后的6种大孔树脂各2.0 g,置于50mL的锥形瓶中,加入20mL艾草总黄酮粗提液,置于30℃恒温振荡箱中,于150 r/min转速下充分振荡24 h,真空抽滤,测定滤液中艾草总黄酮的浓度。用蒸馏水冲洗,直至大孔吸附树脂表面的艾草总黄酮洗净为止,抽滤得到吸附饱和的树脂,再加入80%乙醇溶液20 mL作为解吸液,在温度30℃、转速150 r/min的恒温振荡箱中充分振荡24 h,真空抽滤,测定滤液的总黄酮浓度。大孔吸附树脂吸附量、吸附率和解吸率的计算公式如下:
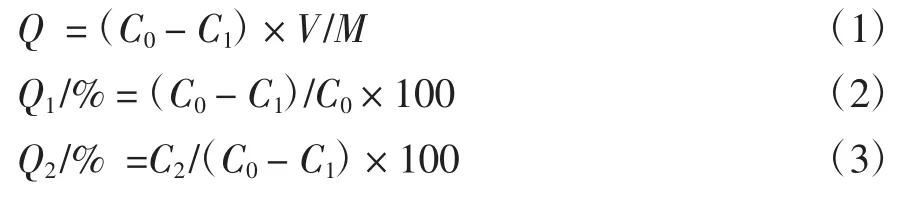
式中:Q 为大孔树脂吸附量,mg/mL;Q1、Q2分别为大孔吸附树脂吸附率和解吸率,%;C0为吸附前艾草总黄酮溶液浓度,mg/mL;C1为吸附后艾草总黄酮溶液浓度,mg/mL;C2为艾草总黄酮溶液解吸液中浓度,mg/mL;V为样品溶液的体积,mL;M为树脂湿重,g。
1.3.4 大孔吸附树脂静态吸附和解吸试验
1.3.4.1 大孔吸附树脂静态动力学曲线绘制
精确称取AB-8大孔吸附树脂1.000 0 g于50 mL锥形瓶中,加入30 mL艾草总黄酮溶液,将其置于转速为150 r/min、温度为30℃的恒温振荡器中振荡充分。每间隔30 min快速从中吸取1 mL溶液,测定总黄酮溶液的浓度,绘制静态吸附动力学曲线。
1.3.4.2 pH值对AB-8大孔吸附树脂吸附率的影响
精确称取AB-8大孔树脂1.000 0 g于50 mL锥形瓶中,加入艾草总黄酮溶液20 mL,pH值分别为2~8,于恒温振荡箱中温度30℃,转速150 r/min、充分振荡150 min,真空抽滤,测定总黄酮溶液的浓度,计算AB-8大孔吸附树脂在不同pH值下的吸附率。
1.3.4.3 温度对AB-8大孔树脂吸附率的影响
精确称取AB-8大孔树脂1.000 0 g于50 mL锥形瓶中,加入pH值为4的艾草总黄酮溶液20 mL,分别调节恒温振荡箱温度为20℃~60℃,于150 r/min转速下振荡吸附,每隔20 min吸取上清液测定总黄酮溶液浓度,绘制艾草总黄酮溶液吸附曲线。
1.3.4.4 乙醇浓度对AB-8大孔吸附树脂解吸率的影响
精确称取AB-8大孔吸附树脂1.000 0 g于50 mL锥形瓶中,于30℃、150 r/min下恒温振荡180 min后抽滤,在树脂中加入20 mL的乙醇溶液,浓度分别为50%~100%,再于上述恒温振荡箱中,充分振荡,解吸24 h,测滤液总黄酮溶液浓度,绘制AB-8大孔吸附树脂在不同乙醇浓度的解吸曲线。
1.3.5 AB-8大孔吸附树脂动态吸附和解吸试验
1.3.5.1 上样液浓度对AB-8大孔吸附树脂吸附率的影响
用预处理过的大孔吸附树脂装柱,将湿树脂沥干并采用湿法装柱,自然沉降。配置pH值为4的艾草总黄酮液1.0 mg/mL~3.0 mg/mL,上样量50 mL,控制上样流速为1 mL/min,计算吸附率,探讨上样液浓度对AB-8大孔吸附树脂吸附率的影响。
1.3.5.2 上样液速率对AB-8大孔吸附树脂吸附率的影响
装柱方法同1.3.5.1,配制pH值为4,浓度为2.5 mg/mL的艾草总黄酮溶液,上样量为50 mL,控制上样速度为0.5 mL/min~2.5 mL/min,计算吸附率,探讨上样液速率对树脂吸附率的影响。
1.3.5.3 洗脱剂用量对AB-8大孔吸附树脂解吸率的影响
装柱方法同1.3.5.1,配制pH值为4、浓度为2.5 mg/mL的艾草总黄酮溶液,上样量为50 mL,上样速率1.5 mL/min,待树脂吸附完全后,分别用40 mL~120 mL的80%乙醇溶液以1.5 mL/min的速率进行洗脱,测定滤液的总黄酮浓度,绘制不同洗脱剂用量对AB-8大孔吸附树脂的解吸效果。
1.4 纯度计算
将艾草总黄酮用AB-8大孔吸附树脂吸附纯化,对比纯化前后的纯度,计算其纯度。计算公式如下:

1.5 抗氧化能力的测定
1.5.1 艾草总黄酮总还原力的测定
参照温晋芳等[11]的方法进行测定。具体操作为:分别配置浓度为0.1 mg/mL~0.8 mg/mL的艾草总黄酮粗提液和纯化液、VC溶液,各取1 mL于离心管中,加入2.5 mL磷酸缓冲液(pH6.6,0.2 mol/L)和铁氰化钾溶液(1%),混匀置于水浴锅(50℃)中水浴20 min,急速冷却,加入三氯乙酸溶液(10%)2.5 mL,搅拌均匀,于离心机(3 000 r/min)中离心10 min,移取2.5 mL上清液,再加入蒸馏水2.5 mL和FeCl3(0.1%)0.5 mL,混匀后静置10 min,于波长700 nm处测定吸光度值。
1.5.2 艾草总黄酮清除DPPH·能力的测定
参考Wang等[12]的方法进行测定。具体操作为:将4 mg DPPH溶解于100 mL无水乙醇中,4℃下避光保存;将0.75 mL的0.1 mmol/L DPPH与1.5 mL不同浓度的总黄酮溶液混匀,暗处静置30 min,以无水乙醇为空白,于波长517 nm测定吸光度A1。空白对照为:0.75 mL无水乙醇与1.5 mL不同浓度的总黄酮溶液混匀,暗处静置30 min,以无水乙醇为空白,于波长517 nm测定吸光度A2;阴性对照为:将0.75 mL的0.1 mmol/L DPPH与1.5 mL无水乙醇混匀,暗处静置30 min,以无水乙醇为空白,于波长517 nm测定吸光度A0。根据公式(5)计算总黄酮溶液对DPPH自由基的清除率。

1.5.3 艾草总黄酮清除·OH能力的测定
采用Fenton法进行测定。具体操作为:将VC和纯化前后的艾草总黄酮配制成0.1 mg/mL~1.6 mg/mL的溶液,以蒸馏水为空白,分别量取4 mL待测溶液于比色管中,加入2 mol/L的FeSO4溶液3 mL和6 mmol/L水杨酸3 mL,再于比色管中加入2 mmol/L H2O23 mL,摇匀,于37℃下反应15 min后在510 nm处测定吸光度值,按照公式(6)计算·OH的清除率:
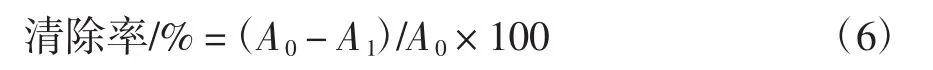
式中:A0为空白吸光度值;A1为待测液吸光度值。
1.5.4 艾草总黄酮清除超氧阴离子自由基(O2-·)能力的测定
采用邻苯三酚自氧化法[13]进行测定。具体操作为:将VC和纯化前后的艾草总黄酮配制成1 mg/mL的溶液,分别于比色管中加入待测液0.1 mL~0.8 mL,然后加入3.7 mL pH 8.2的Tris-HCl缓冲溶液,摇匀,于25℃水浴锅中水浴20 min,再加入3 mmol/L邻苯三酚0.3 mL,迅速摇匀倒入比色皿中,以10 mmol/L盐酸作空白对照,于320 nm处测定吸光度值,每30 s记录一次数值A320,共测10次,随时间变化作A320线性关系图,斜率为邻苯三酚自氧化速率,根据公式(7)计算O2-·的清除率:
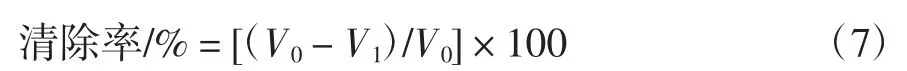
式中:V0为空白对照邻苯三酚自氧化速率;V1为待测液邻苯三酚自氧化速率。
2 结果与分析
2.1 静态吸附试验
2.1.1 不同大孔吸附树脂静态吸附和解吸效果比较
6种大孔树脂吸附及解吸试验结果见表1。

表1 6种大孔吸附树脂对艾草总黄酮静态吸附及解吸附性能比较Table 1 Determination of dynamic desorption rate of total flavonoids from Artemisia argyi by six kinds of adsorption resin
D101在6种大孔吸附树脂中的吸附率最高,HPD500、AB-8和 HP-20次之,DM301、和 ADS17的吸附率较低,但同时AB-8的解吸效果最好,作为合适的分离纯化树脂不仅吸附能力要强,且需要形成可逆吸附。同时,由于生产率与树脂的吸附动力学特征关系紧密,因此,选取吸附和解吸附兼好的AB-8大孔吸附树脂作为分离纯化艾草总黄酮的最佳树脂,后续试验均以AB-8大孔吸附树脂为研究对象,具体探究其静态及动态的吸附和解吸性能。
2.1.2 AB-8大孔吸附树脂静态试验结果分析
AB-8大孔吸附树脂静态吸附动力学曲线见图1。pH值对AB-8大孔吸附树脂的吸附效果的影响见图2。吸附温度对AB-8大孔吸附树脂吸附效果影响见图3。乙醇浓度对AB-8树脂解吸效果影响见图4。
由图1可得吸附时间30 min~180 min时,随着吸附时间的延长,艾草总黄酮溶液的吸附率逐渐升高;180min后,曲线逐渐趋于平缓,树脂吸附基本达到饱和状态。因此,吸附时间选择180 min为宜。
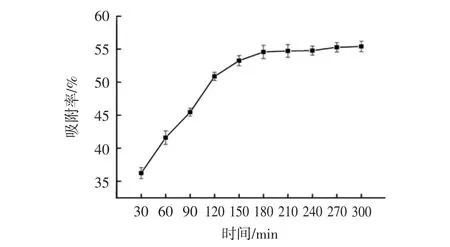
图1 AB-8大孔吸附树脂静态吸附动力学曲线Fig.1 AB-8 resin static adsorption kinetics curve

图2 pH值对AB-8大孔吸附树脂的吸附效果的影响Fig.2 Effect of pH value on adsorption rate and desorption rate of AB-8 resin
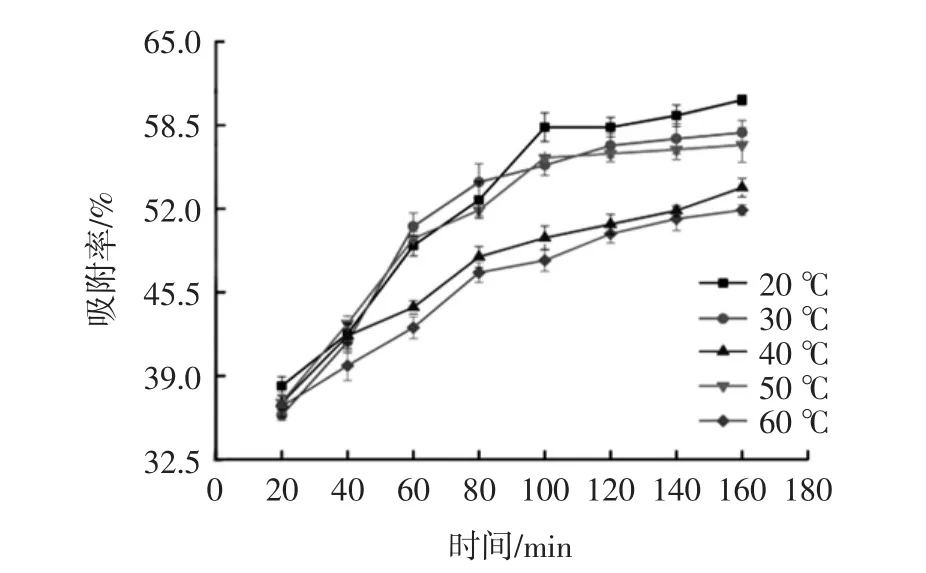
图3 吸附温度对AB-8大孔吸附树脂吸附效果影响Fig.3 Effect of adsorption temperature on adsorption of AB-8 resin

图4 乙醇浓度对AB-8树脂解吸效果影响Fig.4 Effect of ethanol concentration on desorption of AB-8 resin
由图2可得:溶液pH值为2~4时,艾草总黄酮的吸附率增大;当pH值为4时,总黄酮的吸附率达到87.50%;当pH值超过4时,吸附率随pH值的升高而逐渐下降。这是因为黄酮为多羟基酚类化合物,呈酸性,在酸性条件下以分子状态存在,通过范德华力与树脂吸附,因此易被吸附,而在碱性条件下,黄酮分子羟基去离子化,黄酮类化合物形成离子型结构,故不易被吸附[14]。因此,在上样液pH值为4时,AB-8大孔吸附树脂对艾草总黄酮吸附效果最好。
由图3可得:在不同温度下,随着吸附时间的增加,AB-8大孔吸附树脂对艾草总黄酮的吸附率均呈上升趋势;当时间小于40 min时,不同温度条件对应的总黄酮吸附率相差较小,当时间大于40 min后,20、30℃和50℃对应的总黄酮吸附率要高于40℃和60℃,且100 min后,20℃对应的艾草总黄酮吸附率要高于其它温度条件下的吸附率。因此,选取20℃为最佳吸附温度。
由图4可得:选取乙醇溶液作为洗脱剂,对树脂具有很好的解吸效果。当乙醇浓度为50%~80%时,树脂的解吸能力随着乙醇浓度的增加而逐渐提高;当乙醇浓度超过80%时,解吸率趋于平缓。这是由于黄酮类化合物与树脂间有强烈的氢键作用,吸附在树脂上的黄酮类化合物不容易被水和低浓度的乙醇洗脱下来[15]。因此,从解吸效果和节约乙醇两方面考虑,选择80%的乙醇最为适宜,对应解吸率达84.4%。
2.2 动态试验分析
上样液浓度对大孔吸附树脂吸附率的影响见图5。上样速度对大孔吸附树脂吸附率的影响见图6。洗脱剂流速对大孔吸附树脂解吸率的影响见图7。乙醇用量对大孔吸附树脂解吸率的影响见图8。
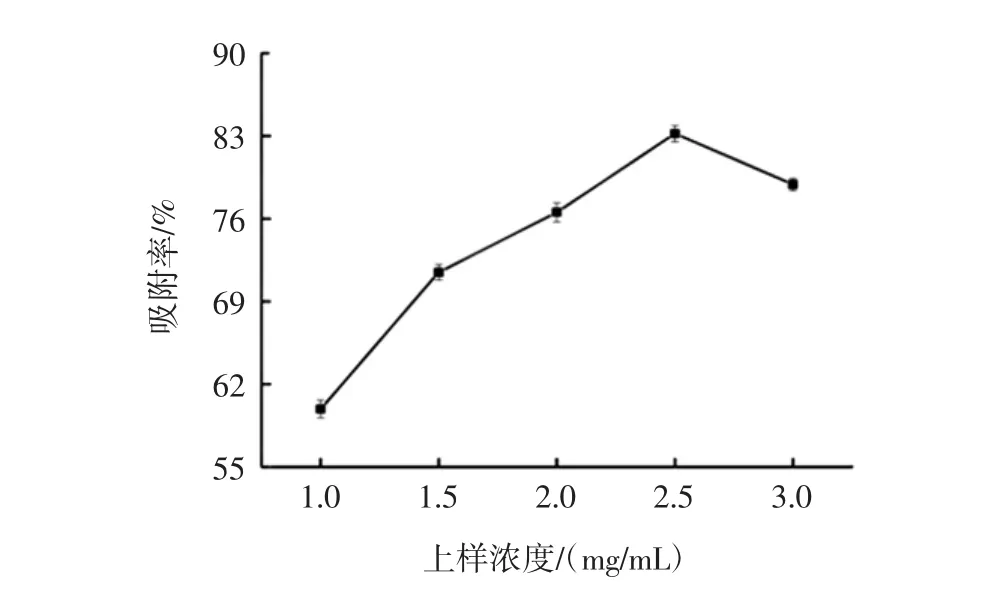
图5 AB-8上样浓度对AB-8大孔吸附树脂吸附效果的影响Fig.5 Effect of loading concentration on adsorption of AB-8 resin
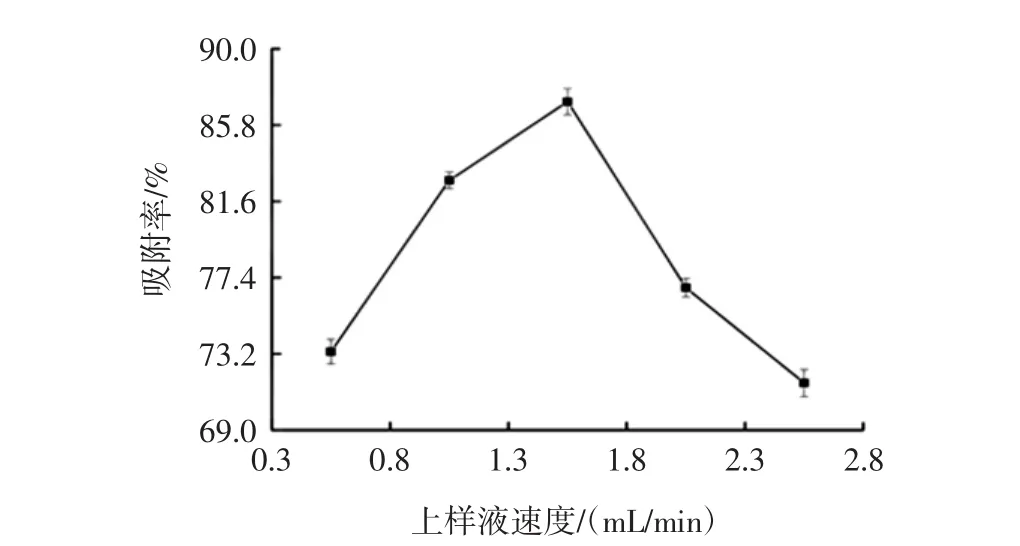
图6 上样液流速对AB-8大孔吸附树脂吸附效果的影晌Fig.6 Effect of the flow rate of the sample solution on the adsorption of AB-8 resin
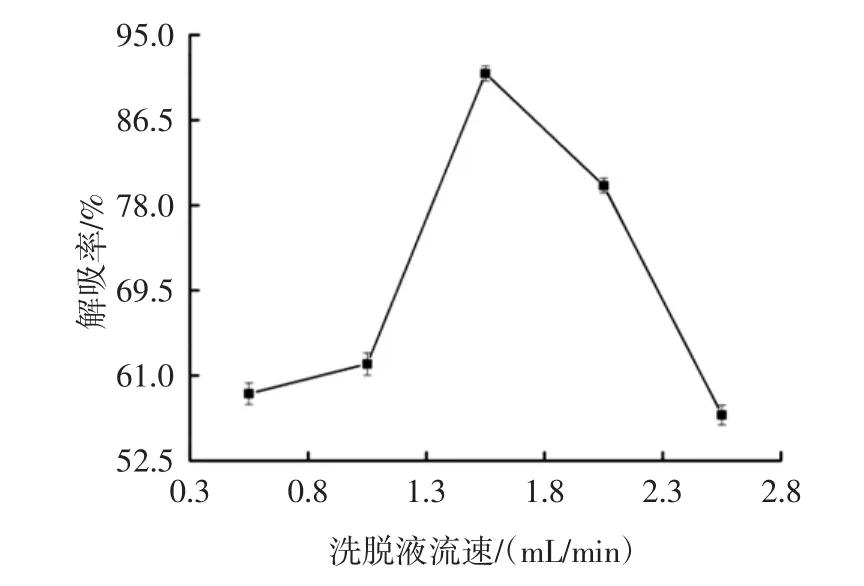
图7 洗脱液流速对解吸效果的影响Fig.7 Effect of eluent flow rate on desorption
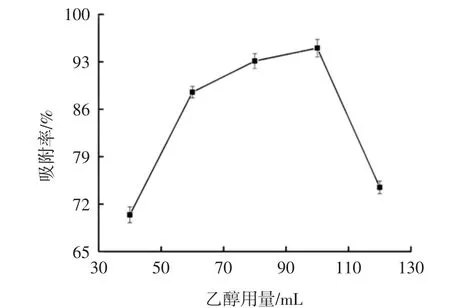
图8 乙醇用量对洗脱的影响Fig.8 Effect of different ethanol volumes on desorption
由图5可得:当上样液浓度为1.0 mg/mL~2.5 mg/mL时,树脂的吸附率随着上样液浓度增加而升高;当上样液浓度超过2.5 mg/mL时,吸附率反而降低。这是由于浓度低的黄酮溶液在通过柱床时,其流速过大,大于传质速度,传质未进行彻底吸附;而浓度高的上样液通过柱床的流速减慢,向内部传质速度变慢,使得有些黄酮成分没有被及时吸附就泄漏出来[16];此外,上样液浓度过大也可能造成大孔吸附树脂使用周期短,再生次数增多,影响树脂的使用寿命。当上样液浓度为2.5 mg/mL时,吸附率最高为83.2%,故选择上样液浓度2.5 mg/mL进行后续试验。
由图6可得:上样液流速在0.5 mL/min~1.5 mL/min时,随着流速的增大,总黄酮的吸附率增大;当流速为1.5 mL/min时,总黄酮吸附率最大,达到87.1%;当流速在1.5 mL/min~2.5 mL/min时,随着流速增大,总黄酮吸附率减小。这是因为流速过低时溶液与树脂的接触时间长,吸附率逐渐升高,可适当增大流速,但流速过高时溶液与树脂的接触时间太短,有效成分不能完全吸附在树脂上,从而导致黄酮的泄漏量增加,吸附率降低[17-18],因此选择上样流速1.5 mL/min进行后续试验。
由图7可得:当洗脱流速为1.5 mL/min时,解吸率最高为91.2%。在过高或过低的洗脱速率下,解吸率均较低。这是因为在较低流速下,不能完全洗脱树脂上的黄酮;当流速过快时,由于洗脱剂与黄酮接触时间太短,无法彻底从树脂上洗脱。因此,选择洗脱速率1.5 mL/min进行后续试验。
由图8可得:当乙醇用量为40 mL~100 mL时,随着乙醇用量的增加,解吸率逐渐增加;当乙醇用量为100 mL时,树脂的解吸率最高为95%;继续增大乙醇用量,解吸率反而降低。这是因为洗脱剂乙醇用量低时,树脂对黄酮的吸附作用使其难以完全解吸,造成洗脱不彻底,当洗脱用量过大时,树脂未能对黄酮完全吸附,并在淋洗过程中造成泄漏损失[19-20]。因此,选择乙醇用量100 mL进行后续试验。
2.3 艾草总黄酮纯化前后纯度比较
纯化前后艾草总黄酮的纯度比较结果见表2。

表2 纯化前后艾草总黄酮的纯度比较Table 2 Comparison of purity before and after purification
由表2可知,经过纯化艾草总黄酮的纯度由(36.1±0.50)%增加至(75.43±0.93)%,纯度提高了近 2倍,说明纯化效果良好。
2.4 抗氧化试验结果
艾草总黄酮粗提物、纯化物和VC的总还原力比较见图9。艾草总黄酮粗提物、纯化物和VC对DPPH·的清除能力见图10。艾草总黄酮粗提物、纯化物和VC对·OH清除能力见图11。艾草总黄酮粗提物、纯化物和VC对O2-·清除能力见图12。
由图9可得:物质的还原力可反映其抗氧化能力,当某物质的还原力很强时,其供应的电子可还原氧化性物质,还可与其自由基反应,形成稳定性较强的物质,因此,还原力越强代表物质抗氧化性越强[21]。总黄酮粗提物、纯化物和VC的总还原力均与质量浓度呈正相关,即浓度越大,还原力越强,表明总黄酮溶液具有一定的还原力;在同一浓度下,纯化物总还原力大于粗提物,但粗提物和纯化物的还原力均小于VC。
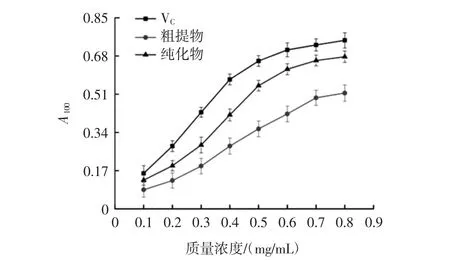
图9 艾草总黄酮粗提物、纯化物和VC总还原力比较Fig.9 Total reduction force of VC,purified substance and flavonoid crude extract

图10 艾草总黄酮粗提物、纯化物和VC对DPPH·清除能力的比较Fig.10 The ability to eliminate DPPH radical of flavonoids from VC,purified substance and flavonoid crude extract

图11 艾草总黄酮粗提物、纯化物和VC对·OH的清除率Fig.11 ·OH clearance rate of flavonoids crude extract,VCand purified substance

图12 艾草总黄酮粗提物、纯化物和VC对O2-·的清除率Fig.12 O2-·clearance rate of flavonoids crude extract,VCand purified substance
由图10可得:DPPH·是用于测定植物提取液抗氧化能力的一种快速、简便的方法,其溶解性好,性质稳定,在有机溶剂中是一种较稳定的自由基,抗氧化剂供质子的能力决定了DPPH自由基的清除能力[22]。随浓度的增大,艾草总黄酮粗提物和纯化物、VC对DPPH·的清除率均呈上升趋势,当浓度为0.1 mg/mL~0.4 mg/mL时,艾草总黄酮粗提物和纯化物对应的清除率增加明显,增幅分别为41.6 mg/mL和31.7 mg/mL;当浓度为1.6 mg/mL时,黄酮粗提物和纯化物对DPPH·的清除率达到最大值,分别为67.1%、80.8%。在相同浓度下,艾草总黄酮纯化物清除DPPH·的能力高于粗提物。综上,艾草总黄酮粗提物和纯化物对DPPH·均有一定的清除能力,纯化物的清除效果优于粗提物,但均弱于VC。
由图11可得:羟基自由基是氧自由基中的一种对细胞及大分子生物破坏作用较强的自由基,它会与体内如氨基酸、糖类、脂类等一系列物质发生反应,从而引起机体组织核酸断裂、脂质过氧化和蛋白质聚合等生化反应,导致机体细胞组织发生病变,引发各类疾病产生和加快机体衰老速度[23-24]。随着质量浓度的增加,黄酮粗提物、纯化物和VC对·OH的清除率不断增大,当浓度为0.1 mg/mL~1.6 mg/mL时,艾草总黄酮粗提物的清除率从18.01%提高至65.03%,纯化物的清除率从28.04%提高至86.01%。在质量浓度相同的条件下,对·OH清除率由高到低的排序为:VC>纯化物>粗提物。
由图12可得:艾草总黄酮粗提物、纯化物和VC对O2-·清除能力。超氧阴离子自由基是代谢过程中产生的第一氧自由基,自身具有强烈的毒害物质,其生成的衍生物(羟自由基和过氧化氢)具有一定的细胞毒性[25]。随着质量浓度的增加,黄酮粗提物、纯化物和VC对O2-·的清除率不断增大,浓度为0.6 mg/mL时三者对应的清除率均达最大值,粗提物和纯化物的清除率分别为49.92 mg/mL和58.03 mg/mL;当浓度>0.6 mg/mL时,三者清除率无明显变化。在质量浓度相同的条件下,对O2-·清除率由高到低的排序为:VC>纯化物>粗提物。
3 结论
通过比较6种大孔吸附树脂的静态吸附和解吸附效果,结果表明AB-8大孔吸附树脂的综合效果最佳,其最佳工艺条件为:上样液浓度为2.5 mg/mL,上样液pH值为4,吸附温度为20℃,上样速度为1.5 mL/min,选用80%乙醇进行洗脱,洗脱流速为1.5 mL/min,洗脱用量为100 mL。在此吸附和解吸条件下,艾草总黄酮的纯度由36.1%上升至75.43%,纯度提高了近2倍。该方法成本低、选择性好、产品纯度高、树脂可再生、工艺简单利于实现大规模生产等优点。体外抗氧化试验表明:艾草总黄酮具有良好的体外抗氧化能力。纯化物总还原力和DPPH·、·OH、O2-·清除能力均强于粗提物,但都弱于VC。
