发酵壳聚糖产酒精的微生物筛选及条件优化
2020-12-01王海东李庆立陈文武李清秀刘绍鹏
王海东,李庆立,陈文武,李清秀,贺 峰,刘绍鹏
(徐州生物工程职业技术学院 药品食品学院,江苏 徐州 221006)
几丁质是由N-乙酰-D-氨基葡萄糖以β(1-4)糖苷键连接成的高分子聚合物,广泛存在于自然界,据统计,几丁质全球年生物合成量超过10亿吨,是仅次于纤维素的第二大可再生资源,主要存在海洋中,还有来源于养殖的虾蟹和昆虫的壳,真菌细胞壁,藻类等[1]。几丁质的降解产物为壳聚糖、几丁寡糖和N-乙酰氨基葡萄糖等,可广泛应用于制药、食品和工业原料等领域[2]。对几丁质的研究主要集中在提高几丁质的降解效率[3],寻找更高效的几丁质降解酶[4]、几丁质脱乙酰酶[5],而以几丁质降解脱乙酰的产物壳聚糖为原料发酵生成酒精的研究,尚没有相关报道,笔者希望通过筛选获得直接发酵壳聚糖产生酒精的菌株,为几丁质的降解和综合利用做有益的探索。
1 材料与方法
1.1 材 料
1.1.1 样 品
采集徐州市云龙湖底淤泥作为样品,以其中的自然菌种为筛选对象。
1.1.2 试 剂
壳聚糖Chitosan,上海伊卡生物技术有限公司,水溶,脱乙酰度≥95%,分子量≤50 kD;
质量分数5%的重铬酸钾溶液,配制方法为称取5 g的重铬酸钾AR溶于50 mL水中,加10 mL浓硫酸,冷却,加水至100 mL,pH自然[6]。
1.1.3 培 养 基
基础培养基:壳聚糖10 g,蛋白胨10 g,115 ℃,琼脂15 g,水1 000 mL,灭菌30 min。
筛选培养基:壳聚糖10 g,琼脂15 g,2,3,5-氯化三苯基四氮唑(TTC)0.5 g,水1 000 mL,pH自然,115 ℃,灭菌30 min[7-8]。
发酵培养基:壳聚糖100 g,水1 000 mL,分装在100 mL发酵瓶中,每瓶50 mL,pH自然,115 ℃灭菌30 min。
1.1.4 仪 器
恒温摇床BDY-100B,上海予卓仪器有限公司;分光光度计T6,上海精科实业有限公司。
1.2 方 法
1.2.1 产酒精菌株的高通量筛选
称取淤泥样品1 g,加入10 mL无菌水,梯度稀释106倍涂布基础培养基平板,30 ℃,培养2 d。待长出菌落后,把筛选培养基融化,冷却至45 ℃左右,倒在平板上,覆盖在菌落上层,30 ℃,避光培养3 h[9]。因内含2,3,5-氯化三苯基四氮唑TTC作为显色剂,如果环境菌株具有降解壳聚糖的呼吸酶活力,会发生红色或粉红色显色反应,以完成菌种的高通量初筛。
划线分离有颜色反应的菌株,挑取单菌落接种到发酵培养基,30 ℃摇床培养,观察是否有大量气泡产生,用重铬酸钾溶液检测是否产生酒精进一步验证[10-11],完成对菌种的复筛。
1.2.2 菌株鉴定
菌株提取总DNA后交由苏州金唯智生物科技有限公司进行ITS序列鉴定和Blast比对,结合菌株的形态和发酵特性分析菌株的种属。
1.2.3 发酵条件优化
以体积分数1%固定接种量接种发酵培养基,开展单因素实验,确定发酵壳聚糖生成酒精的最适pH、温度、时间和转速等参数,设计L9(34)正交实验进行参数优化,以获得最优发酵条件。
1.2.4 乙醇质量浓度的测定
1) 乙醇标准曲线制作
取0.25 mL优级无水乙醇于100 mL容量瓶中,加水至刻度线,该溶液含乙醇质量浓度2 mg/mL。取6支刻度一致的10 mL比色管,编号为1~6,每支比色管中加入重铬酸钾溶液2 mL,分别加入乙醇标准溶液0,1,2,4,6,8 mL,加水至刻度线,配制不同质量浓度的乙醇溶液,100 ℃水浴10 min,流水冷却5 min,以1号管作对比,用1 cm比色皿,于波长600 nm处测定吸光度,以乙醇浓度与对应吸光度A的工作曲线[12-13]。
2) 发酵液中酒精质量浓度的测定
取发酵液0.5 mL于10 mL比色管中,加入2 mL重铬酸钾溶液,加水至刻度线,空白管以1号管作空白,于波长600 nm处测定吸光度,平行3次,取平均值,在标准曲线上查出乙醇的质量浓度[14]。
2 结果与分析
2.1 菌种筛选与鉴定
经多轮初筛和复筛,得到一株能够发生颜色反应的菌株,划线分离得到单菌落,菌株命名为K-6。对菌株的ITS序列,NCBI收录号为MT501695,进行Blast比对分析,结果显示与收录的S.cerevisiae酿酒酵母菌株MUCL28071的ITS序列有最高99.18%的相似度。菌株的菌落形态呈圆形,表面凸起,光滑湿润,粘稠,容易挑起,乳白色泛黄,颜色质地均匀,不透明,边缘整齐,特征如图1所示。
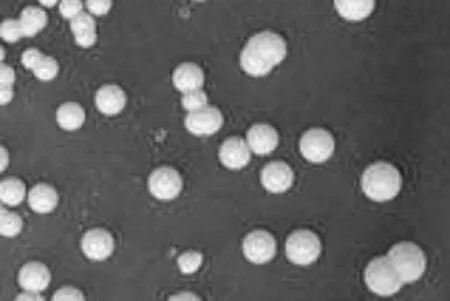
图1 菌株K-6的菌落特征Fig.1 The colony characteristics of strain K-6
经过显微镜检测,其形态为单个菌,卵圆形,可观察到出芽生殖,无菌丝,形态如图2所示。
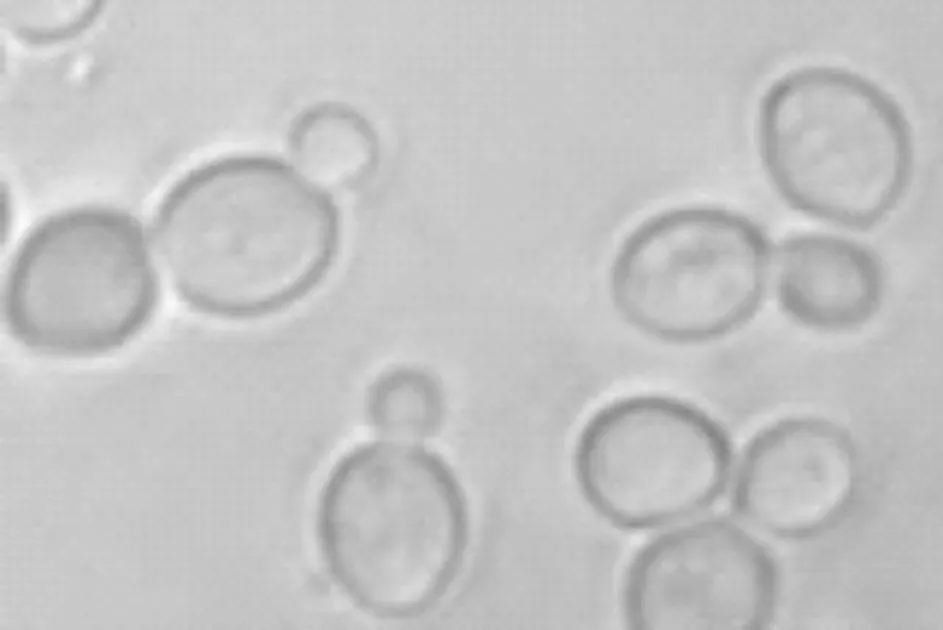
图2 菌株K-6的显微镜下形态Fig.2 The microscopic morphology of strain K-6
将筛选培养基融化冷却至42 ℃左右,用接种针取少量菌,接入培养基混匀倾倒平板,30 ℃培养观察,发现其能够稳定产生红色反应(图3),推测菌株K-6能够利用壳聚糖作为营养物质,有呼吸酶作用[15-16],能够还原TTC产生红色不溶物质三苯甲月替(TTF)。
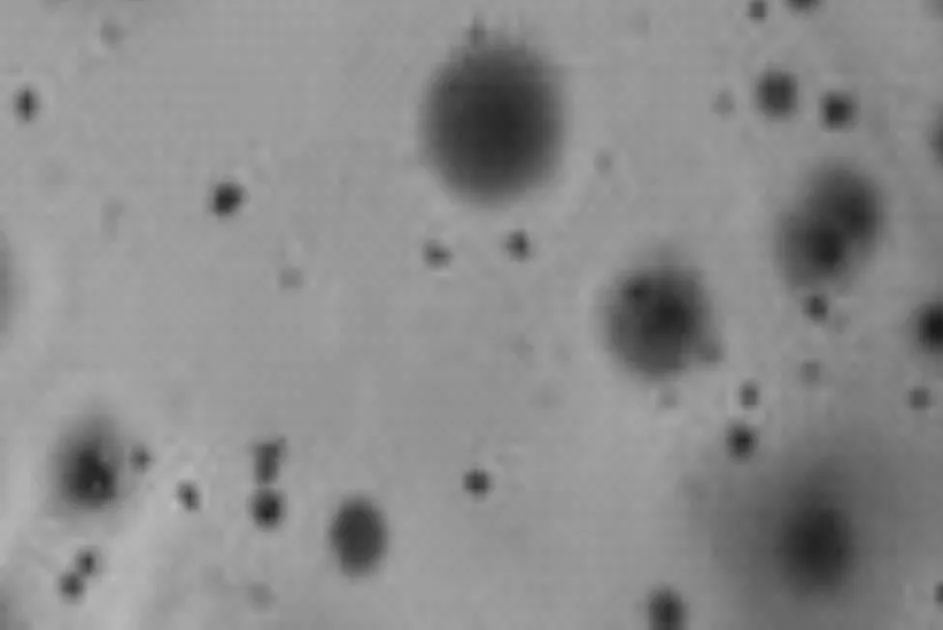
图3 菌株K-6的TTC筛选培养基颜色反应Fig.3 The color reaction of TTC screening medium of strain K-6
将菌株接种到发酵培养基,30 ℃,发酵瓶培养,观测到有大量气体产生,并有轻微酒精气味散出,初步确定发酵液中应该有酒精成分产生;同时检测发现发酵液与重铬酸钾溶液能够产生明显的绿色特征反应,相互验证确定发酵液体中有酒精组分生成,说明菌株K-6能够以可溶性壳聚糖为底物直接发酵产生酒精。通过ITS分子鉴定,结合菌落形态,生殖方式,显色反应,以及可发酵产生酒精的特性,可确定菌株K-6应属于酿酒酵母S.cerevisiae。
2.2 发酵条件优化
以体积分数1%的接种量接种发酵培养基,选定温度、pH、发酵时间和搅拌转速4个因素做单因素优化实验,采用比色法,结合标准曲线测定产生酒精的质量浓度。以温度为变量因素,自然pH、时间3 d和转速150 r/min为条件实验,结果如图4所示。
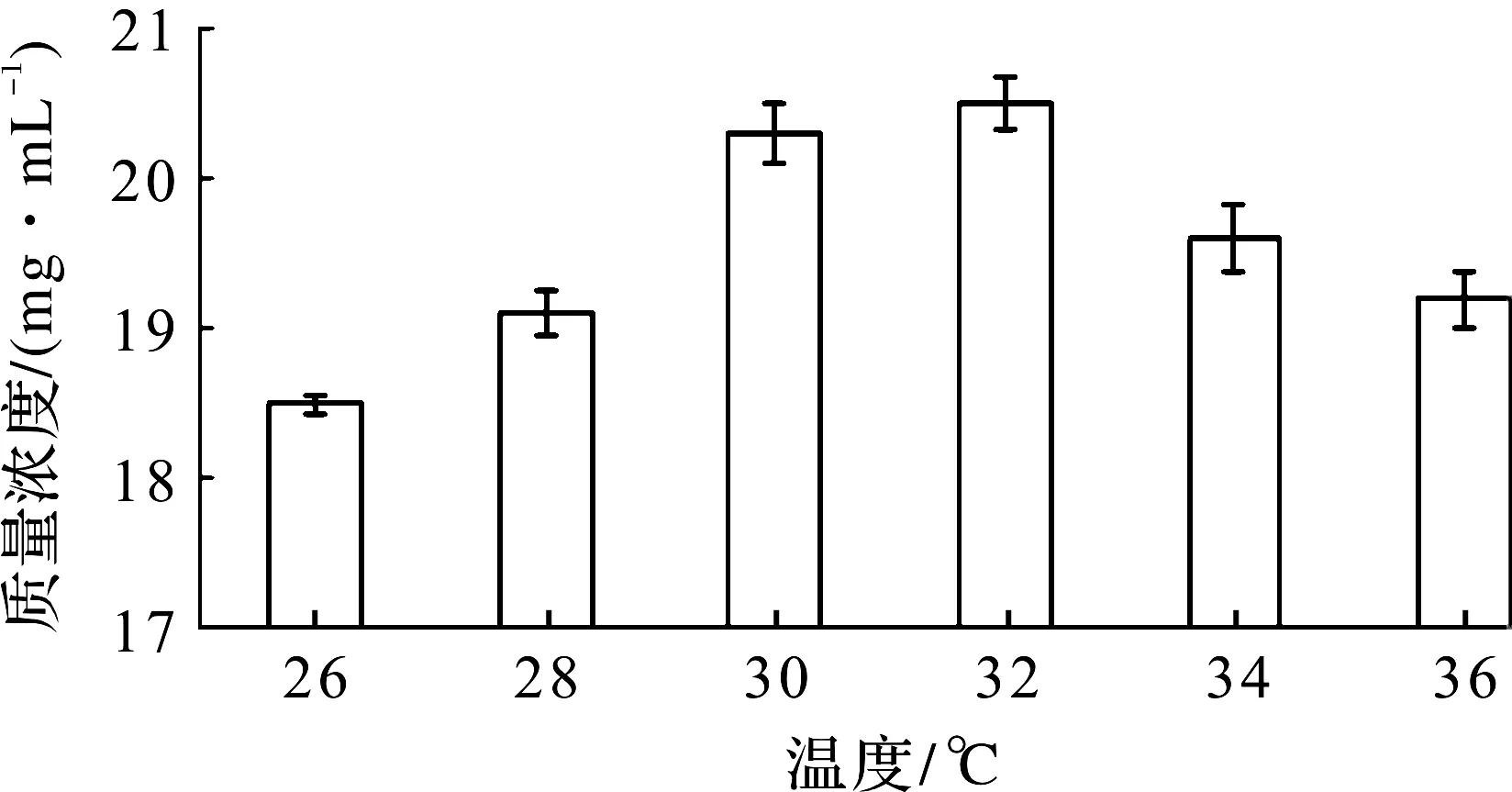
图4 最适发酵温度单因素实验Fig.4 Single factor experiment of optimum fermentation temperature
从图4中发现:温度为32 ℃时,酒精质量浓度最高为20.5 mg/mL,菌株K-6发酵酒精的最适温度为32 ℃。
选择pH为变量因素,温度30 ℃、时间3 d和转速150 r/min为条件做实验,结果如图5所示。当pH为6时,酒精质量浓度最高19.8 mg/mL,从而可确定菌株K-6发酵酒精的最适pH为6。
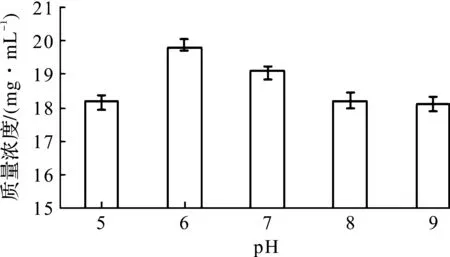
图5 最适发酵pH单因素实验Fig.5 Single factor experiment of optimum fermentation pH
选择发酵时间为变量因素,温度30 ℃、转速150 r/min和自然pH做单因素实验,结果如图6所示。在5 d时发酵基本结束,酒精质量浓度最高为23.6 mg/mL,从而可确定菌株K-6发酵酒精的最适发酵时间为5 d。
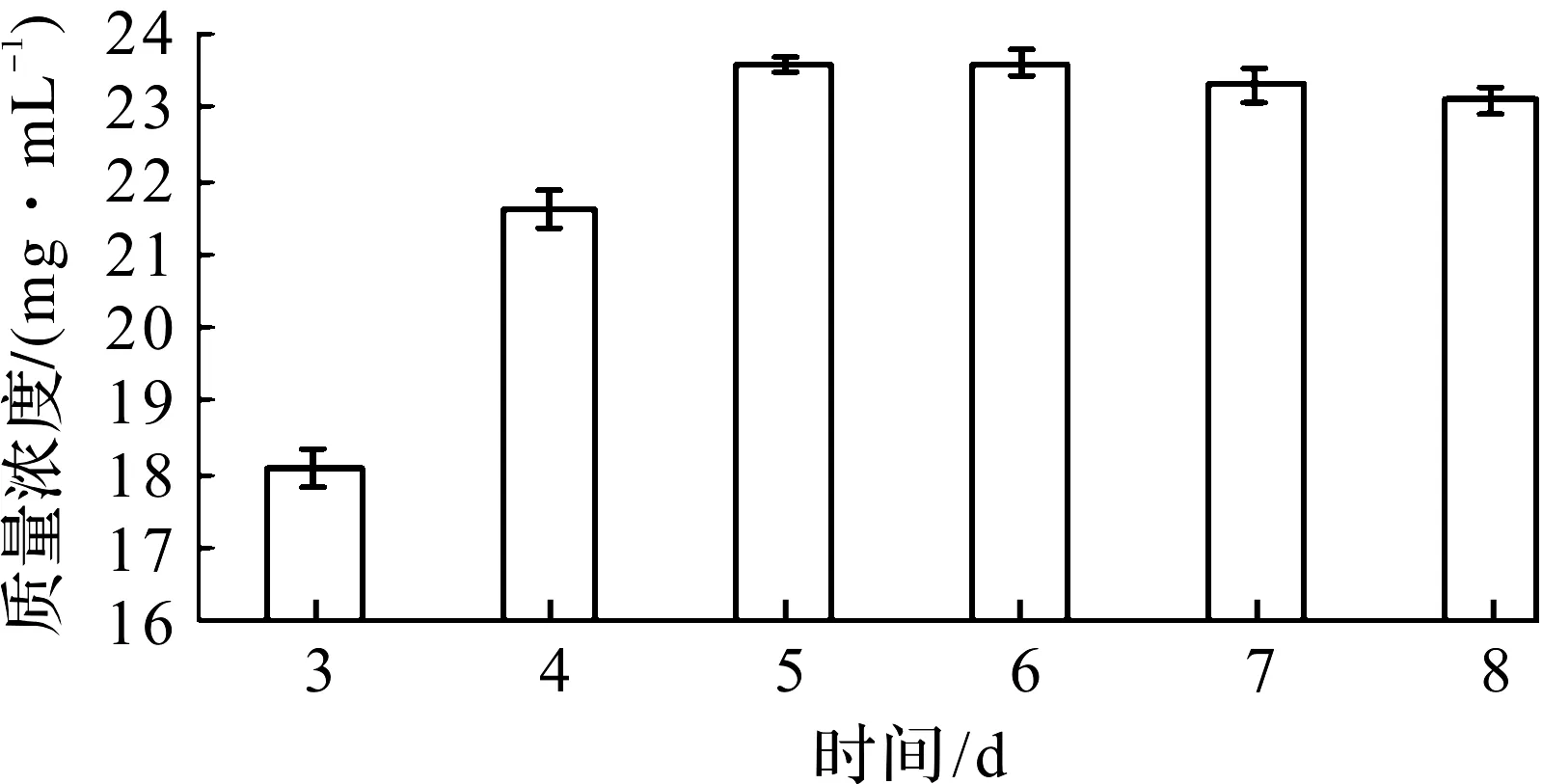
图6 最适发酵时间单因素实验Fig.6 Single factor experiment of optimum fermentation time
选择搅拌转速为实验变量因素,温度30 ℃、时间3 d和pH自然条件下开展单因素实验,结果如图7所示。在100 r/min时,酒精质量浓度最高为18.6 mg/mL,从而可确定菌株K-6发酵酒精的最适发酵转速为100 r/min。
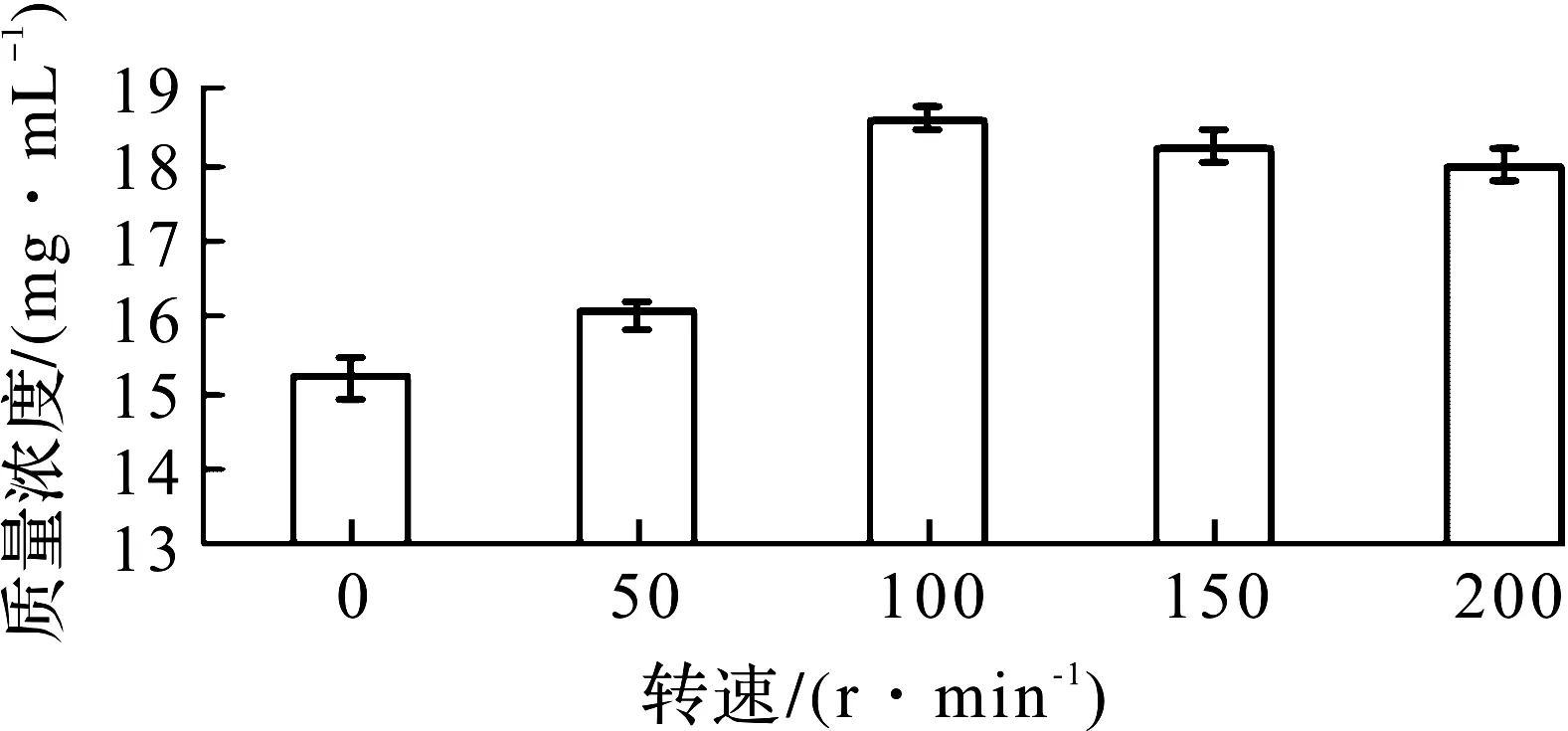
图7 最适发酵转速单因素实验Fig.7 Single factor experiment of optimum fermentation mixing speed
以确定的单因素最适发酵条件为基础,选定因素的3个水平如表1所示,设计L9(34)正交实验以确定最优发酵条件,实验结果如表2所示。
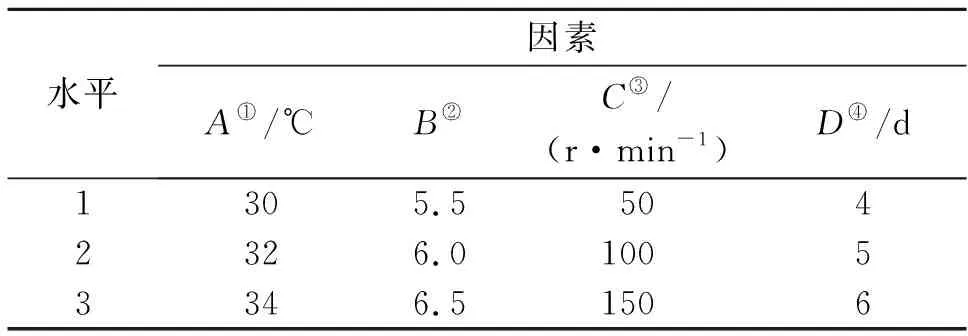
表1 因素水平表Table 1 Table of Factors level
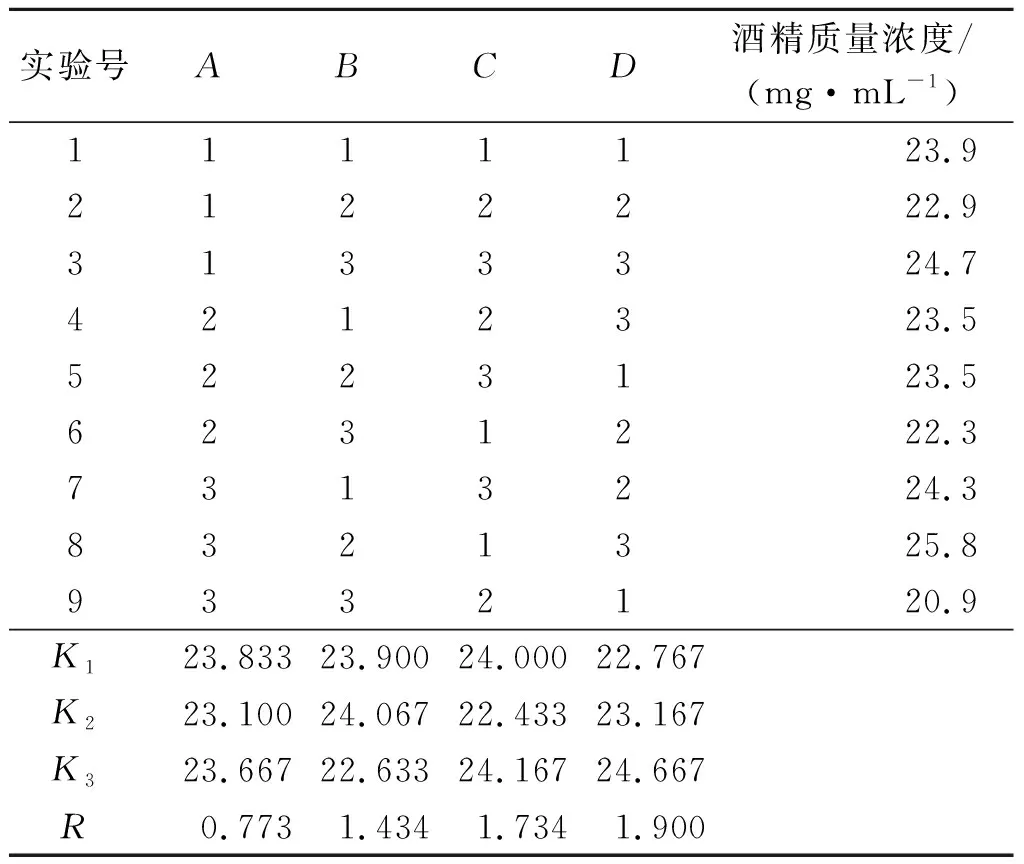
表2 L9(34)正交实验结果Table 2 Orthogonal test results of L9(34)
根据F检验4个因素都不是显著影响因素,所以按照实验结果确定A1B2C3D3为最优发酵条件,即温度30 ℃,pH 6,转速150 r/min和时间6 d,D因素的极差R最大,即发酵时间对酒精生成的影响相对比较明显,最后采用最优条件进行发酵,酒精质量浓度可以达到29.1 mg/mL。
3 结 论
实验成功筛选获得一株菌K-6,证明其能够直接发酵壳聚糖生成酒精,经ITS分子鉴定,结合菌落形态,生殖方式,显色反应,以及可发酵产生酒精的特性,确定其属于S.cerevisiae酿酒酵母菌,并通过实验确定了其生成酒精的最优发酵条件。以壳聚糖为原料发酵生成酒精,为几丁质的综合利用找到了一个可能的新方向,接下来将继续研究酵母菌株K-6发酵产生酒精的酶系构成和催化机制,通过诱变菌株,构建工程菌或者采用固定化酶技术等途径,以期进一步提高酒精发酵效率和发酵稳定性,并尝试探索从几丁质降解到发酵产生酒精的完整工艺过程和条件,为规模化工业生产提供理论和技术支持。
本文得到了徐州生物工程职业技术学院科研项目(2017KY06)的资助。
