L-氨基酸连接酶偶联乙酸激酶催化合成丙谷二肽
2020-12-01王维法季圆清范晓光
王维法,季圆清,洪 翔,范晓光,
(1.莲花健康产业集团股份有限公司 博士后科研工作站,河南 项城 466200;2.天津科技大学 生物工程学院,天津 300457)
丙谷二肽是由L-丙氨酸(Ala)和L-谷氨酰胺(Gln)缩合形成的二肽,属于氨基酸类的化学药剂,由德国费森尤斯(Fresenius AG)于1995年研发成功,首先在德国批准上市,1999年作为进口药物进入中国市场。2005年,日本科学家Tabata[3]试图寻找一种能够连接L-氨基酸形成二肽的酶。基于细菌中D-丙氨酰-D-丙氨酸连接酶的氨基酸序列和结构,通过计算机模拟最终从枯草芽孢杆菌BacillussubtilisATCC 15245中发现了一种L-氨基酸连接酶YwfE。它是一种ATP依赖酶,能够以无保护的氨基酸为底物合成二肽。L-氨基酸连接酶具有广谱性,能以不同氨基酸为底物,合成的二肽类型多达44种。在前期的研究中[4],笔者利用大肠杆菌EscherichiacoliBL21(DE 3)克隆并表达来源于枯草芽孢杆菌B.subtilisATCC 15245的YwfE,采用Ni-NAT亲和层析法分离纯化后,以等浓度(30 mmol/L)的L-丙氨酸、L-谷氨酰胺和腺苷三磷酸(ATP)为底物催化合成22.4 mmol/L的丙谷二肽。
ATP是生命系统中一种必需的分子,是许多过程中必不可少的供能物质[5-6]。自然界中很多酶都属于ATP依赖型酶,需要ATP作为辅助因子才能起到催化作用。生物体通过自身代谢形成ATP再生系统,支持着这些酶的持续作用。当这些酶被用于体外酶催化时,ATP的供应便成为了一个重要的问题。直接使用ATP不但价格非常昂贵,而且过程中形成的腺苷二磷酸(ADP)或腺苷一磷酸(AMP)会对ATP的形成产生抑制作用。构造一个高效的ATP再生系统即成为这一类酶反应的重点研究方向[7-8]。目前,体外用于ATP再生的酶主要为磷酸转移酶[9-10],通常这类酶的作用是将ATP或其他核苷酸上的γ-磷酸基团转移至受体分子。该过程的逆反应常被用于将ADP复磷酸化为ATP。磷酸转移酶是否适用于ATP再生系统的主要取决于成本和稳定性。乙酸激酶(Acetate kinase,Ack)属于一种磷酸转移酶,能够利用乙酰磷酸(ACP)将ADP磷酸化合成ATP,且该反应为可逆反应[11]。在糖酵解反应中,乙酸激酶和乙酰磷酸转移酶共同作用可以催化乙酸合成乙酰辅酶A,而乙酰辅酶A作为生物体内糖、脂肪和蛋白质三大营养物质的物质代谢和能量代谢的枢纽,可以通过氧化磷酸化、三羧酸循环这两条代谢途径互相转化[12-13]。此外,丙酮酸的代谢循环,厌氧菌的醋酸代谢,磷酸化反应及相关生化反应的调控等都需要乙酸激酶的参与,因此乙酸激酶在生物体涉及众多反应发挥着关键的作用[14-16]。由于ACP价格低廉,Ack在ATP再生反应中有着巨大的潜力。研究中,笔者在YwfE催化的丙谷二肽合成反应中引入不同微生物来源的Ack,用于减少反应中ATP的消耗,并对偶联催化反应条件进行了优化。
1 材料和方法
1.1 材 料
1.1.1 菌株和质粒
大肠杆菌E.coliDH5α、大肠杆菌E.coliBL21(DE 3)以及质粒pET-his(Ampr)均由本实验室保藏。
1.1.2 培 养 基
LB(Luria-Bertani)培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7~7.2,121 ℃灭菌20 min。
1.1.3 主要试剂
限制性内切酶、T4DNA连接酶和ExTaq DNA聚合酶均购自宝生物工程(大连)有限公司;PCR产物回收及质粒提取试剂盒购于北京博大泰克生物基因技术有限责任公司;L-丙氨酸、L-谷氨酰胺、丙谷二肽标品和ATP均购于美国Sigma公司;其他试剂均为国产分析纯。
1.2 YwfE的异源表达和纯化
YwfE的异源表达和纯化方法见文献[4]。
1.3 不同微生物来源Ack的异源表达和纯化
根据Genbank上E.coliMG1655,LactobacillusbulgaricusATCC11842和ClostridiumacetobutylicumATCC824的乙酸激酶编码基因,将其分别命名为ack1,ack2,ack3。采用Primer Premier 5.0软件分析并设计引物,各引物序列如表1所示。

表1 ack基因扩增实验中所用引物Table 1 Primers in the experiment of ack amplification
采用细菌基因组试剂盒提取细菌基因组,利用引物以及ExTaq PCR试剂盒扩增乙酸激酶编码基因。目的产物回收后经HindⅢ和BamH Ⅰ酶切、电泳和切胶回收后连接至经相同酶切的表达载体pET-his并化学转化至E.coliDH5α感受态,于LB培养基活化后涂布于含氨苄青霉素(100 μg/mL)的LB固体培养基,过夜培养后,挑取单菌落利用引物进行PCR验证,阳性菌株接入含氨苄青霉素(100 μg/mL)的LB液体培养基,经37 ℃振荡培养12 h后提取质粒进行酶切验证。将验证正确的重组质粒化学转化至E.coliBL21(DE3)感受态细胞,经于SOC中活化后涂布于含氨苄青霉素(100 μg/mL)的LB固体培养基上,于37 ℃倒置培养12 h。挑取单菌落活化后提取其质粒并分别利用引物进行酶切验证。将验证正确的重组菌株以0.1%(质量比)接种量接种至100 mL含氨苄青霉素(100 μg/mL)的LB液体培养基,于37 ℃,200 r/min培养12 h,再按1%(质量比)接种量转接400 mL含氨苄青霉素(100 μg/mL)的LB液体培养基,于37 ℃,200 r/min培养至OD600为0.7时添加终浓度为0.1 mmol/L IPTG,28 ℃诱导培养7 h。培养结束后,7 000 r/min离心10 min去上清,生理盐水洗涤菌体2次,于-80 ℃冻存。
将2 g湿菌体加入50 mL裂解缓冲液重悬均匀后,使用高压匀浆细胞破碎仪(上海永联生物)破碎细胞,6 ℃,80 MPa,破碎5 min,细胞破碎液经13 000 r/min离心20 min后取上清液,于4 ℃保存。将Ni+-NTA树脂加入至层析柱中,再使用20 mL Lysis Buffer平衡冲洗树脂。将25 mL细胞破碎液上清与树脂混合均匀,使用磁力搅拌器4 ℃搅拌吸附30 min。将搅拌吸附后的树脂混合物重新泵入层析柱中,流速控制在0.5 mL/min,之后用20 mL Wash Buffer进行洗脱,洗去杂蛋白,再使用15 mL Elution Buffer进行洗脱,洗脱出目的蛋白。将洗脱的目的蛋白进行收集,使用GE的脱盐柱进行脱盐处理,将脱盐后的目的蛋白按20%的比例加入甘油,并进行分装,于-20 ℃保存。将细胞破碎液及纯化收集流分采用SDS-PAGE分析目的蛋白。
1.4 酶催化反应体系
10 mL最优的催化反应体系如下:Ala 30 mmol/L,Gln 30 mmol/L,MgSO450 mmol/L,ATP 5 mmol/L,ACP-Li 60 mmol/L,Tris-HCl 50 mmol/L(pH 9),纯化的YwfE蛋白200 mg/L,纯化的Ack蛋白80 mg/L。
1.5 丙谷二肽的检测
采用氨基酸分析仪检测反应液中丙谷二肽的含量,其保留时间为24.2 min。
2 结果与讨论
2.1 不同来源乙酸激酶的异源表达与纯化
分别以E.coliMG1655,BulgaricusATCC11842和ClostridiumacetobutylicumATCC824基因组为模板,使用表1中的引物ack1-S/ack1-A,ack2-S/ack2-A和ack3-S/ack3-A分别扩增乙酸激酶编码基因ack1(1 203 bp),ack2(1 188 bp)和ack3(1 206 bp)。将载体pET-His和ack1片段经限制性内切酶BamH Ⅰ/HindⅢ双酶切,将载体pET-His和ack2,ack3片段经限制性内切酶BamH Ⅰ/EcoR Ⅰ双酶切,然后将具有相同黏性末端的载体与目的基因分别连接转化至E.coliDH5α感受态,涂布于氨苄青霉素抗性平板,37 ℃培养12~14 h。后将平板上长出的单菌落分别进行菌落PCR,将初步验证为阳性的单菌落转接摇管,放大培养后提取其质粒,质粒PCR和酶切验证结果如图1所示。
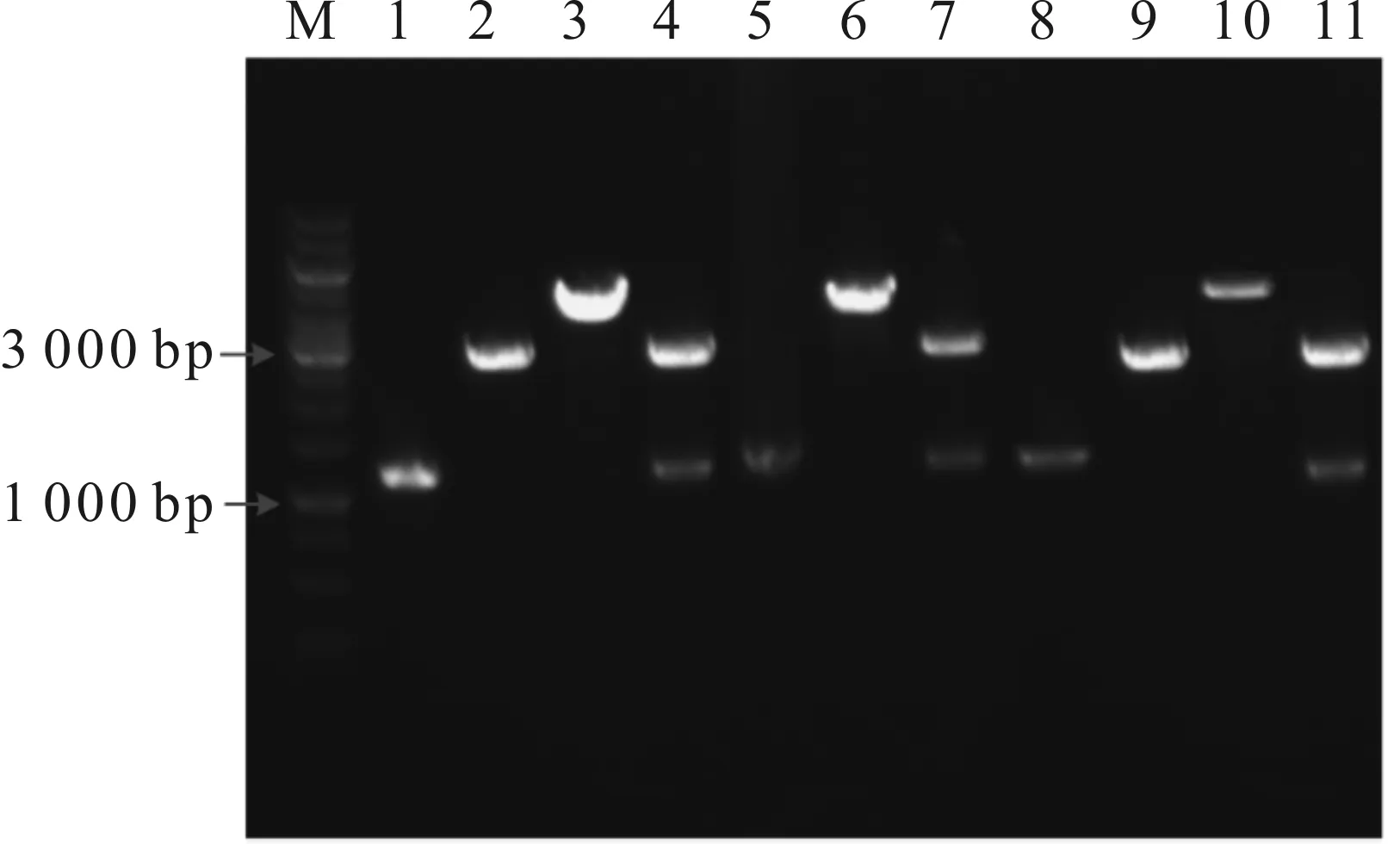
M—Marker;1,5,8—目的基因;2,9—pET-His单酶切;3,6,10—重组质粒单酶切;4,7,11—重组质粒双酶切。图1 重组质粒pET-His-ack1,pET-His-ack2 和pET-His-ack3的酶切验证图谱Fig.1 Identification of recombinant plasmids pET-His-ack1, pET-His-ack2 and pET-His-ack3 digested by restricted endonuclease
由图1可知:重组质粒pET-His-ack1,pET-His-ack2和pET-His-ack3经BamH Ⅰ单酶切后均在4 100 bp处出现预期大小条带;经BamH Ⅰ/HindⅢ或BamH Ⅰ/EcoR Ⅰ双酶切,分别获得与空质粒pET-His大小相符(2 900 bp)大片段和与目的基因大小相符(1 200 bp)的小片段;而以质粒pET-His为模板的阴性对照未扩增出任何目的基因条带。结果表明:经PCR所获得的目的基因已成功连接至pET-His中,将上述重组表达质粒分别转化至E.coliBL21感受态中,获得重组菌分别命名为E.colipET-His-ack1,E.colipET-His-ack2和E.colipET-His-ack3。
对重组菌和空白对照进行摇瓶培养,当菌体浓度达到OD600为0.6~0.8时,添加终浓度0.01 mmol/L的诱导剂IPTG,于28 ℃,200 r/min诱导6 h后,收集产酶细胞,按照1.3节中的方法对酶进行分离纯化,结果如图2所示。

M—蛋白Marker;1—空白对照E.coli pET-His细胞破碎后上清液;2—重组菌E.coli pET-His-ack1细胞破碎后上清液;3—重组菌E.coli pET-His-ack2细胞破碎后上清液;4—重组菌E.coli pET-His-ack3细胞破碎后上清液;5—纯化的Ack1蛋白;6—纯化的Ack2蛋白;7—纯化的Ack3蛋白。图2 SDS-PAGE分析Ack1,Ack2和Ack3蛋白Fig.2 SDS-PAGE analysis of Ack1, Ack2 and Ack3 proteins
根据乙酸激酶Ack1,Ack2和AcK3的氨基酸序列计算,其编码多肽链分子量均为45.2 kDa,泳道2,3和4相应位置均有预期大小的条带,说明乙酸激酶Ack1,Ack2和Ack3已成功诱导表达。泳道5,6和7在对应位置出现预期大小的条带,表明经Ni+-NTA树脂亲和纯化后成功获得乙酸激酶Ack1,Ack2和Ack3。
2.2 不同ATP再生系统的偶联反应效果比对
根据文献的研究结果[4],氨基酸连接酶YwfE在37 ℃,pH 9的条件下酶活力最高,为了验证双酶偶联催化的效果,配置如下催化反应体系:Ala 30 mmol/L,Gln 30 mmol/L,MgSO430 mmol/L,ATP 5 mmol/L,ACP-Li 50 mmol/L,Tris-HCl 50 mmol/L(pH 8或pH 9),纯化的YwfE蛋白200 mg/L,纯化的Ack蛋白50 mg/L。对反应生成的丙谷二肽进行监测,结果如表2所示。
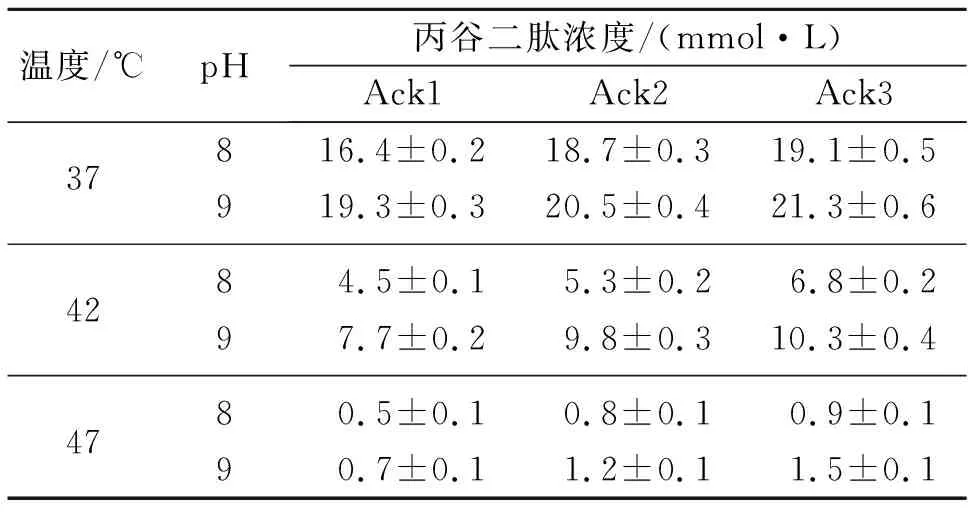
表2 不同偶联反应体系下丙谷二肽的浓度
由表2可知:在温度为37 ℃时,乙酸激酶和氨基酸连接酶的偶联效果最好,这与二者的最适反应温度相近有关。温度37 ℃,pH 9.0条件下的丙谷二肽生成量高于温度37 ℃,pH 8.0条件下的生成量,说明偶联反应时,氨基酸连接酶活力的保持更有助于丙谷二肽的合成。当温度由37 ℃升高到47 ℃,丙谷二肽的生成量显著降低,说明氨基酸连接酶活力受温度影响较大。总体来说,双酶偶联反应制备丙谷二肽的最适反应条件为37 ℃,pH 9,此时以乙酸激酶Ack1,Ack2和Ack3为ATP再生用酶的丙谷二肽的最大摩尔转化率分别为64.3%,68.3%和71%。
2.3 以乙酸激酶Ack3为ATP再生用酶的偶联反应条件优化
与直接使用ATP相比,ATP再生系统引入了新的底物。因此对乙酸激酶Ack3为ATP再生用酶的偶联反应条件进行优化,着重考察MgSO4,ACP-Li和Ack3的添加量对丙谷二肽合成的影响。MgSO4和ACP-Li对偶联催化合成丙谷二肽的影响见图3。
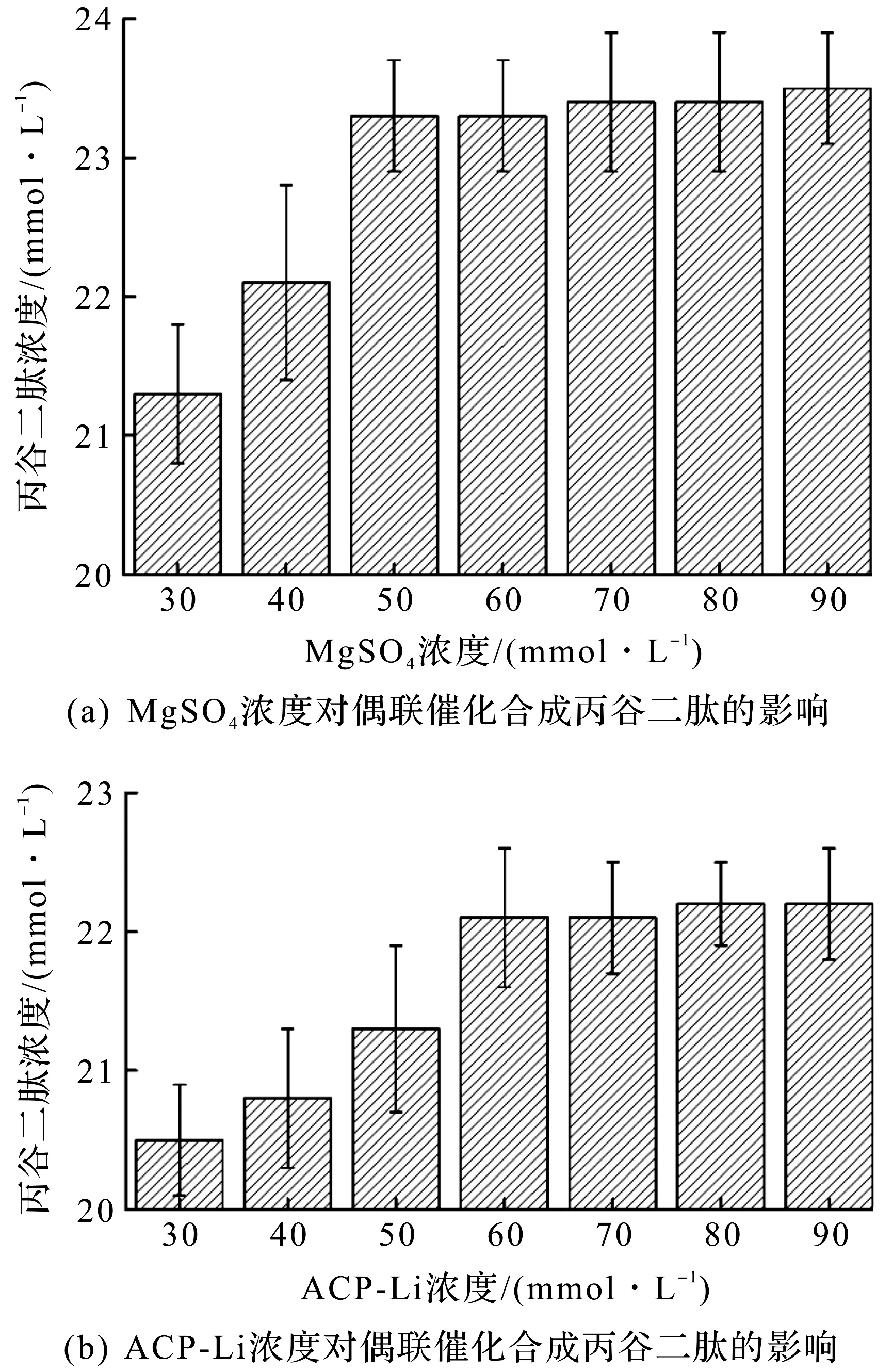
图3 MgSO4和ACP-Li对偶联催化合成丙谷二肽的影响Fig.3 Effect of MgSO4 and ACP-Li concentration on the synthesis of Ala-Gln by coupled enzymatic reaction
由图3(a)可知:Mg2+浓度对偶联反应中酶的活力都有促进作用,当Mg2+浓度从30 mmol/L升高到50 mmol/L时,丙谷二肽的摩尔转化率从71%提升到77.7%,继续提升Mg2+浓度时,丙谷二肽的摩尔转化率没有太大变化。由图3(b)可知:当ACP-Li的浓度从30 mmol/L提高到60 mmol/L,丙谷二肽的摩尔转化率从68.3%提升到73.6%,继续提升ACP-Li时,丙谷二肽的摩尔转化率没有太大变化。因此,偶联反应中底物的最佳配比为Ala 30 mmol/L,Gln 30 mmol/L,MgSO450 mmol/L,ATP 5 mmol/L,ACP-Li 60 mmol/L。
考察乙酸激酶Ack3添加量对偶联催化合成丙谷二肽的影响见图4。当Ack3的添加量从50 mg/L提高到80 mg/L时,丙谷二肽的合成量从21.3 mmol/L提升至24.3 mmol/L,摩尔转化率从71%提升至81%,表明通过提高偶联反应体系中乙酸激酶的浓度,可以有效提升ATP的再生效率,为丙谷二肽合成提供充足的能量供给。继续提升乙酸激酶的添加量,丙谷二肽的合成量没有太大变化,说明此时ATP的供给已不是丙谷二肽合成的限制因素。

图4 乙酸激酶Ack3添加量对偶联催化合成丙谷二肽的影响Fig.4 Effect of Ack3 concentration on the synthesis of Ala-Gln by coupled enzymatic reaction
在优化的反应体系下,即Ala 30 mmol/L,Gln 30 mmol/L,MgSO450 mmol/L,ATP 5 mmol/L,ACP-Li 60 mmol/L,对YwfE和Ack3偶联催化反应进程进行监测,结果如图5所示。

图5 YwfE和Ack3催化的酶反应进程曲线Fig.5 Enzymatic reaction process curve catalyzed by YwfE and Ack3 protein
随着反应的进行,丙谷二肽的生成量逐渐增高,并于16 h达到最大值24.3 mmol/L,副产物丙丙二肽的浓度在14 h达到最大值2.3 mmol/L并逐渐趋于恒定。底物Ala在14 h几乎消耗完全,而Gln则在18 h消耗完全,表明在反应过程中,一部分的底物Ala会额外消耗用于副产物丙丙二肽的合成。
与我们之前的研究结果相比[4],使用Ack3蛋白作为ATP再生体系的催化反应效果比直接使用ATP的催化反应效果更好,这可能是由于直接使用ATP时会伴随着AMP和ADP生成,这些化合物会竞争性的与YwfE结合,从而抑制了YwfE的酶活力。ATP再生体系的引入大幅度减少了反应体系中ATP的使用以及AMP和ADP的积累量,从而维持了反应过程中YwfE的酶活力,提高了底物的利用率。但是ATP再生体系的应用会延长催化反应时间,导致生产效率的下降。
3 结 论
本研究考察了不同ATP再生系统与L-氨基酸连接酶催化丙谷二肽合成反应的适配性。研究表明,C.acetobutylicumATCC824来源的Ack3与YwfE的偶联效果最好。对反应体系进行优化,在37 ℃,pH 9条件下,使用200 mg/L纯化的YwfE蛋白,80 mg/L纯化的Ack3蛋白,催化30 mmol/L的Ala,30 mmol/L的Gln,50 mmol/L的MgSO4,5 mmol/L的ATP,60 mmol/L的ACP-Li反应16 h生成24.3 mmol/L的丙谷二肽,摩尔转化率为81%,同时产生2.3 mmol/L的副产物丙丙二肽。ATP再生体系的引入可以减少丙谷二肽合成过程中ATP的使用,减少AMP和ADP对于L-氨基酸连接酶的竞争性抑制,提高底物的利用率和摩尔转化率,其研究结果对于大规模的丙谷二肽催化生产具有一定的指导意义。
