一株凝结芽孢杆菌在竹笋酵素制备中的应用
2020-12-01方小聪钟建荣杨善岩徐昊泽陈稳竹
方小聪,钟建荣,杨善岩,徐昊泽,陈稳竹
(1.眼力健(杭州)制药有限公司,浙江 杭州 310018;2.杭州民生健康药业有限公司,浙江 杭州 311100;3.杭州民生药业有限公司,浙江 杭州 311100)
“酵素(Enzyme)”在旧时也指酶类物质,现在多指一些发酵产物,如市面上常见的植物酵素、酵素菌肥和环保酵素等,都属于后者。其中的植物酵素,是利用益生菌对果蔬等植物来源的底物进行发酵,得到的一种富含生物酶、维生素及次生代谢产物的微生物产品[1-2]。如果是采用人工接种的益生菌发酵制备的酵素,称为人工酵素;如果采用底物自带益生菌或环境含有的益生菌发酵制备的酵素,则称为天然酵素[3]。前者发酵周期短,制备迅速,且过程可控,不易被杂菌污染;后者发酵周期长,过程不可控,容易被杂菌污染。当前酵素及益生菌类产品是市场的热门,如果利用益生菌对竹笋进行发酵处理,制成含有活性益生菌的竹笋酵素,可实现活性益生菌与竹笋的结合,同时可增加其风味。益生菌在主要定植于肠道,具有调节肠道微生态、促进消化吸收、提高机体免疫力等作用[4-6],产生的细菌素还有抑制有害菌的作用[3,7-9]。但竹笋中纤维素较多,而普通益生菌又不能降解纤维素,所以制备的竹笋酵素往往口感较差。
凝结芽孢杆菌(Bacilluscoagulans)既产芽孢,又产乳酸,是一种“有孢子的乳酸菌”。该菌不仅具有普通乳酸菌(如乳杆菌、双歧杆菌和嗜热链球菌等)的保健功效,还具有较强抗逆性(如耐热性、耐酸性和耐胆碱等)[10],且对肠道致病菌具有较强的抑制作用[11]。卫计委2016年第6号公告,将凝结芽孢杆菌列入《可用于食品的菌种名单》。有研究表明:凝结芽孢杆菌在产生乳酸的同时,可代谢产生纤维素酶[12],可有效降解纤维素;能合成如维生素、氨基酸和短链脂肪酸等;还能代谢产生对肠道炎症有治疗作用的抑菌物质,如“凝结素”、L-乳酸和一些低分子胺类物质等[13],是制备竹笋酵素的理想发酵菌种。利用凝结芽孢杆菌发酵结合真空冷冻干燥技术制备竹笋酵素,不但克服了天然竹笋口感和风味差的缺陷,而且富含益生菌和生物活性物质,使其变成一种安全营养的功能食品配料。在此,以分离筛选到的一株凝结芽孢杆菌MSJK001为菌种,通过Minitab 16和Design-Expert 7.0.3软件对竹笋的发酵条件进行了优化,确定了发酵过程中的关键参数。
1 材料及方法
1.1 材 料
土壤样品,采集于浙江省杭州市的一块农田表层(0~10 cm);新鲜竹笋,采用新鲜毛竹笋,采自浙江省湖州市安吉县;PCR试剂盒,PCR产物纯化试剂盒,pMDl9-T simple vectorE.coliDH5α均购于TaKaRa公司;人工胃液(胃蛋白酶活性3 000 U/mg,pH=1.5±1)、人工肠液(胰蛋白酶活性250 U/mg,pH=6.8±1)购自Sigma公司;L-乳酸检测试剂盒购自上海酶联生物科技有限公司。
1.2 富集与分离
采用GYP培养基对预处理土壤进行富集培养,采用(MRS培养基)分离潜在的L-乳酸产生菌。取一个250 mL的三角瓶,加入100 mL GYP培养基,将约10 g的土壤样品加入,摇匀,然后置于100 ℃处理15 min,于30 ℃,150 r/min孵育24 h。取1 mL的培养物用灭菌蒸馏水进行梯度稀释,稀释液分别涂布于MRS培养基(添加CaCO3质量浓度20 g/L)平板,置于30 ℃条件下培养2~3 d。选择有周围有透明圈的单菌落,进一步进行平板划线分离。
1.3 菌种鉴定
利用《伯杰氏细菌手册》进行菌种的形态鉴定,通过16S rDNA序列比对进行菌种的分子鉴定。16S rDNA引(前导链:5′-GACGAACGCTTGCGGCGTGC-3′,后随链:5′-CCTTCCAATACGGAGGGTGC-3′)物由生工生物工程(上海)有限公司合成。PCR体系参照PCR试剂盒说明书进行。PCR程序:95 ℃预变性6 min;95 ℃变性45 s,60 ℃退火45 s,72 ℃延伸1 min,30次循环;72 ℃延伸15 min。PCR产物用1.0%的琼脂糖凝胶电泳检测,分别回收目的片段,并T/A克隆至pMDl9-T simple vector,转化E.coliDH5α,经蓝白斑筛选获得转化子,测序由上海华大基因科技有限公司完成。目标菌株的16S rDNA序列提交GenBank数据库,获得登录号MK402079。该序列经GenBank数据库Blast比对分析,确定其亲缘关系。
1.4 发 酵
保藏菌种于MRS斜面培养基45 ℃活化18 h;用无菌水洗下菌种,并将其OD600调整为1,即为菌悬液;按照质量分数8%的接种量,转接于MRS液体培养基,于45 ℃,150 r/min培养18 h,即为液体菌种。
新鲜毛竹笋,除杂切成1 cm长(或见方)的小段(或小块),按固液比1∶6加无菌水,匀浆,制备竹笋匀浆液。用无菌水和麦芽糊精将竹笋匀浆液的相对密度调整为1.2,再用无菌水和葡萄糖浆将其糖度调整到1~2,最后将其pH调整为5~8。
将液体菌种按照质量分数4%~14%的接种量,转接于上述竹笋匀浆液,然后将其装入500 mL的三角瓶(装量2/3),密封,于25~50 ℃,100 r/min,发酵24~48 h。
1.5 发酵液后处理
发酵结束后,每100 mL发酵产物中添加10 g海藻糖,混匀溶解,于真空度15 Pa,温度-60 ℃条件下冷冻干燥;真空冷冻干燥结束后,产物用粉碎机粉碎至20~40目。
1.6 检测方法
1.6.1 益生菌检测
益生菌活菌数按照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》测定。
1.6.2 pH值测定
首先将5.0 g(液体试样为5 mL)样品加45 mL蒸馏水制成稀释液,然后测定pH值。
1.6.3 乳酸测定
L-乳酸测定按照L-乳酸检测试剂盒说明书进行。
1.6.4 溶解性测定
将样品加入25 ℃的纯化水中,搅拌使其溶解,2 000 r/min,离心10 min;弃沉淀,上清液冷冻干燥处理(真空度15 Pa,温度-60 ℃)。溶解质量分数=(上清液冻干物质量/待测样品质量)×100%,样品均以干重计。
1.6.5 抗逆性测定
取2 g样品,溶于37 ℃的人工胃液/人工肠液中100 r/min搅拌30 min。以生理盐水替代人工胃液/人工肠液,作为对照;于8 000 r/min,离心20 min,弃上清,沉淀用生理盐水洗涤3次;沉淀用生理盐水梯度稀释;选择2~3个合适的稀释度,每个稀释度吸取100 μL样品分别加入到培养皿中,倾入冷却至50 ℃左右的MRS培养基约20 mL,轻轻旋转摇匀,静置凝固,于37 ℃培养箱中培养12~20 h计数。抗逆性通过率=(试验组/对照组)×100%。
1.7 统计学分析
利用统计软件Minitab 16进行Plackett-Burman试验设计及分析,考察各因素的显著差异,进行最陡爬坡试验,确定显著性的最佳值区域,通过Design-Expert 7.0.3软件进行Box-Behnken试验设计及响应面优化分析。
2 结果及分析
2.1 菌株形态及生理生化特征
如图1所示,分离到的一株L-乳酸产生菌(命名为MSJK001),菌体大小为(0.7~0.8) μm×(3~5) μm,革兰氏染色呈阳性,无鞭毛,杆状,多数单独存在,少数排成短链;芽孢端生,大小约0.55 μm×1.1 μm。该菌株在MRS培养基(添加CaCO3质量浓度20 g/L)上的菌落直径为2.0~2.5 mm,周围有溶钙圈,边缘整齐,表面有光泽,不透明,质地软。

图1 菌株MSJK001溶钙圈及芽孢染色图Fig.1 Dissolved calcium circle and spore staining of strain MSJK001
生理生化试验结果如表1所示,革兰氏染色、VP试验、淀粉水解和酪蛋白分解等均呈阳性,而柠檬酸盐利用、甲基红试验和吲哚产生等均呈阴性,比较发现菌株MSJK001生理生化特征与凝结芽孢杆菌最为相似。

表1 菌株MSJK001生理生化特征
2.2 菌株MSJK001的16S rDNS序列比对
将菌株MSJK001的16S rDNS序列与GenBank公布的序列进行比对,发现该菌株与凝结芽孢杆菌16S rDNA序列(登录号DQ347840.1)的同源性最高,达到99%。通过综合形态特征、生理生化分析及序列分析比对,可以认为菌株MSJK001为凝结芽孢杆菌的1个亚种,可正式将其定名为凝结芽孢杆菌MSJK001。凝结芽孢杆菌MSJK001的16S rDNA序列提交NCBI的GenBank,获得登录号为No.MK402079。
2.3 影响因素显著性分析
通过Plackett-Burman试验对影响因素进行显著性分析。试验选取5个因素进行考察,通过对比各因素两水平间差异与整体差异来分析因素的显著性,所选因素及水平分别为糖度(1.0%,1.5%)、初始pH(6,7)、接种量(4%,8%)、温度(35,40 ℃)和时间(24,36 h),采用N=12试验设计进行试验,借助统计软件Minitab 16进行数据分析。因素效应Pareto图见图2,竹笋凝结芽孢杆菌发酵的显著性影响因素(置信度大于95%)有接种量、温度和初始pH,这3个显著因素对发酵液的活菌数的影响可以由方程Y看出:Y=-3.705-0.067A+0.010 28B+0.088 3C+0.048 7D+0.256 7E,R2=0.840 7。

A—糖度;B—时间;C—接种量;D—温度;E—初始pH。图2 因素效应Pareto图Fig.2 Pareto picture of factorial effect
2.4 最陡爬坡试验
由影响因素显著性分析可知:接种量、温度和初始pH为显著性影响因素。对这3个显著性因素进行进一步的优化,确定其最佳值。在响应面优化中,要真实的反应真实情形并建立有效的拟合方程,需要接近因素的最佳值区域,这往往通过最陡爬坡试验来实现[14-15]。试验设计及结果见表2,其中5号试验中发酵液活菌数最高,可达4.42×109CFU/mL,即对应的接种量、温度和初始pH值3个因素在最佳值附近,可据此进一步对发酵条件进行响应面优化。

表2 最陡爬坡试验设计及结果
2.5 发酵条件的响应面优化
2.5.1 回归模型拟合及方差分析
采用Box-Behnken试验,对影响发酵液活菌数的显著因素进行三因素三水平的15组试验。因素水平设置分别为接种量(10%,12%,14%),温度(44,48.5,53 ℃),初始pH(6.5,7,7.5)。对试验结果进行分析,拟合得到多元回归模型:发酵液的活菌数Y=4.55+0.092X1+0.079X2+0.014X3+0.05X1X2-0.06X1X3+0.48X2X3-0.36X12-0.81X22-0.42X32。方差分析显示:接种量、初始pH及温度对发酵液活菌数有显著的正效应,模型p=0.009 4,小于0.05,显著;矢拟项的p=0.146 5,大于0.05,不显著;决定系数R2=0.949 5,大于0.9,综上所述回归模型拟合程度良好。
2.5.2 响应面交互作用优化与分析
为进一步研究相关变量之间的交互作用并确定最优点,利用Design-Expert 7.0.3软件对回归模型进行分析,图3为部分响应面分析立体图和等高线图。软件分析结果表明:当接种量为9.1%、温度为48.9 ℃及初始pH为6.8时,发酵液的活菌数预测最高值为4.549 56×109CFU/mL。综合考虑,将最佳条件定为接种量9%、温度49 ℃及初始pH 6.8。
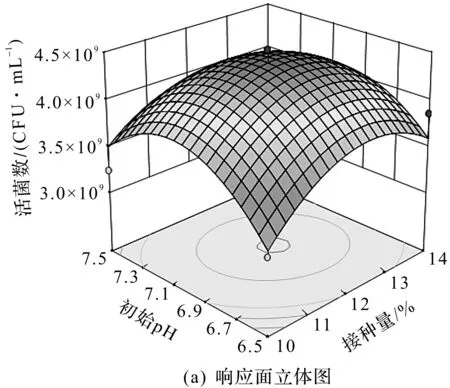

图3 活菌数的响应面3D及等高线图Fig.3 Plots and 3D response surface of VIC values
2.5.3 验证试验
为验证模型预测的准确性,用优化后的条件(接种量9%、温度49 ℃及初始pH 6.8)进行试验,发酵液中的活菌数为4.37×109CFU/mL,基本吻合模型预测最大值,说明模型合理有效。
2.6 产物特性
发酵液经真空冷冻干燥处理,做成的竹笋酵素粉富含活性凝结芽孢杆菌,活菌数可达3.8×1011CFU/g,在水中的溶解质量分数为56.8%。竹笋酵素粉中含有以乳酸为主的大量的有机酸,其中L-乳酸质量分数可达0.5%。人工胃液、人工肠液抗逆性测试结果表明了凝结芽胞杆菌通过率为35.6%。
3 结 论
以凝结芽孢杆菌对竹笋进行发酵,通过Plackett-Burman试验及Box-Behnken试验对发酵条件进行优化,确定了最佳的发酵条件。用优化后的条件进行发酵和冷冻干燥,得到了理想的竹笋酵素粉活菌数、溶解质量分数和抗逆性测试结果凝结芽胞杆菌通过率。凝结芽孢杆菌可与其他益生菌进行竹笋的联合发酵,也可在发酵前利用纤维素酶对竹笋进行酶解或在发酵过程中接入纤维素降解菌,进一步改善竹笋的溶解性。结果表明:益生菌发酵竹笋酵素粉将益生菌的益生效果与竹笋的健康功效合二为一,并改善了竹笋的营养结构,使之更符合现代人群的健康需求,同时也为益生菌的利用及酵素产品的开发提供了新的思路。
