高负荷厌氧处理番茄红素发酵废水的研究
2020-12-01郝红红张汀军季康锋徐舒宁邵佳丹
郝红红,张汀军,季康锋,徐舒宁,邵佳丹
(1.浙江医药股份有限公司 昌海生物分公司,浙江 绍兴 312000;2.浙江工业大学 环境学院,浙江 杭州 310014)
生物发酵生产番茄红素的过程中会产生发酵废水,发酵废水来自发酵产品分离提取(萃取、吸附、结晶和干燥等)后产生的,具有有机物质量浓度高、色度高和悬浮物质量浓度高等特点[1-3]。厌氧工艺是处理这类发酵废水的经济有效方法,通过厌氧处理不仅可以有效降解污染物,并且能回收沼气[4-6],也为后续的好氧处理工艺减轻负荷。目前利用厌氧技术处理番茄红素发酵废水的报道虽然较多,但是很少有厌氧反应器能达到较高的COD容积负荷(VLR)并且能够稳定运行的相关报道。如左昌平[7]通过厌氧折流板反应器处理番茄红素发酵废水的试验中,当进水COD质量浓度为700~1 500 mg/L,COD容积负荷约为3 kg/(m3·d)时,COD去除率可以达到60%以上;Alpesh等[8]通过UASB反应器处理番茄红素发酵废水的试验中,当进水COD质量浓度为4 300 mg/L,COD容积负荷为1.6 kg/(m3·d)时,COD去除率可以达到85%以上。因此,有必要通过厌氧反应器对番茄红素发酵废水进行高负荷厌氧处理,从而减少运行成本。本试验采用改进型内循环厌氧反应器(MIC反应器),先接种活性污泥,然后考察番茄红素发酵废水的高负荷厌氧处理过程,再分析微生物群落结构变化。
1 材料与方法
1.1 试验装置
MIC反应器的主要材料为有机玻璃,反应器内径为0.15 m,高为2.5 m,反应器有效体积为0.02 m3,MIC反应器示意图如图1所示。废水通过进水泵由反应器底部泵入反应器主体,然后废水从反应器上部流出到出水箱,沼气通过湿式气体流量计计量后排出;相对于普通IC反应器,该反应器的中部设有回流出口,通过回流泵循环废水,提高废水与污泥的传质效果,整个试验过程中循环液流量控制在8 L/min,对应上升流速为27.2 m/h。MIC反应器的外壁为保温夹套,恒温水浴装置的温度由控制箱控制。

图1 MIC反应器示意图Fig.1 Sketch of the MIC reactor
1.2 接种污泥与试验用水
接种污泥取自杭州市某城镇污水处理厂二沉池,通过砂布过滤污泥以去除大颗粒砂石,自然沉降倒去上清液,MIC反应器接种污泥的MLSS质量浓度为9.2 g/L,m(MLVSS)∶m(MLSS)=0.63,接种体积约10 L。试验用水为番茄红素发酵废水,取自绍兴某制药公司,其废水基本水质见表1。

表1 番茄红素发酵废水水质
1.3 反应器运行
试验共进行119 d,试验期间控制停留时间(HRT)为4 d,1~20 d为阶段Ⅰ,该阶段将V(自来水)∶V(番茄红素发酵废水)=5∶1混合作为进水,再采用出水循环的方式先使接种污泥适应番茄红素发酵废水并提高接种污泥的活性。21~119 d为阶段Ⅱ,该阶段通过逐步提高进水当中番茄红素废水的比例,直到进水全部为番茄红素发酵废水为止。由于经稀释后的番茄红素废水pH值较低,因此通过添加NaOH和Na2CO3来调节进水pH,使进水pH为6.5~7.5,并且在试验过程中添加Fe2+,Zn2+,Mn2+,Co2+,Ni2+和Cu2+等微量元素[9],整个试验过程将反应器内部温度控制在(35±2) ℃。
1.4 分析方法
1.5 微生物群落结构分析
污泥样品共2组,分别为反应器运行0 d和119 d的样品,其中0 d的污泥为反应器的接种污泥,对2组样品进行微生物多样性检测。根据E.Z.N.A.® soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA抽提,DNA质量浓度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3-V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min(PCR仪:ABI GeneAmp®9700型)。PCR反应体系为20 μL,产物用2%琼脂糖凝胶进行电泳检测,切胶回收PCR产物并进行定量,制备PE文库并用Miseq PE300(Illumina)进行测序,原始测序序列使用Trimmomatic软件质控,然后使用FLASH软件进行拼接,再使用UPARSE软件进行OUT聚类,最后利用RDP classifier进行物种分类注释。
2 结果与讨论
2.1 COD去除率
COD去除率是反映厌氧反应器运行好坏的一个重要指标,定期检测进出水COD质量浓度,可以反映反应器的运行状况。反应器进出水COD质量浓度以及COD去除率变化情况如图2所示。

图2 COD质量浓度及去除率变化曲线Fig.2 Variations of COD concentration and removal efficiency loading rate
从图2可知:阶段Ⅰ最初10 d进水COD质量浓度为5 000 mg/L左右时,去除率可以达到40%以上,然后在接下来10 d采用出水循环的方式,而这10 d反应器对COD的去除率也有20%左右,表明最初10 d的出水还存有生物可降解性COD。在阶段Ⅱ中,从第21 d开始,进水方式采用逐步提高进水COD质量浓度的方法,并且每当COD去除率达到80%以上并稳定3~7 d,再提高进水COD质量浓度,每次提高进水COD质量浓度时,COD去除率都会有所下降,其原因为提高进水COD质量浓度对厌氧系统具有一定的冲击,厌氧微生物需要一段时间去适应外界环境的变化,随着厌氧微生物活性的提高,COD去除率将会有所上升[11-12]。当MIC反应器处理番茄红素废水第119 d时,反应器进水COD质量浓度为32 848 mg/L,出水COD质量浓度为3 445 mg/L,COD去除率为89.5%。
2.2 pH变化
pH值是影响厌氧微生物新陈代谢过程的最重要因素之一,定期检测进出水pH可以反映厌氧反应器的运行情况。MIC反应器进出水pH变化情况如图3所示。

图3 厌氧反应器进出水pH变化曲线Fig.3 Variation curve of pH in the anaerobic reactor
在阶段Ⅰ中,其进水pH和出水pH值相接近,这可能的原因为水解菌水解复杂有机物产生了脂肪酸、氨氮和醇类等物质,部分脂肪酸和氨氮被微生物所利用,剩余的脂肪酸和氨氮水解产生[H]+和[OH]-的量相接近,从而使溶液的pH变化不大[13]。
在阶段Ⅱ中,21~50 d的进、出水pH的变化同阶段Ⅰ相似。在51~119 d,当进水pH在6.0~7.0时,出水pH为6.5~7.5,结果表明:出水pH大于进水pH,这较大的原因为水解菌水解复杂有机物产生了脂肪酸、氨氮和醇类等物质,部分脂肪酸和氨氮被微生物所利用,剩余脂肪酸水解产生的[H]+小于氨氮水解产生[OH]-的量,从而使出水pH大于进水pH。
2.3 产 气 量
产气量是厌氧反应过程中一个重要的检测指标,能反映厌氧反应器的运行状况。MIC反应器厌氧发酵过程产气量和VLR变化曲线如图4所示。

图4 沼气和容机负荷变化曲线Fig.4 Variations of biogas and volumetric loading rate
在阶段Ⅰ中,由于采用出水循环的方式,在11~20 d的COD容积负荷(约0.7 kg/(m3·d))相对于1~10 d的COD容积负荷(约1.3 kg/(m3·d))较低,其11~20 d的产气量(约0.3 L/d)相对于1~10 d的产气量(1.25~1.90 L/d)较低,虽然11~20 d的产气量较低,但可以说明在1~10 d的出水还有含部分未被生物利用的物质。
在阶段Ⅱ中,从21 d开始,产气量与VLR的变化趋势相似,但是每当VLR有所提升时,MIC反应器的产气量会波动性地上升,这与COD去除率的变化有关。当MIC反应器处理番茄红素废水在119 d时,反应器的COD容积负荷为8.21 kg/(m3·d),此时产气量为82.3 L/d。
2.4 污泥质量浓度变化
污泥质量浓度是厌氧反应过程中一个重要的检测指标,能反映厌氧微生物的生长情况以及反应器的运行状况。取样口每隔约30 d测1次MLSS和MLVSS,MLSS与m(MLVSS)∶m(MLSS)变化如图5所示。

图5 MLSS质量浓度与m(MLVSS)∶m(MLSS)的变化Fig.5 The changes of MLSS concentration and m(MLVSS)∶m(MLSS)
从图5可知:接种污泥的MLSS质量浓度为9.2 g/L,m(MLVSS)∶m(MLSS)为63%,在最初30 d,污泥质量浓度从9.2 g/L增长到10 g/L,m(MLVSS)∶m(MLSS)从0.63增长到0.65,MLSS与m(MLVSS)∶m(MLSS)值变化较小,一方面是沉降性能以及活性较差的污泥被洗出,另一方面是微生物需要适应外界环境的结果。在60,90,119 d时,MLSS质量浓度分别为14.1,20,34 g/L,m(MLVSS)∶m(MLSS)分别为0.71,0.81,0.89,可以看出MLSS质量浓度呈上升的趋势,并且增长速率也越来越大,其原因为厌氧微生物适应了番茄红素发酵废水,以此作为新陈代谢的基质,实现微生物快速繁殖;m(MLVSS)∶m(MLSS)也呈上升的趋势,表明污泥中微生物质量浓度的比重越来越大,也说明活性较高。
2.5 细菌群落变化
不同样品污泥微生物菌群中细菌在门和属水平上的群落结构组成情况如图6所示。

1—Others;2—WS6;3—Synergistetes;4—Saccharibacteria;5—Proteobacteria;6—Parcubacteria;7—Ignavibacteriae;8—Firmicutes;9—Chlorlflexi;10—Bacteroidetes;11—Actinobacteria;12—Acidobacteria。(a) 细菌在门水平上的群落组成
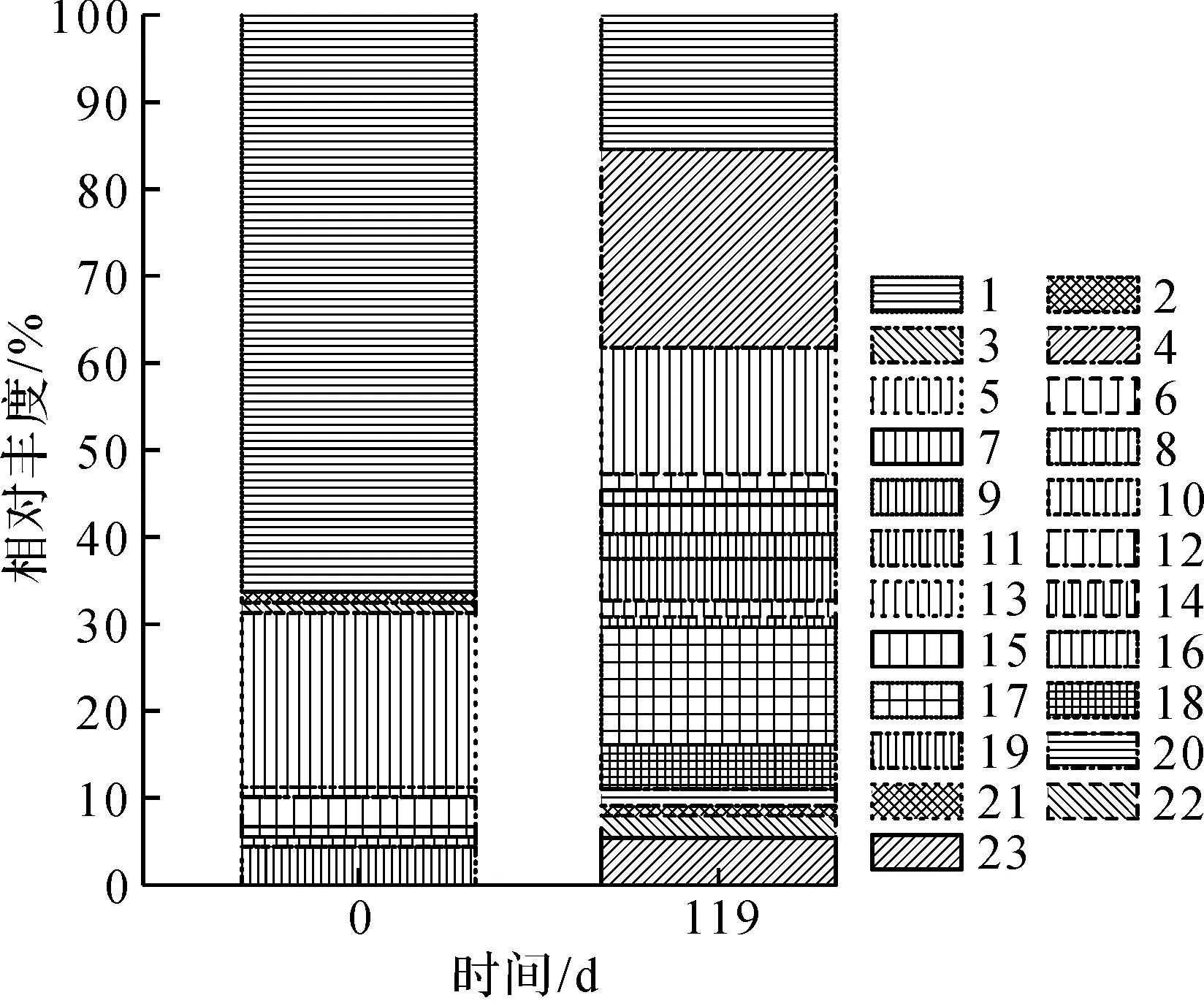
1—Unclassified;2—Terrimonas;3—Roseiflexus;4—Rhodococcus;5—Others;6—Microbacterium;7—Megasphaera;8—Leucobacter;9—Lactobacillus;10—Lamia;11—Gordonia;12—Ferru-ginibacter;13—Eubacterium;14—Devosia;15—Deni-tratisoma;16—CL500-29_marine_group;17—Cellu-lomonas;18—Candidatus_Microthrix;19—Candi-datus_Microthrix;20—Camelimonas;21—Aeromicro-bium;22—Actinomyces;23—Acidaminococcus。(b) 细菌在属水平上的群落组成
由图6(a)可知:接种污泥丰度大于5%的菌群有Chloroflexi(27.1%),Proteobacteria(22.5%),Actinobacteria(18.5%),Bacteroidetes(9.3%),Saccharibacteria(5.8%)和Actinobacteria(5.3%),其中Chloroflexi,Proteobacteria和Actinobacteria这3类菌门所占的比例之和为68.1%,为接种污泥主要的菌门类型;除了丰度大于5%的菌门之外,接种污泥中还含有其他类型的微生物菌门,这与较多学者研究城市污水厂活性污泥细菌群落结构中的优势菌群以及种类较多的结果相一致[14-15]。由图6(b)可知:接种污泥中Others和Unclassified分类所占有的丰度分别为20%和66.2%,表明接种污泥虽然含有多种类型的细菌,但是丰度较小。
由图6(a)可知:在119 d时的厌氧污泥与接种污泥相比,细菌在门水平上的群落结构发生了变化,其中优势菌群为Actinobacteria(47.1%),Firmicutes(29.1%)和Proteobacteria(10.4%),这3种菌是主要的水解酸化菌,参与复杂有机物的降解;而原先接种污泥的优势菌(如Chloroflexi,Bacteroidetes,Saccharibacteria和Actinobacteria)在119 d时的厌氧条件培养下,其丰度大幅度下降,主要的原因是这4种菌为好氧菌,不适应在厌氧条件下存活。由图6(b)可知:其中优势菌群为Acidaminococcus(5.4%),Christensenellaceae_R-7_group(13.5%),Cellulomonas(5.1%)和Rhodococcus(22.8%),这几种菌是主要的水解酸化菌,参与复杂有机物的降解。细菌群落中属水平上占主导地位的菌种Rhodococcus属于Actinobacteria,其作用为降解碳氢化合物和蛋白质等物质[15]。
2.6 古菌群落变化
不同时间段微生物菌群中古菌在属水平上的群落结构组成情况如图7所示。

1—Others;2—Methanosphaera;3—Methanosarcina;4—Metha-nosaeta;5—Methanomethylovorans;6—Methanomassilii-coccus;7—Methanoculleus;8—Methanocorpusculum;9—Methanobrevibacter;10—Methanobacterium。图7 不同样品中古菌在属水平上的群落结构组成Fig.7 Composition of archaea community structure at the genus level in different samples
由图7可知:接种污泥中丰度大于5%的菌群有Methanobacterium(20.3%),Methanobrevibacter(18.8%),Methanosaeta(38.9%)和Methanosarcina(5.1%),其中Methanobacterium,Methanobrevibacter,Methanosaeta和Methanosarcina这4类菌属所占用的比例之和为83.1%,其中氢营养型产甲烷属有Methanobacterium和Methanobrevibacter,氢营养型产甲烷菌可利用H2/CO2和甲酸进行生长代谢;乙酸营养型产甲烷菌有Methanosaeta和Methanosarcina,乙酸营养型产甲烷菌可利用乙酸进行生长代谢[17],表明产甲烷菌中的氢营养型产甲烷菌和乙酸营养型产甲烷菌的比例都不低。除了丰度大于5%的菌属之外,接种污泥中还含有其他类型的微生物菌属,这与较多学者研究城市污水厂活性污泥古菌群落中的优势菌群以及种类较多的结果相一致[18-19]。
第119 d的厌氧污泥与接种污泥相比,古菌在属水平上的群落结构发生了变化,其中优势菌群为Methanobacterium(30.6%),Methanobrevibacter(20.4%),Methanocorpusculum(15.4%)和Methanosarcina(26.9%),其中Methanocorpusculum为氢营养型产甲烷菌,表明产甲烷菌以氢营养型产甲烷菌为主。而原先接种污泥的优势菌Methanosaeta在119 d时的厌氧条件培养下,其丰度大幅度下降,可能的原因为反应器中乙酸的质量浓度较低导致没有足够的底物能够被Methanosaeta利用[20]。
3 结 论
采用MIC反应器接种活性污泥,控制HRT为4 d,经过119 d厌氧培养,MIC反应器对番茄红素发酵废水有较好的处理能力。在一定的进水质量浓度条件下,COD处理容积负荷可达到8.21 kg/(m3·d),COD去除率为89.5%。MIC反应器虽然对番茄红素发酵废水能够去除大部分的有机污染物,但出水COD仍然较高,需要后续处理才能达到排放要求。微生物群落结构显示:接种污泥经过119 d厌氧培养,微生物群落结构发生了改变。细菌物种多样性减少,细菌群落中门水平Actinobacteria,Firmicutes和Proteobacteria为优势菌,属水平上Rhodococcus为占主导地位的菌;古菌物种多样性同样减少,古菌群落中属水平Methanobacterium,Methanobrevibacter,Methanocorpusculum和Methanosarcina为优势菌,并且以氢营养型产甲烷菌为主。
