替莫唑胺对Livin基因过表达的胶质瘤TJ905细胞及其干细胞增殖活性的影响
2020-12-01李根华冯嵩韩光魁马文渊刘臣孔令胜靳峰
李根华 冯嵩 韩光魁 马文渊 刘臣 孔令胜 靳峰
胶质瘤是成年人中最常见、最具有侵袭性的原发脑肿瘤,约占中枢神经系统肿瘤的30%,虽然近年来治疗技术不断进步,但胶质瘤患者的预后仍不理想[1-2]。胶质母细胞瘤(glioblastoma multiforme,GBM)是Ⅳ级胶质瘤,患者1年生存率低于30%,高级别恶性胶质瘤患者中期生存时间仅有约15个月[3]。肿瘤干细胞概念的提出给肿瘤生物学和治疗方法带来本质的变化,相关文献提示靶向肿瘤干细胞杀伤或者分化可能是对高侵袭性肿瘤最好的治疗策略[4]。
在胶质瘤的发生发展中涉及到多种基因的失调。Livin是凋亡蛋白抑制基因(inhibitor of apoptosis protein,IAP)家族成员,既往研究发现Livin基因过表达与细胞增殖/凋亡、化学治疗耐药关系密切,而且Livin基因在不同细胞系表达量存在差异性[5]。IAP家族的抗凋亡机制主要是阻断Caspase途径激活而引起的细胞凋亡过程,致使细胞凋亡停止,细胞增殖能力增强并延长细胞的存活时间。为进一步研究Livin基因与化学治疗药物干预后细胞增殖/凋亡的关系,课题组利用免疫磁珠分选方法从TJ905细胞系中分离培养出CD133+干细胞,使用慢病毒载体转染技术将细胞凋亡抑制基因Livin转染进胶质瘤TJ905细胞和TJ905干细胞,上调细胞中Livin基因表达量,建立相关细胞模型,给予不同浓度的替莫唑胺 (temozolomide,TMZ)干预,使用反转录PCR(reverse transcription-PCR,RT-PCR)、流式细胞仪、CCK-8等技术检测干预后细胞增殖活性及Livin、Caspase-3/7表达量的变化,探讨TMZ对Livin基因介导的胶质瘤干细胞细胞增殖活性的影响。
材料与方法
一、主要试剂和仪器
试剂:DMEM/F12培养基、胎牛血清(Hyclone,美国),PI试剂盒(四季青公司,中国),表皮生长因子(epidermal growthfactor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、白血病抑制因子(leukemiainhibitory factor,LIF)(Peprotech公司,美国)、胰蛋白酶、B27(Gibco公司,美国),兔抗人CD133抗体、免疫磁珠(CD133+)细胞分选试剂盒(Miltenyi Biotec公司,德国),CCK-8试剂盒(日本同仁化学研究所,日本),Livin基因慢病毒过表达载体(上海吉凯基因有限公司)。
仪器:Multiskan酶标仪(Thermo公司,美国),生物安全柜Ⅱ.A2(力康生物医疗科技控股有限公司),荧光显微OLYMPUS IX71 (奥林巴斯有限公司,日本),流式细胞仪BD LSRⅡ型(Becton Dickinson公司,美国),免疫磁珠分选仪(Miltenyi Biotec公司,德国),实时定量PCR仪Applied Biosystems(7900HT公司,美国)。
二、细胞培养及分选
胶质瘤TJ905细胞由天津神经病学研究所建系并馈赠。
细胞培养:条件均为37℃、5%CO2,TJ905细胞置于含10%胎牛血清的常规DMEM/F12培养基中培养,TJ905干细胞置于含有EGF(20 ng/mL)、bFGF(20 ng/mL)、LIF(10 ng/mL)、B27(1×)的无血清DMEM/F12培养基中培养。
免疫磁珠分选CD133+细胞[6]:TJ905细胞在无血清培养基培养10 d后,利用免疫磁珠分离方法分选、培养CD133+干细胞,成球后用胰蛋白酶消化,5000个/孔接种96孔板,CCK-8检测增殖活性,重复3次。
三、Livin基因过表达细胞模型构建
按照预实验摸索出的感染复数(multiplicity of infection,MOI)值(TJ905细胞:MOI=5;TJ905干细胞:MOI=10)计算需要病毒数量,polybrene作用是增强慢病毒感染力,使用浓度为5 μg/mL,将计算好的慢病毒过表达载体病毒液体直接加入Enhanced Infection Solution(慢病毒稀释液),混均后滴加到算好所需培养基中。在慢病毒过表达载体转染20 h后弃掉培养基,换用新鲜培养基继续培养。慢病毒载体携带绿色荧光蛋白(green fluorescent protein,GFP),转染进细胞内培养72 h后能在荧光显微镜下呈现绿色荧光,RT-PCR检测Livin表达量的变化。细胞分组:TJ905细胞Livin过表达组 (TJ905 ACC-OE组:转染慢病毒Livin过表达载体)、TJ905细胞Livin过表达对照组(TJ905 ACC-CON组:转染慢病毒空载体);TJ905干细胞Livin过表达组(TJ905 CSC-OE组:转染慢病毒Livin过表达载体)、TJ905干细胞Livin过表达对照组(TJ905 CSC-CON组:转染慢病毒空载体)。
四、CCK-8检测细胞增殖及TMZ干预后细胞毒效应
提前24 h在96孔板按105个/孔分别接种TJ905细胞及其干细胞,次日吸掉培养基后每孔添加TMZ浓度分别为0(空白对照)、25、50、100、200、400 μmol/L的TMZ培养基100 μL (空白对照以DMSO代替TMZ),每孔设2个副孔。TMZ干预48 h后弃掉培养基,每孔加100 μL CCK-8溶液(DMEM/F12∶CCK-8为9∶1),37℃温箱孵育90 min,上机检测,检测波长450 nm,参照波长630 nm,每组重复2次。
五、RT-PCR检测Livin及Caspase-3/7基因表达量
分别用上述浓度的TMZ干预TJ905细胞及TJ905干细胞,并在干预48 h后收集细胞,提取总RNA,逆转录-扩增产物使用RT-PCR技术进行定量分析。PRIMER5.0设计Livin、Caspase-3/7引物序列,引物序列信息见表1,在反应过程中每次扩增的同时设无cDNA做阴性对照。获取各组标本的标准曲线结果分析采用荧光定量PCR仪器自带分析软件分析标本的Ct值,待测样品相对值=2-△Ct,△Ct=Ct阴性对照-Ct待测样品。
六、流式细胞仪检测细胞周期
按照实验设计分组,将所得细胞制成单细胞悬液后使用70%乙醇4℃固定过夜,次日PBS漂洗,添加500 μL配制好的PI染色液,37℃孵育30 min,4℃冰盒待检。流式细胞仪采用激发波长488 nm检测红色荧光,同时检测光散射情况,流式细胞仪自带分析软件分析数据。

表1 引物序列
七、统计学分析
应用SPSS19.0软件进行数据处理,符合正态分布的计量资料 (RT-PCR数据)以均数±标准差(Mean±SD)表示,组间比较采用单因素方差分析,组内数据两两比较采用t检验,P<0.05表示差异具有统计学意义。
结果
一、Livin基因转染鉴定
慢病毒载体携带GFP蛋白,转染进细胞内培养72 h后能在荧光显微镜下呈现绿色荧光:普通倒置显微镜下观察TJ905细胞呈正常胶质瘤细胞形态(图1A),TJ905干细胞呈正常胶质瘤干细胞形态(图1B),荧光显微镜下均呈现相应的绿色荧光(图1C~D)。
二、CCK-8检测Livin转染前后及TMZ干预后细胞增殖活性
Livin基因转染后细胞增殖速度变快,而在化学治疗药物TMZ干预后细胞增殖速度减慢,CCK-8检测发现TMZ能明显降低4组胶质瘤细胞的增殖速度,抑制胶质瘤细胞增殖(表2)。
三、RT-PCR检测Livin、Caspase-3/7基因表达量

图1 慢病毒转染前后胶质瘤TJ905细胞及其干细胞显微镜下观察

表2 CCK-8检测TMZ干预各组细胞48 h后细胞增殖活性
(1)TJ905细胞Livin基因表达量[(245.245±4.521)×10-5]高于TJ905干细胞[(23.566±1.231)×10-5],两者比较差异具有统计学意义(t=81.953,P<0.001)。慢病毒载体转染后Livin基因过表达组表达量升高,Caspase-3表达量减低,Caspase-7表达量升高,与慢病毒空载体0 μmol/L对照差异具有统计学意义(P<0.05)。(2)TMZ干预后随着药物干预浓度的增大Livin表达量降低,Caspase-3/7表达量增高,同组细胞药物干预后与0 μmol/L对照,差异具有统计学意义(P<0.05),说明TMZ能有效抑制Livin基因表达,促进Caspase-3/7基因表达,诱导胶质瘤TJ905细胞及其干细胞凋亡。具体信息见表3~5。
四、流式细胞仪检测细胞周期变化
TMZ干预细胞模型48 h后,TJ905 CSC-OE组诱导在S、G2/M停滞,CSC-CON组则是在S期停滞;TJ905 ACC-OE组在S期停滞,对G2/M则是低浓度诱导停滞,随药物浓度增加其诱导作用减弱,ACCCON在G2/M期停滞;TJ905 CSC-OE组与CSC-CON组、TJ905 ACC-OE组与ACC-CON组的上述周期检测对比差异均有统计学意义(P<0.05)。具体信息见表6、图2。
讨论
目前,GBM患者的预后仍极差,即使接受手术切除联合放射治疗和化学治疗的综合治疗方式,患者的5年生存率仅有10%[7]。目前胶质瘤的标准治疗方案即手术切除,辅助以放射治疗和化学治疗,延长患者生存时间。与其他烷化剂比较,TMZ是新型烷化剂、小分子物质,能有效穿过血脑屏障,具有独一无二的特性。多种研究已经证实TMZ是高级别胶质瘤的有效药物,能有效延长GBM患者的生存时间,使GBM患者单独放射治疗的2年生存率10.4%提高到联合治疗的26.5%[8-9]。但无论何种治疗方式均不能有效改善患者预后,提高患者生存质量。越来越多的研究发现,胶质瘤患者经TMZ治疗后很快出现化学治疗耐药,治疗效果变差。基于胶质瘤的治疗现状,本研究采用GBM细胞系TJ905及其干细胞,探讨目前临床一线化学治疗药物TMZ对TJ905细胞及其干细胞的细胞增殖/凋亡的影响,为胶质瘤化学治疗耐药研究提供一定的实验及理论基础。
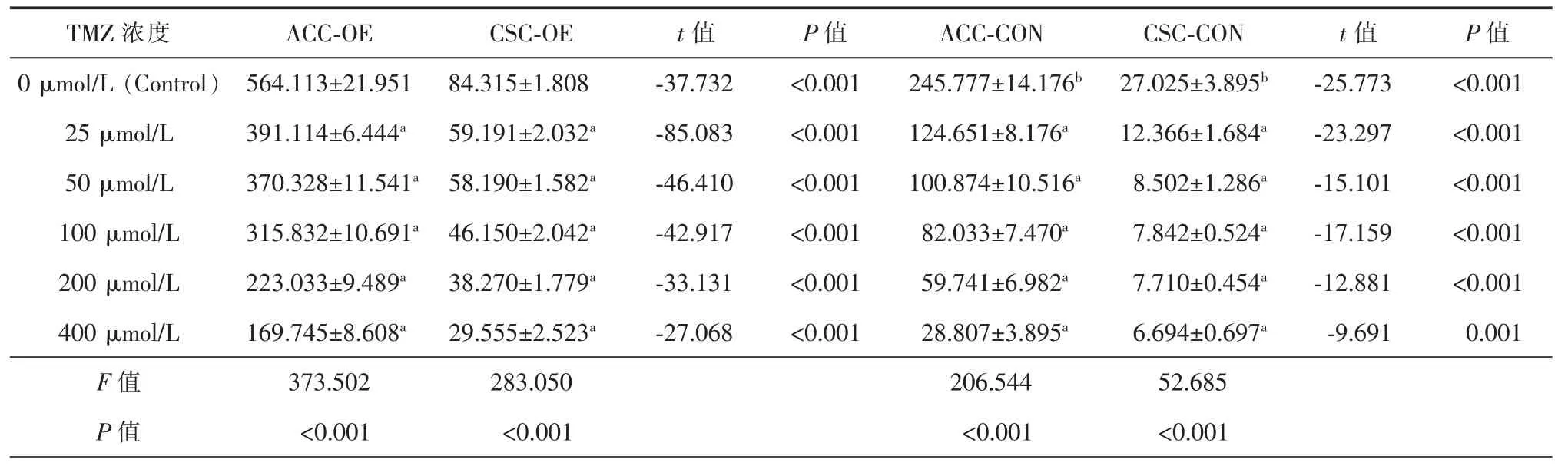
表3 RT-PCR检测TMZ干预各组细胞48 h Livin mRNA表达变化(×10-5)

表4 RT-PCR检测TMZ干预各组细胞48 h Caspase-3 mRNA表达变化(×10-5)

表5 RT-PCR检测TMZ干预各组细胞48 h Caspase-7 mRNA表达变化(×10-5)

表6 流式细胞仪检测TMZ干预48 h细胞周期变化(%)
Livin是IAP家族成员,在细胞凋亡、细胞增殖和控制细胞周期方面起着关键作用[10]。细胞凋亡是Caspase激活的协调效应,Caspase-3/7在细胞凋亡过程中起着细胞凋亡启动、细胞凋亡执行的重要作用,尤其在内源性细胞凋亡途径,细胞色素C从线粒体解除,并与Apaf-1结合,导致Caspase-9重组和凋亡小体形成,Caspase-9激活介导的凋亡小体激活Caspase-3和Caspase-7,其促进细胞死亡,但是激活的Caspase能被内源性抑制剂IAP抑制[11-13]。
肿瘤干细胞存在类似于正常干细胞的细胞休眠静止状态的特性,对放射治疗和化学治疗敏感性差,导致其能在放射治疗和化学治疗后仍能存活一部分,而正是仅存的这部分肿瘤干细胞成为胶质瘤复发的源头[14]。为了解Livin基因对化学治疗药物干预前后细胞增殖/凋亡的影响,本研究构建了Livin基因慢病毒过表达细胞模型,并使用不同药物浓度的TMZ干预,检测药物干预后细胞模型中Livin基因的变化,了解细胞增殖/凋亡的变化,有助于进一步研究Livin基因与细胞增殖/凋亡、化学治疗耐药的关系。

图2 TMZ干预各组细胞48 h细胞周期变化
本研究发现,Livin基因在胶质瘤TJ905细胞表达量显著高于TJ905干细胞,与之前研究胶质瘤U251细胞时结果相反,说明胶质瘤干细胞在分化、增殖过程中可能存在不稳定性[15]。CCK-8检测发现Livin基因表达量的多少可能与细胞增殖速度有关,说明细胞凋亡抑制基因Livin在细胞增殖过程中起着重要作用,但由于大多数干细胞为休眠状态,只有在激活条件下才能分裂、增殖,因此要检测Livin基因表达量的多少与细胞增殖之间的关系,需在同种细胞内完成,单纯检测Livin基因表达量的高低并不能比较普通肿瘤细胞与其干细胞增殖活性强弱。药物干预后,胶质瘤TJ905细胞和TJ905干细胞中Livin基因表达量随着药物浓度增加而降低,Caspase-3/7基因表达增高,再次说明Livin基因与Caspase之间存在密切关系,在胶质瘤的细胞增殖与细胞凋亡过程中具有重要作用。
运用慢病毒转染技术将Livin基因转染进胶质瘤TJ905细胞和TJ905干细胞后,细胞周期发生变化,Livin基因过表达导致胶质瘤干细胞的细胞周期G0/G1增加明显,而TJ905细胞周期则是G2/M期少量增加,研究结果说明Livin基因在胶质瘤TJ905细胞和TJ905干细胞中对细胞周期的影响机制存在差异,也可能是胶质瘤干细胞存在休眠状态,转染后激活干细胞细胞分裂所致。而在TMZ干预后胶质瘤细胞及其干细胞细胞周期停滞在不同的分裂周期,导致细胞增殖减缓。TMZ能明显抑制胶质瘤TJ905细胞和TJ905干细胞的增殖活性,且相同干预条件下,对TJ905细胞的抑制作用明显强于TJ905干细胞,干细胞比普通细胞的表现出有更强的化学治疗药物耐药。
综上所述,本研究发现TMZ能有效抑制TJ905细胞及其干细胞的增殖,由于肿瘤干细胞在分化过程中存在不稳定性,Livin、Caspase基因虽然在细胞抗凋亡过程中起着关键作用,且TMZ可有效地抑制胶质瘤TJ905细胞及TJ905干细胞的增殖,促进细胞凋亡,但考虑细胞凋亡有着不同的细胞凋亡途径,单纯给予TMZ治疗并不能有效彻底地抑制肿瘤增殖。因此,胶质瘤的治疗需要多种治疗方式联合应用。单纯针对干细胞中Livin、Caspase-3/7基因靶向治疗并不能有效解决胶质瘤化学治疗耐药及复发。鉴于细胞实验的局限性,后期将根据本研究结果进一步完善相关动物实验。
