颈内动脉眼动脉段动脉瘤的显微外科手术治疗
2020-12-01王振宇徐如祥胡晓李志立谭海斌张天程美雄刘泠胡俊亭
王振宇 徐如祥 胡晓 李志立 谭海斌 张天 程美雄 刘泠 胡俊亭
颈内动脉眼动脉段动脉瘤(ophthalmic segment artery aneurysms,OSAs)指起源于颈内动脉远环与后交通动脉之间的颈内动脉动脉瘤,由于其位置深、前床突骨质对动脉瘤颈及瘤囊遮挡、与视神经关系紧密,手术夹闭动脉瘤对神经外科医生有一定的难度,是临床治疗关注的重点之一[1]。回顾性分析四川省医学科学院·四川省人民医院神经外科自2010年6月至2020年6月收治的行显微外科手术治疗的23例OSAs患者的临床资料,现报道如下。
资料与方法
一、临床资料
本组23例患者中男性9例,女性14例,年龄(51.2±11.5)岁,年龄范围32~69岁。临床表现:头痛10例,视力下降及视野缺损7例,月经紊乱1例,无症状5例。
术前影像检查包括头部CT、MRI、磁共振血管成像(magnetic resonance angiography,MRA)或CT血管造影术(computed tomography angiography,CTA)、数字减影血管造影(digital subtraction angiography,DSA)、球囊闭塞试验(balloon occlusion test,BOT)了解脑血流代偿情况。23例患者共检出动脉瘤32个,11例为多发动脉瘤,其中双侧动脉瘤6例(4例为双侧OSAs动脉瘤);破裂动脉瘤合并蛛网膜下腔出血5例。23个OSAs直径范围4~30 mm,直径(8.2±2.3)mm,巨大动脉瘤2例。
二、手术步骤及方法
本组患者全部采用全麻翼点入路,完成动脉瘤夹闭。麻醉完成后头架固定。
颈部切口:颈部纵向直切口,从胸锁乳突肌内侧分离显露颈总动脉、颈内动脉、颈外动脉,颈内动脉留置棉线,阻断时提起血管,便于颈内动脉临时阻断夹放置,降低动脉瘤内血流张力,控制出血。
头部偏向对侧略向后仰(开颅后有利于额叶自然下垂,较少额叶牵拉),设计常规翼点入路,骨瓣成型后硬脑膜悬吊,围绕蝶骨嵴额部及颞部暂不悬吊(方便进一步处理局部骨质)。
硬膜外入路:磨除蝶骨嵴骨质,颞部近蝶骨嵴骨质磨除,切开脑膜眶韧带,眶上裂硬膜皱折打开,用锋利的蛛网膜刀或剥离子将覆盖颞叶的硬膜与海绵窦内层分离(两层之间有一个松散的连接),磨除前床突及视神经管上壁,磨除过程中间断磨钻操作,滴水清理磨除的骨质,并降低磨钻产生的热损伤。沿侧裂方向纵行切开硬脑膜(脑压较高时磨除前床突前,可先将侧裂池后部蛛网膜切开释放脑脊液减压),切开颈内动脉末端蛛网膜下腔释放脑脊液减压满意后进一步分离视神经及视交叉池。视神经鞘切开,必要时颈内动脉远侧硬膜环切开,有利于视神经及颈内动脉移位分离显露动脉瘤,挑选合适动脉瘤夹夹闭动脉瘤。
硬膜下入路:弧形切开脑膜后,分离颈内动脉池、视神经及视交叉池。切开前床突硬脑膜,部分磨除前床突,切开视神经鞘及颈内动脉上方脑膜,充分显露动脉瘤及颈内动脉近端(必要时切开颈内动脉远环),分离夹闭动脉瘤。
动脉瘤夹闭:瘤囊周围黏连仔细分离后进行动脉瘤夹闭,动脉瘤张力较高或破裂时颈内动脉近端阻断。至少选用2枚OSAs动脉瘤夹(仅1例1枚)。动脉瘤位于颈内动脉背侧时,硬脑膜远环与动脉瘤黏连部分仔细去除,避免因脑膜覆盖与无脑膜覆盖部分动脉瘤囊厚度差异较大导致动脉瘤夹闭不全。动脉瘤位于颈内动脉腹侧时选用跨血管夹夹闭。同侧多发动脉瘤一期手术夹闭,对侧动脉瘤二期手术。动脉瘤巨大、瘤颈宽大波及海绵窦时夹闭困难,采用载瘤动脉近端阻断或孤立、颈外动脉-大隐静脉(或桡动脉)-大脑中动脉搭桥术。同侧多发动脉瘤术中同时夹闭,对侧动脉瘤二期手术或介入治疗。
三、术中监测
术中电生理检测、荧光造影及术中超声血流检测,评估脑组织缺血损害及血管通畅性、载瘤动脉狭窄、动脉瘤是否完全夹闭。
四、临床观察及随访
术后临床观察视力视野、肢体肌力变化,头部CTA、DSA影像评估动脉瘤夹闭效果。术后3、6、12个月随访,此后每年DSA随访1次。术后3个月采用GOS评分对临床效果进行评价。
结果
一、临床结果
23例患者中有17例采用颈部颈动脉临时阻断,13例患者采用硬膜外入路 (均为未破裂动脉瘤),8例患者采用硬膜下入路(5例破裂动脉瘤),2例患者采用颅内外搭桥手术治疗,其中1例动脉瘤孤立,1例颈内动脉近端阻断。21例患者恢复良好,9例头痛者症状消除,6例视力下降及视野缺损者好转,1例月经紊乱者术后好转,无动眼神经损害病例。23例患者中发生脑挫裂伤2例(均硬膜下入路),1例保守治疗,1例再次开颅手术,发生血管痉挛、偏瘫,治疗后肢体肌力部分恢复(Ⅲ~Ⅳ级)。
二、随访结果
随访3~63个月,平均21.3个月。2例(8.7%)OSA患者复发,其中1例为用1枚动脉瘤夹夹闭病例,均再次入院介入治疗。2例颅内外搭桥患者桥血管通畅,动脉瘤消失。3例患者并发脑积水,其中1例行脑室腹腔分流,1例行腰池腹腔分流,1例临床观察随访。随访3个月GOS评分:5分20例,4分2例,3分1例,无死亡病例。
三、典型病例
典型病例1:52岁,女性,左眼视力下降。影像学检查及结果提示左侧破裂OSAs,合并左侧大脑中动脉瘤、右侧大脑中动脉瘤。经硬膜下入路手术夹闭左侧OSAs及左侧大脑中动脉微小动脉瘤,右侧大脑中动脉瘤二期手术夹闭(图1A~H)。2次手术均无并发症发生,视力恢复。
典型病例2:53岁,女性,无视力损害。DSA检查提示右侧未破裂OSAs。经硬膜外入路手术夹闭OSAs(图1I~L)。术后恢复良好,无视力损害等并发症出现。
典型病例3:52岁,女性,右眼视力损害(0.1)。影像学检查提示右侧眼动脉段巨大动脉瘤,瘤颈宽大,波及海绵窦,瘤囊上有小的子囊。右侧巨大OSAs。右侧颈内动脉-大隐静脉-大脑中动脉搭桥,右侧颈内动脉结扎(图2)。术后右眼视力好转,无脑缺血损害发生。
讨论
OSAs占颅内动脉瘤的5%,起源于颈内动脉远环与后交通动脉之间的颈内动脉动脉,动脉瘤的周围解剖结构复杂,手术操作空间狭小,手术直接夹闭瘤颈难度大,实现动脉瘤的满意夹闭对神经外科医生仍然是一项技术挑战[2-3]。
一、OSAs的解剖特点
OSAs毗邻前床突、视神经、颈内动脉外环,与眼动脉关系密切。OSAs可发生于颈内动脉背侧,可推挤眼动脉或与之黏连;发自颈内动脉腹侧的OSAs,周围无分支动脉;发自颈内动脉内侧面的OSAs,位于鞍膈上,与垂体上动脉及垂体柄有关系[4]。无论哪一种情况,手术入路及OSAs分离、显露都可能会对眼动脉造成影响。眼动脉是一个末梢动脉,起源于远端硬脑膜环上方的颈内动脉,向下延伸至视神经的颅内段,从近端到远端可分为3段:硬膜内段、视神经管段和眶内段。当眼动脉进入视神经管时,其附着在视神经的硬脑膜鞘上,并沿着其下外侧方向延伸。虽然颈外动脉与眼动脉之间存在广泛的吻合,如面动脉角支与鼻背支、脑膜中动脉与泪支、眶下支与肌支等,多数情况下,这种侧支循环可以保证视网膜有足够的血液供应,但有时眼动脉缺血可导致视网膜中央动脉闭塞。最近的一项研究发现视网膜梗死发生在视网膜中央动脉闭塞15~19 min后,视网膜中央动脉闭塞或长时间缺血可导致3%~38%的OSAs患者出现不可逆的视力损害[5]。
二、治疗方式的选择
OSAs的解剖特点结合动脉瘤形态、位置、大小、破裂与否、是否为血栓性动脉瘤,是决定动脉瘤治疗方式的关键因素,术前依据影像资料进行详细的评估是非常重要的。术前MRI及MRA可初步评估动脉瘤的位置、是否合并颅内缺血、动脉瘤囊内血栓机化程度;DSA可准确测量动脉瘤的大小、位置、瘤囊方向、瘤囊上是否有分支血管发出,评估侧支代偿;BOT可帮助了解闭塞颈内动脉后脑缺血耐受;CT检查可明确动脉瘤破裂与否、脑室扩张程度;CTA颅底骨显像可帮助了解动脉瘤与前床突的关系,冠状位可清楚显示指向上方的瘤囊,评估动脉瘤与颈内动脉远环的关系(视柱是硬膜远环的可靠标志),了解动脉瘤位于硬膜内还是硬膜外[6]。
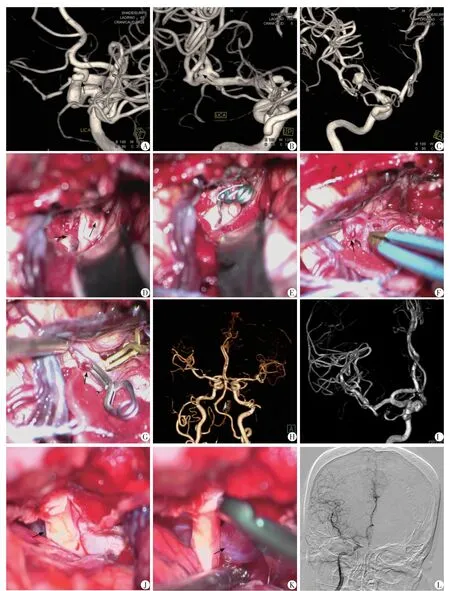
图1 典型病例1和2分别经硬膜下、硬膜外入路手术夹闭动脉瘤的影像学资料
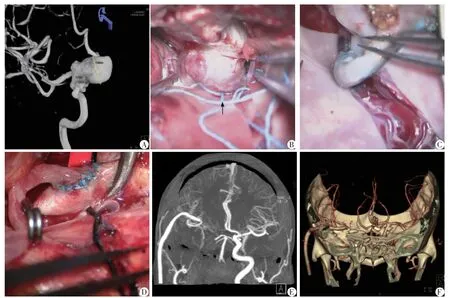
图2 典型病例3行右侧颈内动脉-大隐静脉-大脑中动脉搭桥并颈内动脉结扎的影像学资料
目前关于OSAs治疗方式的选择存在争议:(1)对于未破裂动脉瘤及微小动脉瘤,选择观察或者治疗干预。国际性研究显示颅内未破裂动脉瘤认为不超过7 mm的前循环动脉瘤破裂几率远远小于1%[7]。通过临床手术观察,笔者认为瘤囊是否有血管流出道可作为微小动脉瘤手术指征选择的重要参考。临床术中通过对微小动脉瘤的观察发现,虽然动脉瘤体积较小,但囊壁可能非常薄弱,甚至可以看到瘤囊内血流涡流,这种情况下患者是非常危险的,发生破裂的风险极高。这类微小动脉瘤瘤囊上无血管发出,无法缓解瘤囊壁上血流的压力,应该积极治疗。(2)手术方式选择介入或者手术夹闭:介入治疗无需开颅、创伤小,尤其是近年来血流导向装置的应用,介入治疗的优势不断扩大[8-9]。OSAs显微手术夹闭,术者需要熟悉诸多技术:OSAs的颅底解剖,磨钻前床突骨质磨除,磨除过程中神经血管损伤的风险,海绵窦出血的控制,动脉瘤出血的控制,动脉瘤的夹闭技术,神经外科显微操作技术及颅内外搭桥技术。网络技术交流使神经外科医生拥有更多的手术技巧交流学习机会,手术技术及要点为更多神经外科医生所熟悉,OSAs手术技术不断提高,手术相关的并发症显著降低[10]。Kamide等[11]报道OSAs手术直接夹闭动脉瘤,动脉瘤闭塞率可达到98%,术后动脉瘤复发概率低,预后良好率达96.2%。本组资料中的OSAs大部分为未破裂动脉瘤,手术效果良好,临床症状改善满意。OSAs破裂在临床中也时有发现,手术中动脉瘤瘤囊减压、动脉瘤塌陷,占位效应解除,患者神经压迫迅速解除;对于蛛网膜下腔出血较多的患者,术中可大量清除颅内及蛛网膜下腔甚至脑室中积血,降低颅内压和脑血管痉挛发生率,促进神经功能的尽快恢复;术前及术后患者不用抗血小板聚集药物治疗,即使需要后续外科干预,患者凝血功能对手术不产生影响,脑脊液外引流或分流等二次手术不会增加出血的风险。
任何一种治疗方式都不能满意地处理所有的动脉瘤,手术方式的选择应综合患者体质、年龄、治疗意愿和临床技术条件等方面考虑,慎重选择。
三、手术入路的选择及动脉瘤处理
OSAs手术入路分为硬膜外入路和硬膜下入路。硬膜外入路采用Dolenc入路方法,从硬膜外磨除前床突[12]。笔者认为,硬膜外前床突的处理优势明显:(1)可较充分处理前床突骨质,去除视柱影响,显露动脉瘤远环与近环之间的颈内动脉,便于术中阻断;(2)动脉瘤近端颈内动脉的显露更充分;(3)不增加脑挫裂伤的风险,脑压较高时,侧裂后部脑膜切开蛛网膜下腔小切口释放脑脊液,颅内压逐渐下降,有助于硬膜外操作进行。磨钻操作时,注意间断操作,生理盐水清洁手术视野,减少神经及血管的热损害。硬膜外入路中蝶窦或筛窦开放用筋膜胶水封闭,防止脑脊液漏发生。颈部颈内动脉术前显露有助于防止操作过程中动脉瘤破裂出血的控制。硬膜下入路多适用于破裂OSAs的夹闭,从硬膜下磨除前床突,根据动脉瘤夹闭的具体需求部分磨除,较硬膜外入路操作时间短、出血少、更为便捷,动脉瘤破裂时可尽快应对[13]。本研究中13例患者采用硬膜外入路,另8例患者采用硬膜下入路,其中有2例发生脑挫裂伤。硬膜下入路并发症的发生可能与SAH后脑组织水肿压力较高有关,硬膜外入路病例均为未破裂动脉瘤,硬膜外入路可能更适用于未破裂OSAs的处理。
无论硬膜外入路还是硬膜下入路,动脉瘤的处理是手术的最终目标。动脉瘤夹闭前,瘤囊周围蛛网膜黏连要细致分离,仔细观察动脉瘤颈的范围。对于视神经下方内侧型动脉瘤,视神经鞘膜切开要充分,必要时颈内动脉远侧硬膜环打开,视神经、颈内动脉移位后可实现动脉瘤的满意显露[14]。若动脉瘤囊复杂、体积大,夹闭前可颈内(或颈部)动脉临时阻断(是否采用颈部切口依据术前影像结合术者对动脉瘤出血控制进行评估),减低瘤囊内压力,便于解剖分离夹闭。有研究从对侧处理OSAs,认为可无需牵拉视神经实现动脉瘤的夹闭,但有增加视神经微血管损伤风险,并且动脉瘤破裂出血控制困难,应慎重选择[15]。本研究中6例双侧动脉瘤患者均安排再次治疗,未采用上述方式处理。动脉瘤夹的选择、放置应尽可能减少对神经的推挤,若动脉瘤囊巨大则需用串联动脉瘤夹夹闭技术。由于OSAs起源于颈内动脉,血流压力高,存在动脉瘤颈增厚、动脉瘤囊硬膜黏连无法分离等情况,动脉瘤夹的使用建议不少于2枚,预防近端高压力血流推挤造成动脉瘤夹移位、动脉瘤残留甚至再出血。本研究中1例患者用1枚动脉瘤夹导致术后动脉瘤夹滑动动脉瘤残留。若动脉瘤较大,瘤颈增厚,瘤囊中有血栓及机化内容物,动脉瘤夹闭后将导致颈内动脉狭窄、扭曲,可预防性采用颞浅动脉-大脑中动脉搭桥,防止术后脑缺血的发生。本研究中2例巨大、瘤颈宽大波及海绵窦OSAs患者的瘤囊夹闭困难,采用载瘤动脉近端阻断(1例)或孤立(1例)、颅内外血管搭桥技术。
四、术中监测
术中电生理检测、荧光造影及术中超声血流检测已成为神经外科脑血管手术的常用辅助手段,可评估脑组织缺血损害及血管通畅性、载瘤动脉狭窄、动脉瘤是否完全夹闭。
综上所述,熟悉前床突局部解剖、磨钻颅底骨质磨除操作技术、动脉瘤夹选择及夹闭技巧、熟练的显微神经外科操作技术是OSAs手术治疗安全及取得最佳疗效的关键。本研究不足之处在于研究样本量有限,仍需更多积累总结。
