芪丹颗粒对2型糖尿病患者胰岛素抵抗及血清CTRP6和CTRP12水平的影响
2020-11-30熊思明叶仁群
熊思明, 叶仁群
(1. 广州中医药大学附属宝安中医院,广东深圳 518133;2. 广州中医药大学研究生院,广东广州 510405)
作为世界性公共卫生疾病,糖尿病对人体健康的危害不言而喻。由超重和肥胖逐渐演变为糖尿病,胰岛素抵抗在其中发挥了不容忽视的影响。现代医学普遍认为肥胖诱导的脂肪组织巨噬细胞浸润的慢性低度炎症及代谢性炎症综合征与胰岛素抵抗的发生发展存在着因果关系[1-3]。而Kwon H等[4]研究发现,在脂肪组织中脂肪细胞分泌的大量脂肪因子可作用于机体炎症反应环节并影响胰岛素抵抗的发生发展,如以脂联素、血清分泌型卷曲相关蛋白5、神经调节蛋白4 等为代表的抗炎脂肪因子及以瘦素、抵抗素、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等为代表的促炎脂肪因子,分别在机体内发挥着抑制/促进炎症刺激、提高/降低胰岛素敏感性、改善/诱导或加重胰岛素抵抗、抵抗/增进肥胖发生的作用。聚焦于炎症学说,脂肪组织的慢性低度炎症的解决可能是治疗胰岛素抵抗及肥胖引起的代谢功能障碍的一种方法。
CTRP6和CTRP12属于新近发现的与脂联素具有结构同源性的脂肪因子超家族补体C1q/肿瘤坏死因子相关蛋白(complement- C1q/TNF- related protein,CTRP)家族。研究[5-7]发现,CTRP6具有促进脂质沉积和肥胖发生、拮抗胰岛素信号等作用,而CTRP12则低表达于肥胖和糖尿病患者,具有降低血糖、抗炎、促进脂肪细胞摄取葡萄糖、抵抗肥胖、胰岛素增敏等作用。本课题组的前期研究证实了芪丹颗粒可通过影响脂联素、抵抗素等抗炎/促炎脂肪因子的水平来改善2 型糖尿病患者的胰岛素抵抗[8]。结合前期研究结果,本研究旨在进一步探讨芪丹颗粒对2型糖尿病脾虚痰瘀证患者胰岛素抵抗及新型脂肪因子CTRP6和CTRP12的影响,并探讨胰岛素抵抗与CTRP6及CTRP12的关系,现将研究结果报道如下。
1 对象与方法
1. 1研究对象及分组选取2019年1月至2019年12 月于深圳市宝安区中医院内分泌科门诊及住院部接受治疗的符合纳入标准并签署知情同意书的2 型糖尿病脾虚痰瘀证患者,共60 例,其中男33 例,女27 例;年龄30 ~60 岁,平均(50.77 ±6.98)岁;病程1.8 ~15.9 年,平均(6.92 ± 3.64)年。按患者就诊先后顺序,采用随机数表将患者随机分为治疗组和对照组,每组各30例。
1. 2诊断标准西医诊断标准:参考1999年世界卫生组织(WHO)发布的2型糖尿病诊断标准[9]。中医诊断标准:参考中华中医药学会《糖尿病中医防治指南》[10]关于消渴病的中医诊断标准,并根据《中药新药临床研究指导原则(试行)》[11]及《糖尿病中医诊疗标准》[12]拟定脾虚痰瘀证的辨证标准:嗜食肥甘厚味,形体肥胖,头身困重,胸闷脘胀,肢体麻木,恶心口黏,神倦懒言,气短乏力,口干不欲饮,舌质淡暗,苔白厚腻,有瘀点瘀斑,脉沉滑或沉涩。
1. 3纳入标准①符合上述中西医诊断标准;②中医证型为脾虚痰瘀证;③年龄介于30~60 岁之间;④自愿参加本研究并签署知情同意书的患者。
1. 4排除标准①非2 型糖尿病患者;②糖尿病急性并发症发病1个月内,或伴有严重的糖尿病慢性并发症患者;③合并有严重感染或其他系统严重原发性疾病患者;④精神病患者;⑤过敏体质或对本研究所用药物过敏的患者;⑥妊娠期及哺乳期妇女;⑦依从性差,未按规定进行治疗,或自行加用其他有治疗作用的药物,从而影响疗效判定的患者。
1. 5治疗方法所有患者均给予糖尿病基础治疗,包括糖尿病饮食、运动锻炼和限烟戒酒等健康知识教育。在此基础上,对照组给予口服盐酸二甲双胍片(商品名:格华止,中美上海施贵宝制药有限公司,批准文号:国药准字H200223370)治疗,每天2次,每次0.5 g,饭后口服;治疗组给予口服芪丹颗粒(以黄芪、丹参、三七、山楂等4 味中药组方而成,由深圳市宝安区中医院制剂室制备,剂型、规格及制作方法参考文献[8])治疗,每次1 袋,每天2 次,于早晚饭前用200 mL 开水冲服。连续治疗8周后评价疗效。
1. 6观察指标2 组患者治疗前后以下指标各检测1 次。①胰岛素抵抗指数(HOMA-IR)评估:HOMA-IR=空腹血糖(FPG)×空腹胰岛素(FINS)/22.5;②血清CTRP6、CTRP12 水平测定:采用双抗体夹心酶联免疫吸附测定法(ELISA)测定,试剂盒由上海江莱生物科技有限公司生产(编号:JLMB12692、JLMB13388)。
1. 7安全性评价2 组患者治疗前后均检测基本生命体征(包括体温、呼吸、心率、脉搏、血压等)以及血常规、尿常规、大便常规、肝功能、肾功能和心电图等;研究过程中如出现不良反应,应详细记录其不良反应情况及相应的处理措施。
1. 8统计方法采用SPSS 21.0统计软件进行数据的统计分析。计量资料用均数± 标准差(x±s)表示,组内治疗前后比较采用配对样本t检验,组间比较采用两独立样本t检验;计数资料用率或构成比表示, 组间比较采用χ2检验; HOMA- IR、CTRP6、CTRP12之间分别进行Pearson相关及多元线性逐步回归分析。以P<0.05为差异有统计学意义。
2 结果
2. 1 2组2型糖尿病患者基线资料比较治疗组30例患者中,男17例,女13例;年龄32 ~60岁,平均年龄(51.59 ± 6.68)岁;病程2.3 ~14.6 年,平均病程(6.73 ± 3.32)年。对照组30 例患者中,男16 例,女14 例;年龄30 ~59 岁,平均年龄(49.93± 7.38)岁;病程1.8 ~15.9 年,平均病程(7.07 ±4.02)年。2组患者的性别、年龄、病程等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。
2. 2 2组2型糖尿病患者治疗前后HOMA-IR比较表1 结果显示: 治疗前, 2 组患者的HOMA-IR 比较,差异无统计学意义(P>0.05)。治疗后,2组患者的HOMA-IR 均较治疗前明显下降(P<0.05),且治疗组对HOMA-IR 的下降作用明显优于对照组,差异有统计学意义(P<0.05)。
表1 2组2型糖尿病患者治疗前后HOMA-IR比较Table 1 Comparison of HOMA-IR in type 2 diabetic patients of the two groups before and after treatment ( ± s)

表1 2组2型糖尿病患者治疗前后HOMA-IR比较Table 1 Comparison of HOMA-IR in type 2 diabetic patients of the two groups before and after treatment ( ± s)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
组别治疗组对照组N/例30 30治疗前6.08 ± 1.15 6.31 ± 1.05治疗后3.57 ± 0.86①②4.24 ± 0.73①
2. 3 2组2型糖尿病患者治疗前后血清CTRP6、CTRP12水平比较表2结果显示:治疗前,2组患者血清CTRP6、CTRP12 水平比较,差异均无统计学意义(P>0.05)。 治疗后, 治疗组患者血清CTRP6 水平较治疗前明显下降(P<0.05),血清CTRP12水平较治疗前明显升高(P<0.05);而对照组治疗前后血清CTRP6和CTRP12水平均无显著性变化,差异均无统计学意义(P>0.05)。组间比较,治疗组对血清CTRP6 水平的下降作用和对血清CTRP12水平的升高作用均明显优于对照组,差异均有统计学意义(P<0.05)。
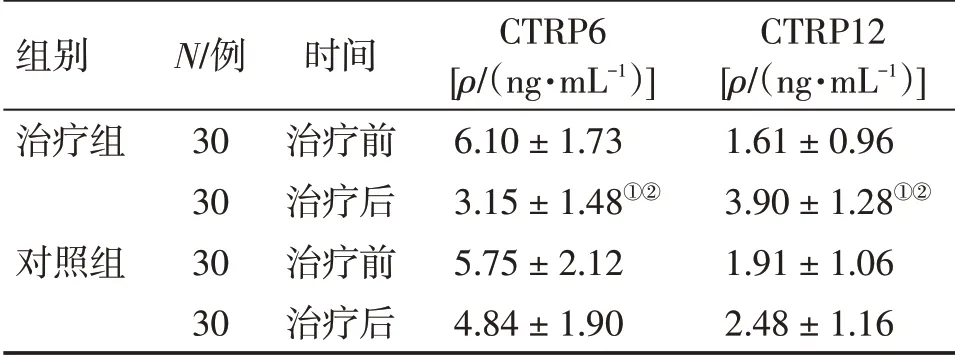
表2 2组2型糖尿病患者治疗前后血清CTRP6、CTRP12水平比较Table 2 Comparison of serum CTRP6 and CTRP12levels in type 2 diabetic patients of the two groups before and after treatment (x ± s)
2. 4 HOMA-IR与血清CTRP6、CTRP12水平的Pearson相关性分析经HOMA-IR 的Pearson 相关性分析发现,HOMA-IR与血清CTRP6水平呈正相关(r= 0.746,R2= 0.557,P<0.01), 与 血 清CTRP12水平呈负相关(r= -0.802,R2= 0.644,P<0.01)。结果见表3和图1。

表3 HOMA-IR与血清CTRP6、CTRP12水平的Pearson相关性分析Table 3 Pearson correlation analysis of HOMA-IR with serum CTRP6 and CTRP12 level in type 2 diabetic patients of the two groups
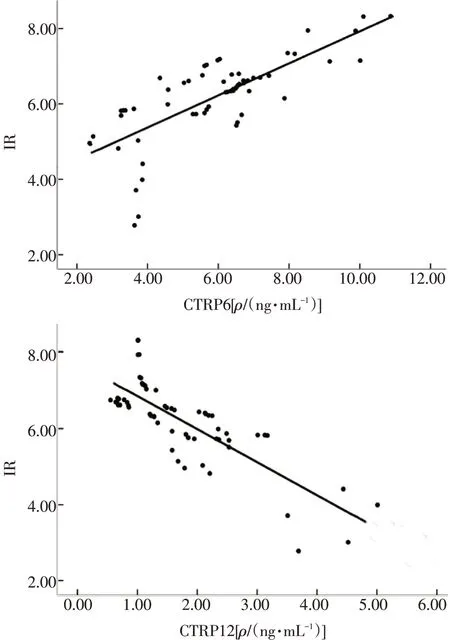
图1 HOMA-IR 与血清CTRP6和CTRP12的Pearson相关性分析Figure 1 Pearson correlation analysis of HOMA-IR with serum CTRP6 and CTRP12 level in type 2 diabetic patients of the two groups
2. 5血清CTRP6与CTRP12水平的Pearson相关性分析经CTRP6 的Pearson 相关性分析发现,血清CTRP6 与CTRP12 水平呈负相关(r= -0.577,R2=0.333,P<0.01),结果见图2。

图2 血清CTRP6与CTRP12的Pearson相关性分析Figure 2 Pearson correlation analysis of serum CTRP6 with serum CTRP12 level in type 2 diabetic patients of the two groups
2. 6 HOMA-IR的多元线性逐步回归分析为明确HOMA-IR 的独立相关因素,本研究进一步以HOMA-IR 为因变量,以年龄、性别、病程、血清CTRP6、CTRP12 水平为自变量,进行多元线性逐步回归分析。 结果(表4)显示, 血清CTRP6、CTRP12 水平是HOMA-IR 的独立影响因子(P<0.01)。
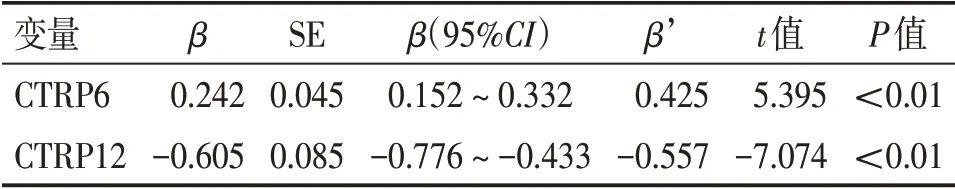
表4 HOMA-IR的多元线性逐步回归分析Table 4 Multiple stepwise regression analysis of HOMA-IR with serum CTRP6 and CTRP12 level in type 2 diabetic patients of the two groups
2. 7 2组患者不良反应情况研究过程中,2组患者的基本生命体征,血、尿、大便常规,肝、肾功能及心电图等安全性指标均无异常改变。治疗结束后2 周,对2 组患者进行药物不良反应追踪,2组均未发现与本次试验药物相关的不良反应。
3 讨论
作为2型糖尿病的病理生理特征,胰岛素抵抗的发病机制复杂,涉及脂质超载和炎症反应两大方面,涵盖了整个胰岛素信号转导通路。越来越多的研究证实,脂肪组织分泌的脂肪因子参与了机体糖脂代谢、炎症反应调节等生理和病理过程并通过其分泌失衡干扰胰岛素信号转导通路,影响机体胰岛素抵抗、肥胖相关性疾病的发生发展趋势。目前,现代医学通过大量体外细胞、动物实验及临床研究认可了脂联素等抗炎脂肪因子以及瘦素、抵抗素、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等促炎脂肪因子在胰岛素抵抗、肥胖病、2型糖尿病、非酒精性脂肪性肝病、代谢综合征等内分泌代谢性疾病发病机制中发挥的作用[13]。作为新型脂肪因子,CTPRs与脂联素具有结构同源性,其多个家族成员被证实具有抗糖尿病、胰岛素增敏作用[5]。结合其生理病理作用及影响糖脂代谢、炎症调节等相关机制研究,推测CTPRs可能为治疗胰岛素抵抗、肥胖相关性疾病的潜在新途径。
作为CTRPs 中相对独特的一个成员,CTRP6具有促进脂质沉积和肥胖发生、拮抗胰岛素信号等作用,在糖脂代谢过程、炎症调节、胰岛素抵抗和肥胖的发生发展中扮演着重要的角色[6]。Lei X等[14]在体外动物细胞实验中,通过模拟糖尿病状态建立的3T3-L1脂肪细胞模型,证实CTRP6高表达于糖尿病状态小鼠体内,而CTRP6 高表达的非糖尿病状态小鼠体内的胰岛素释放则减少;同时CTRP6 还可通过自分泌方式刺激靶向巨噬细胞的极化过程,进而剂量依赖性地上调促炎细胞因子(如TNF-α)的表达来调节局部炎症,并通过旁分泌方式作用于脂肪细胞,进而减少胰岛素刺激的Akt磷酸化以拮抗胰岛素信号转导来调节葡萄糖代谢。上述两种方式均促进并加剧了脂肪细胞内的慢性低度炎症状态,导致脂肪细胞胰岛素敏感性降低,逐步介导胰岛素抵抗产生。同时研究还表明CTRP6 可直接影响小鼠的胰岛素敏感性,相反,CTRP6 的缺乏则降低了脂肪组织中的循环炎性细胞因子和促炎性巨噬细胞水平,并增强了脂肪组织中胰岛素刺激的Akt活化[14]。Wang M等[15]通过对比健康人、糖耐量受损(IGT)患者及2 型糖尿病患者的相关糖脂代谢指标及部分脂肪因子水平,发现2 型糖尿病患者血清CTRP6 水平最高,IGT 患者次之,健康人最低;同时发现机体血清CTRP6 水平与血糖血脂相关指标、胰岛素水平、肥胖相关指标和相关炎症因子水平呈正相关,且在糖耐量试验(OGTT)中血清CTRP6水平变化与血糖、胰岛素和TNF-α的水平变化趋势一致。
相反,同为CTRPs 中的一员,拥有与脂联素20%结构同源性的CTRP12 则具有降低血糖、抗炎、促进脂肪细胞摄取葡萄糖、抵抗肥胖、胰岛素增敏等作用,且其分泌受制于胰岛素的调节[7]。Wei Z 等[16]通过体外动物实验证实CTRP12 可以通过两种方式来改善胰岛素抵抗:一是通过胰岛素依赖性方式,直接增强肝脏和脂肪组织的胰岛素敏感性来改善胰岛素抵抗;二是通过胰岛素非依赖性方式,直接激活胰岛素信号转导通路的经典途径PI3K-Akt 信号通路,降低肝脏细胞G-6-Pase和PEPCK 的表达来抑制肝糖异生并促进脂肪细胞摄取葡萄糖,增强肝脏和脂肪组织中的胰岛素信号以达到改善胰岛素抵抗的目的。 Enomoto T等[17-18]先后通过体外动物细胞实验发现CTRP12 可剂量依赖性地抑制巨噬细胞中促炎性介质(如TNF-α、IL-1β 和MCP-1)的基因表达,减轻脂肪组织中的炎症刺激,提示CTRP12 具有抗炎作用;而暴露于促炎环境和内质网应激下的3T3-L1 脂肪细胞则会下调CTRP12表达,提示在脂肪组织功能障碍的病理条件下CTRP12水平会下降;此外,使用特异性c-Jun 氨基末端激酶(JNK)抑制剂处理培养的3T3-L1 脂肪细胞则发现,JNK 抑制剂可以阻断TNF-α对脂肪组织表达CTRP12的抑制作用,表明TNF-α可通过刺激活化JNK途径来抑制CTRP12表达。还有Tan B K 等[19-21]先后通过临床试验及体外细胞培养实验发现,在健康人中高胰岛素血症可诱导CTRP12分泌和表达,而服用二甲双胍治疗的多囊卵巢综合征(PCOS)患者血清CTRP12 水平较服用前上升,且罗格列酮可以显著增加脂肪组织中CTRP12的分泌和表达。
基于胰岛素抵抗是2 型糖尿病的病理生理特征,二者均可归属于祖国医学 “消渴”“消瘅”“肥胖” 等疾病范畴。段军等[22]认为 “郁、热、虚、损” 是消渴发病的病机关键,正如《素问·奇病论》云:“此肥美之所发也,此人必数食甘美而多肥也,肥者令人内热,甘者令人中满,故其气上溢,转为消渴。” 饮食不节,积滞中焦,久则化热内聚,蒸灼津液,炼津为痰;脾胃受损,运化失职,气机升降失常,血行不畅,则气滞血瘀;痰浊血瘀互结,日久机体逐渐形成脾虚为主导、痰瘀互结为辅的局面,主辅联动,共同催化胰岛素抵抗的产生。其中,痰瘀互结是2型糖尿病胰岛素抵抗产生的关键因素[23]。当前大量中药药理研究发现多种单味中药具有降血糖、抗炎、胰岛素增敏、改善胰岛素抵抗的作用[24],如黄芪多糖可降低2型糖尿病大鼠血糖水平,增加组织对胰岛素的敏感性,改善胰岛素受体和受体后环节信号转导[25];钟振东等[26]的动物实验证实三七总皂苷通过提高KK-Ay 鼠对胰岛素和瘦素的敏感性,发挥抗高血糖、抗肥胖作用;蔡双朋等[27]研究发现,丹参酮Ⅰ可通过抑制PTP1B 的表达来促进P-AKT/AKT 信号通路活化,进而改善胰岛素抵抗HepG2 细胞;吴淑艳等[28]通过建立高脂饮食诱导的胰岛素抵抗大鼠模型,发现山楂中的熊果酸可以降低胰岛素抵抗指数(HOMA-IR),升高胰岛素敏感指数。针对上述病因病机,结合现代中药药理研究,本课题组采用以黄芪、丹参、三七、山楂等4味中药组方而成的芪丹颗粒来治疗脾虚痰瘀型2型糖尿病,意在发挥其组方中药的健脾化痰、袪瘀通络之功效来改善2型糖尿病患者的胰岛素抵抗。
本研究结果表明,芪丹颗粒可明显降低2型糖尿病患者HOMA-IR及血清CTRP6水平,上调血清CTRP12水平,与对照组比较,差异均有统计学意义(P<0.05);进一步通过Pearson相关性分析发现2 型糖尿病患者HOMA-IR 与血清CTRP6 水平呈正相关,而与血清CTRP12 水平呈负相关,血清CTRP6 水平与血清CTRP12 水平成负相关,这与Wang M 等[15]的研究结论一致;同时经多元线性逐步回归分析发现,血清CTRP6 和CTRP12 水平是HOMA- IR 的独立影响因素。 综上, CTRP6 和CTRP12共同参与机体糖脂代谢过程,研究结果提示二者可能通过自身血清水平变化,一方面减轻脂肪组织存在的炎症刺激,另一方面活化PI3KAkt胰岛素信号转导通路来增加胰岛素敏感性,共同达到减轻2型糖尿病胰岛素抵抗的目的。本研究结果与本课题组前期研究中芪丹颗粒可能作用于脂肪-胰岛内分泌轴,通过调节与胰岛素抵抗发生发展相关的脂肪因子的合成及分泌来改善胰岛素抵抗的结论相呼应[8]。
