上肢人工血管内瘘术后并发血清肿一例
2020-11-30徐明芝陈汝满白亚飞陈集敏李洪
徐明芝 陈汝满 白亚飞 陈集敏 李洪
570311 海口,海南省人民医院
病例资料
患者,男,36岁,主因“维持性血液透析13年,右上肢内瘘吻合口处包块10 d”入院,患者13年前左腕部建立自体动静脉内瘘开始维持血液透析。7年前因左腕部自体动静脉内瘘闭塞改行右前臂中段自体动静脉内瘘。4年前因右前臂中段自体动静脉内瘘闭塞改行左上肢人工血管动静脉内瘘。2个月前左上肢人工血管内瘘闭塞,以不带cuff导管过渡,2020年2月10日行右肱动脉、右贵要静脉人工血管(内环延展性4-6,美国戈尔)动静脉内瘘成形术(u型)。术后有2周的人工血管全程肿胀并逐渐消退。术后3周内瘘吻合口处无明显诱因出现无痛性、无搏动性包块,伴同侧肢体末梢麻木入院(动静脉内瘘尚未使用)。 既往有吉兰-巴雷综合征病史,3个月前开始口服泼尼松,目前30 mg/次、1次/d。体格检查:人工血管内瘘全程杂音震颤良好;吻合口处可见大小约3 cm×4 cm包块(图1)。局部皮肤无红肿、疼痛、破溃,触诊无搏动。入院后查血生化示:总蛋白68.4 g/L,白蛋白38.1 g/L,C反应蛋白6.01 mg/L。血常规:白细胞计数 10.2×109/L,中性粒细胞百分比69.3%,血红蛋白78 g/L,血小板计数176×109/L。DIC全套:凝血酶原时间13.3 s,D-二聚体11.51 μg/mL。降钙素原:1.69 ng/mL。包块的彩色多普勒超声结果显示,右侧肘部上方包块隆起处皮下组织,以囊性为主包块(大小43 mm×29 mm×41 mm,内见低弱片状回声及低弱条状光带回声),包块周边软组织水肿增厚(图2)。考虑人工血管吻合口处血清肿可能性大,给予彩色多普勒超声引导下诊断性穿刺抽出淡黄色透亮液体(图3)。黏稠性大,抽出困难,只抽出约2 mL清亮液体,加压包扎2 d后仍未改善,并同侧肢体末梢麻木加重,伴轻微疼痛感,分离包块并切除,包块内挤出无色透亮液体。可见黄白色囊壁(图4)。血清肿有多个囊壁,主要位于动脉吻合口附近。包块囊壁病理检查可见囊壁内大量薄壁小血管增生,伴小血管充血及周围组织出血,散在少量淋巴细胞及单核细胞浸润,伴少许增生的纤维结缔组织。免疫组化:平滑肌肌动蛋白SMA(+),血管内皮标记CD31(血管+),内皮细胞标记CD34(血管+),肌动蛋白Action(HHF35)(+),Ⅳ型胶原collagen Ⅳ(+),结蛋白Desmin(-)。特殊染色:Masson(胶原纤维+),网织纤维染色(+)(图5)。
血清肿切除术后2周再次逐渐出现吻合口处肿块,1个月后再次就诊我院。臂丛麻醉下再次行血清肿切除,并分离出动静脉吻合口,动脉吻合口有长约2 cm的 人工血管裸露,静脉吻合口有长约0.5 cm的人工血管裸露(图6)。凝血酶冻干粉(2 000 U/支,长春雷允上药业)涂于裸露的人工血管,动脉端共用4 000 U,静脉端共用2 000 U。然后应用可吸收止血沙(速即纱再生氧化纤维素,美国Ethicon LLC)包绕于裸露的人工血管上,动脉端共用1片半,静脉端共用半片(图7)。包绕处给予压迫20 min。术后至今4个月余未再复发。
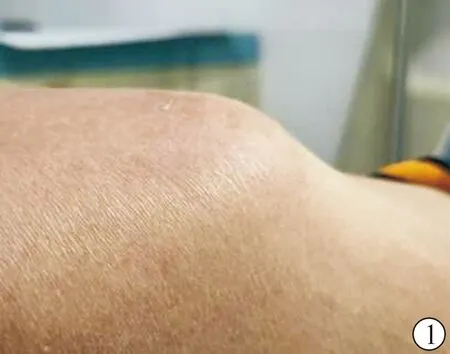
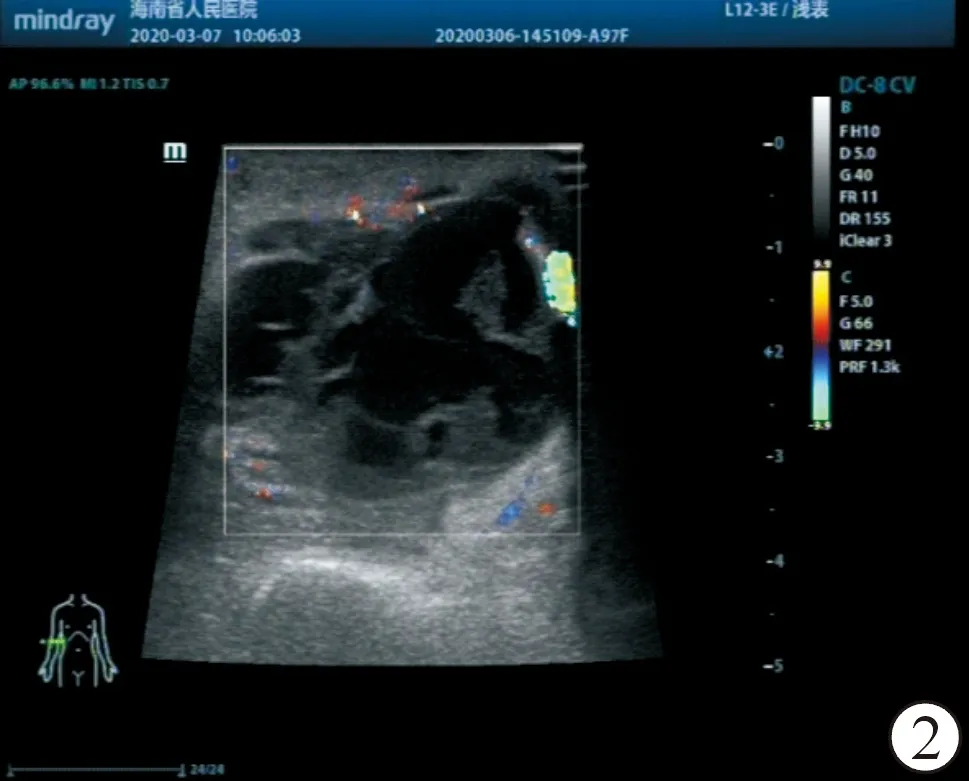





图1 患者人工血管内瘘吻合口处包块(大小约3 cm×4 cm) 图2 包块的彩色多普勒超声图 图3 患者包块里穿刺抽出的淡黄色透亮液体 图4 包块切开后的黄白色囊壁 图5 包囊囊壁病理图纤维性囊壁 5A.HE染色,10×;5B.HE染色,40× 图6 人工血管动静脉端吻合口裸露的人工血管 图7 凝血酶及止血沙包绕
讨 论
人工血管血清肿是指无菌性血清样液体聚集在人造血管周围,液体外周由无分泌性纤维软组织假包膜包裹。好发于动脉吻合口[1]。该例患者分离出动静脉吻合口后发现动静脉端均有血清肿,但主要位于动脉吻合口,并有裸露的人工血管。早期的血清肿是自发形成的,通过针孔和血管微孔渗出的血清是引起术后肢体肿胀原因之一[2]。血清肿被分成四个等级,0级:无;1级:观察、吸收;2级:包括抽吸或外科引流;3级:导致移植物丢失[3]。幸运的是,这种2到3级的血清肿的发生率在0.48%到4.2%之间,是罕见的,与前臂动静脉移植物相比,更常见于上臂[4]。
血清肿发生原因不明,推测可能与人工血管多孔性结构、技术因素、移植物在植入前暴露于腐蚀剂如酒精或碘、免疫(或过敏)因素和生化因素,如抑制成纤维细胞生长[5]。据报道,聚四氟乙烯接枝物和聚酯纤维织物的血清肿发病率均低于2%。发现凝胶涂层聚四氟乙烯动静脉移植的发生率更高为36%,并得出结论,它们不适合用于血液透析[6]。正常情况下当移植物被植入皮下后,组织受损机体自身发生修复,周围成纤维细胞集聚、分裂增生,连同新生毛细血管一起长入人造血管的孔洞,同时成纤维细胞可分泌基质、胶原,4~6周后人工血管周围被纤维组织包裹;若人工血管受损多孔性结构破坏将影响周围组织长入,导致出汗现象进而发生血清肿[1]。手术医生在手术中如果应用肝素盐水浸泡人工血管、生理盐水加压冲洗、酒精聚维酮碘污染人工血管、移植物打折扭曲、操作不规范等均可导致移植物受损;患者贫血、低蛋白血症血浆致胶体渗透压降低促进出汗现象发生;另外成纤维细胞抑制因子可抑制人工血管周围组织长入,促进血清肿发生[5]。该例患者发生原因考虑可能:(1)人工血管的材料,虽然该患者人工血管为聚四氟乙烯,发病率低于2%,但仍有一定可能;(2)患者有贫血及低白蛋白血症致胶体渗透压下降;(3)长期泼尼松的应用是否会抑制人工血管周围组织的长入仍待证实。
血清肿诊断相对容易,好发于吻合口部位,一般在1个月内出现,生长相对缓慢,无搏动性包块,超声波可以帮助区分血清肿和血肿。穿刺抽出透亮液体及手术探查显示假体周围有纤维状假膜,充满浆膜或胶状物质[3]。临床需要与血肿、脓肿、假性动脉瘤等相鉴别。该例患者无法明确时给予穿刺抽液后得以明确诊断。
大多数不需要干预就可以吸收。当血清肿干扰插管、继续生长或损害上覆皮肤时,手术是必要的。应避免抽吸,因为其会显著增加移植物感染和丢失的风险[4]。 因可能继发感染、皮肤皲裂、坏死、移植物血栓、穿刺部位丧失、2至3级的窃血综合征等需要处理。Blumenberg等[7]在1985年回顾性分析了108例样本病例,采取手术切除人工血管、穿刺抽吸、随访观察等处理方法,其中手术取除人工血管最为有效,62例患者中有92%痊愈;进行随访观察的22例中15例自然痊愈,仅有1例出现并发症。 Nicholas等[8]在2008的研究中,用一个8 mm×50 mm的覆膜支架被逆行地放置在移植物动脉末端的“裸背”上使得移植物血清肿完全消失。
上肢人工血管动静脉内瘘并发局部大血清肿罕见,并有包块的囊壁包囊病理检查的国内报道只有1例。本例患者首次处理时仅诊断性穿刺并抽液减压,经穿刺抽液后明确为血清肿,但因液体黏稠,大约抽出2 mL即无法抽出。继续观察2 d后,术侧肢体末梢麻木加重,伴有轻微疼痛,更改为血清肿切除,切除中未仔细探查。术后2周逐渐再次出现血清肿,切开清除血清肿,并发现裸露的人工血管,应用凝血酶联合可吸收止血沙包绕后压迫20 min。目前使用内瘘进行血液透析4个月余,时间稍短,无法评价该方法长期疗效,有待进一步临床经验积累。
