汇图像题型剖解题思路
2020-11-28吴美刚
吴美刚
[摘 要]为使学生掌握图像题的解题思路,教学中教师有必要做好相关题型的汇总,明确图像题考查的知识点,并优选经典例题,与学生一起剖析,使其掌握解答图像题的方法与技巧,以便在考试中能够把握解题的关键点,实现快速破题。
[关键词]高中化学;图像题;解题思路
[中图分类号] G633.8 [文獻标识码] A [文章编号] 1674-6058(2020)32-0064-03
图像题以图像为媒介,能很好地融入知识,考查学生的读图能力和分析问题的能力,因此,在高考化学中备受青睐。解答高中化学图像题时,首先应把握图像的一些关键点,包括纵轴、横轴表示的含义,图像的起点、拐点、终点等,思考图像变化的原因,充分挖掘图像中的隐含信息,然后结合题干,积极回顾所学知识,认真分析,从而有效解题。
一、平衡移动图像题解题思路
平衡移动图像题类型较多,类型不同,考查的侧重点也有所不同。解答平衡移动图像题的解题思路通常为:其一,观察可逆反应各物质的状态,结合图像的变化找到物质的量的变化规律,确定反应系数之间的关系。其二,对比图像与头脑中记忆的图像,分析引起图像变化的因素:是增加了参与反应的物质,还是改变了压强、温度,或是加入了催化剂,等等。其三,如需计算相关参数,应注重运用三行式,找到物质的起始浓度、变化浓度、平衡浓度,再运用相关的计算公式进行解答。计算时需要明确引起参数变化的因素,如平衡常数只受温度影响,以此找到计算的切入点。
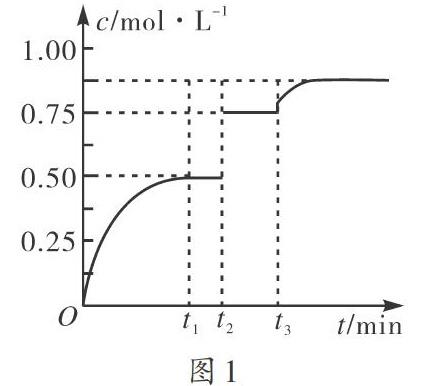
【例1】在2 L的恒容密闭容器中充入各1 mol的M和N气体,发生反应M(g)+N(g)?xP(g)+Q(s)。在t1时反应达到平衡状态。在t2、t3分别改变一个反应条件,检测到P浓度与时间的关系如图1所示,则下列各项中正确的是()。
A.可逆反应中x的值为1
B.在t2时改变的条件为使用催化剂
C. t3改变的条件为移去了少量的Q
D. t1~t3间该反应的平衡常数为4
把握图像的拐点是解决本题的关键。审题可知P在t2时浓度突然增大,但平衡并未发生移动。考虑到反应所处的容器的容积恒定,因此,在t2时应该是增大了压强。增大压强平衡不移动,只能是反应前后气体体积不发生改变的反应,即x=2,A、B两项错误。考虑到Q为固体,因此Q的改变不会给平衡带来影响,C项错误。t1~t3间反应温度未发生改变,因此平衡常数相同。列出三行式,可解得平衡常数K=c2(P)/c(M)·c(N)=0.52/0.25×0.25=4,D项正确。
二、电化学图像题解题思路
电化学图像题通常以产生的气体、出现的沉淀的量绘制相关的图像,考查的知识点较多。解答此类题型时应有明确的思路:其一,认真审题,明确溶液中的溶质,判断是原电池还是电解池。其二,根据所学判断出两极,并结合金属活动性顺序找到对应电极上的放电先后顺序。其三,明确图像纵轴、横轴表示的含义,并根据图像的拐点找到放电的转折点,计算对应物质的量以及电子转移的量,从而计算出相关的物质的量或物质的量浓度。
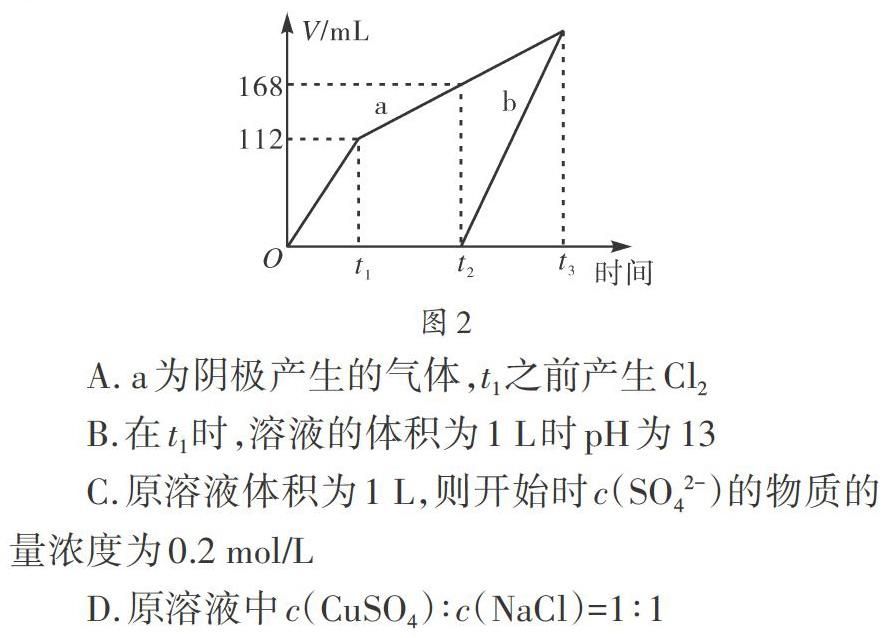
【例2】将CuSO4与NaCl溶液混合在一起后,使用惰性电极电解。测得标准状况下两电极上产生的气体体积如图2所示,则下列相关叙述正确的是()。
A. a为阴极产生的气体,t1之前产生Cl2
B.在t1时,溶液的体积为1 L时pH为13
C.原溶液体积为1 L,则开始时c(SO42-)的物质的量浓度为0.2 mol/L
D.原溶液中c(CuSO4)∶c(NaCl)=1∶1
解题时先搞清楚两极发生的化学反应是关键。其中在阴极发生的是还原反应,反应的顺序为Cu2+先得电子生成单质Cu,Cu2+反应结束后,氢离子得电子生成H2。阳极发生氧化反应,反应顺序为Cl-先失去电子生成Cl2,而后OH-离子失去电子生成H2O和O2。由图2可知,a一开始就有气体产生,表明a为阳极,A项错误。t1时,阴极生成单质Cu,阳极产生Cl2,溶液中的溶质为Na2SO4和CuSO4,溶液呈酸性,B项错误。根据图2内容可知,生成0.005 mol的Cl2气体,转移0.01 mol的电子,对应NaCl的物质的量为0.01 mol。t2时,铜离子放电结束,产生氧气168-112=56 mL,对应的物质的量以及转移的电子数分别为0.0025 mol、0.01 mol,由电子守恒可知,产生的Cu单质为0.01 mol,对应CuSO4的物质的量为0.01 mol。若原溶液为1 L,则c(SO42-)的物质的量浓度为[0.01 mol÷1 L=0.01 mol/L],C项错误,D项正确。
三、电离平衡图像题解题思路
电离平衡涉及的知识点较多,主要有物质反应、物质电离、物质水解等。解答此类题型的思路为:其一,根据图像判断弱酸或弱碱的电离程度,结合电离、水解知识分析溶液中的离子浓度大小。需要注意的是分析离子浓度时应灵活应用电荷守恒、质子守恒、质量守恒等定律,构建正确的离子浓度等式关系,部分等式关系需要联立起来分析。其二,明确图中关键点表示的含义,正确理解与运用相关概念进行分析。如“酸碱恰好中和”与“溶液呈中性”两个概念是不同的,应注意辨别,前者表示中和的百分数为100%,后者表示溶液中OH-和H+浓度相等。
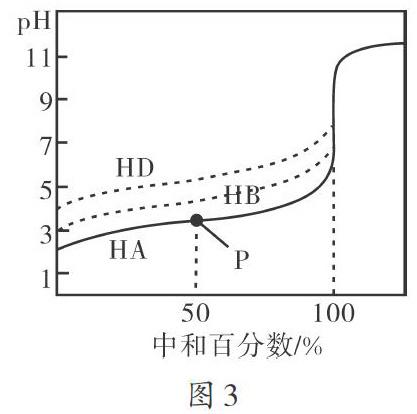
【例3】常温下,用相同浓度的KOH溶液分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB、HD)溶液,滴定曲线如图3所示,以下判断正确的是()。
A.在100%的中和百分数下,将三种溶液混合在一起,满足:c(HA)+c(HB)+c(HD)=c(H+)+c(OH-)
B.在图中P点时,溶液离子浓度大小为c(K+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.同浓度的三种酸对应的盐溶液中KA的pH值最大
D.滴定三种酸至中和状态时,HA消耗的KOH溶液体积最大,HD消耗的体积最小
在100%的中和百分数下,各溶液的溶质为KA、KB、KD,运用质子守恒进行分析可知,c(HA)+c(HB)+ c(HD)=c(OH-)-c(H+),A项错误。P点位置上HA和KA的物质的量浓度相等,溶液为酸性,HA的电离程度较小,离子满足的关系式为c(A-)>c(K+)>c(HA)> c(H+)>c(OH-),B项错误。根据图3可知,三种酸的电离程度由大到小依次为:HA、HB、HD。在浓度相同的条件下,A-、B-、D-的水解程度依次增大,对应盐溶液的pH值依次增大,KD的pH最大,C项错误。当三种酸的浓度相同时,由电离程度可知HD电离的H+浓度最小,因此,消耗的HD溶液的体积最小,D项正确。
四、沉淀平衡图像题解题思路
沉淀平衡图像题在高考中多有出现,解答此类题型的关键在于判断反应的先后顺序,具体解题思路有:其一,在认真审题的基础上,积极联系以往解题经验,找到解题突破口。其二,部分习题会给出一些提示,如物质的沉淀平衡常数等,搞清这些提示后再分析问题。对沉淀平衡常数而言,物质的这一数值越小表示越难溶,沉淀反应也越先进行。其三,结合所学,写出正确的化学反应方程式,找到反应参数之间的关系,即可分析出最终结果。
【例4】在25 ℃条件下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33。逐滴将NaOH溶液滴入到Al(NO3)3和Fe(NO3)3的混合溶液中,生成Al(OH)3沉淀的物质的量与加入的NaOH溶液的体积的关系如图4所示,当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列叙述正确的是()。
A.原溶液中Fe3+与Al3+物质的量浓度比为1∶1
B.可加入过量的NaOH溶液将Fe(NO3)3溶液中混有的Al(NO3)3除去
C.B点存在两种沉淀物,且上层溶液中Al3+与Fe3+物质的量浓度比为2.5×104∶1
D.C点的溶液中只含有NaAlO2这一溶质
根据已知条件读懂题目是解题的关键。将NaOH溶液滴入到Al(NO3)3和Fe(NO3)3的混合溶液中,先产生Fe(OH)3沉淀,后产生Al(OH)3沉淀,分别对应图4中的OA和AB段。由横轴对应的线段可知其消耗NaOH溶液的体积为2∶3,不难推出原溶液中Fe3+与Al3+物质的量浓度比为2∶3,A项错误。除杂过程中过量的NaOH溶液与Fe(NO3)3反应生成Fe(OH)3沉淀,B项错误。B点沉淀的值达到最大,表明存在Fe(OH)3和Al(OH)3两种沉淀,因为Ksp[Al(OH)3]=c(Al3+)·c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-),因此Al3+与Fe3+物质的量浓度比为2.5×104∶1,C项正确。C点时由离子守恒可知,溶液中还存在NaNO3,D项错误。
纵观近年来的化学高考题不难发现,图像在试卷中出现的频率较高。但受多种因素影响,学生在解题过程中总是会出现各种错误,因此,教师在教学中既要分析学生出错的原因,又要做好常考图像题题型的汇总,优选经典例题,并与学生一起剖析解题思路,使学生掌握分析解答各类题型的关键。同时,鼓励学生在日常学习中多进行练习、总结,不断积累相关解题经验及解题技巧,彻底巩固这一重点题型。
[ 参 考 文 献 ]
[1] 刘正心.运用作图法,巧解化学题[J].科技风,2019(10):56.
[2] 吴玲.高中有机化学的常见题型及解题技巧探研[J].成才之路,2018(6):63.
[3] 赵雨泉.高中化学中对化学平衡原理的巧用研究[J].科技风,2017(24):19.
[4] 李似麒,林玉琼.高考理综Ⅰ卷化学图像题对“证据推理与模型认知”的考查及启示[J].福建教育学院学报,2017(11):126-128.
[5] 赵鑫光.高考热点:化学平衡图像题的解题思路和要点[J].中国校外教育,2017(14):116.
[6] 彭梭. 高考化学图像题的统计分析及教学策略研究[D].武漢:华中师范大学,2016.
[7] 詹星悦.高中化学离子反应图像题解题规律分析[J].中学化学教学参考,2014(16):70-71.
[8] 沈旭东.高中化学曲线型图像题类型与解析概论[J].化学教育,2008(5):40-41+45.
(责任编辑 罗 艳)
