驼乳肽生物功能特性的研究进展
2020-11-27吉日木图
苏 娜,吉日木图,2,伊 丽,2,*
(1.内蒙古农业大学,乳品生物技术与工程教育部重点实验室,内蒙古 呼和浩特 010018;2.内蒙古骆驼研究院,内蒙古 阿拉善 750306)
驼乳是一种绿色无公害的天然乳源,它的蛋白质模式比牛乳更接近人乳,其乳清蛋白主要是α-乳白蛋白,不含有致敏性的β-乳球蛋白,这与牛乳明显不同[1]。因此,驼乳可作为婴幼儿防过敏乳源的良好替代品。驼乳与牛乳在蛋白质、维生素和矿物质组成与结构上的差异,导致其具有独特的功能和生物学活性。它本身还存在一些独特的保护性蛋白和促进健康的生物分子,如乳铁蛋白、溶菌酶和免疫球蛋白等[2]。驼乳的生物学和医疗价值很高,因此提高驼乳的利用率和利用驼乳生产高附加值的产品非常有发展前景。但由于骆驼泌乳方式不同于其他哺乳动物,其不含畜乳结构,属于神经反射性泌乳,只有在驼羔吮吸后才可泌乳,因此大部分乳汁用于喂养驼羔。通常双峰驼的日产乳量约为1.5~2.0 kg,与牛乳(30 kg)相比产乳量极低[3]。此外,骆驼在我国主要分布在边疆经济落后地区,如新疆、内蒙古、甘肃、青海等荒漠地区[4],驼乳产业起步较晚,企业规模较小,整体技术水平落后,导致产品结构单一,推广力度不足,使其受限。
蛋白质是驼乳的主要营养成分,其种类也十分丰富。Alhaider等[5]从单峰驼驼乳中鉴定了238 种蛋白质,其中酪蛋白和乳清蛋白是驼乳中最主要的蛋白质。驼乳蛋白的一级结构中加密的一些氨基酸序列,通常在天然蛋白质中不起作用,但一经水解就会被释放出来,对人体健康发挥有益的作用[6]。与其他来源的肽相比,利用驼乳中酪蛋白和乳清蛋白制备的肽具有很强的生物活性。因此,驼乳蛋白可以作为生物活性肽的优质来源[7]。此外,随着科学技术的迅速发展和仪器设备的不断更新,如层析、液相色谱、质谱、液相色谱-质谱联用、软电离离子化和生物信息学分析等[8]这些新技术和新设备的出现,使得生物活性肽在分离纯化和鉴定方面取得了巨大的成功。因此,近几年驼乳蛋白水解产物与健康相关的生物活性方面已有了不少的研究成果,且研究表明驼乳源的生物活性肽具有很好的功能特性,如抗氧化、降压、抗菌、降血糖、抗炎和抗癌等活性[9-13]。本文综述了近年来通过特定蛋白酶水解、模拟胃肠道消化或产酶菌株发酵的方法,对驼乳/驼乳蛋白释放出潜在生物活性肽的研究,为今后驼乳生物活性肽在预防和治疗疾病方面提供参考。
1 抗氧化活性肽
氧化应激是一种负面状态,其特征在于增加自由基水平,从而对重要生物分子如脂质、蛋白质和DNA造成损害。氧化应激通常与许多慢性疾病相关,包括动脉粥样硬化、癌症、糖尿病、类风湿关节炎、心血管疾病、人类慢性炎症和其他退行性疾病[14]。因此,天然抗氧化剂在清除自由基和预防氧化应激相关疾病中至关重要。肽的抗氧化机制主要包括清除自由基(供氢能力和自由基淬灭)活性、抑制脂质过氧化、金属离子螯合作用或这些特性的结合[15]。近年来,驼乳源抗氧化肽研究较多,在营养和健康方面表现出积极的作用(表1)。
研究证实与牛乳相比,驼乳更适合作为抗氧化肽制备的底物[16-17],这种差异是由于驼乳与牛乳的成分不同,如蛋白质种类、氨基酸组成、序列和结构不同所致[18]。驼乳抗氧化肽的制备主要采用酶解的方式,但近些年一些研究则利用发酵菌株以提高其蛋白水解产物的抗氧化活性,如嗜酸乳杆菌[10]、植物乳杆菌[11]、鼠李糖乳杆菌[19]和嗜热链球菌[20]等。据文献报道,驼乳中酪蛋白质量分数高达52%~87%,由αS1-酪蛋白(22%)、αS2-酪蛋白(9.5%)、β-酪蛋白(65%)和κ-酪蛋白(3.5%)[21-22]组成。其中只有α-酪蛋白和β-酪蛋白分解后能够产生抗氧化肽,但其分解机制不同。Hartmann等[23]指出大多数抑制必需脂肪酸酶和非酶过氧化的肽来自αS-酪蛋白,它是磷酸化的酪蛋白。其中αS1-酪蛋白序列中有6 个磷烯残基,αS2-酪蛋白有9 个,揭示了αS-酪蛋白的抗氧化活性可能与磷酸肽有关[24]。而Jrad等[15]认为驼乳酪蛋白中富含β-酪蛋白,该蛋白是抗氧化肽的最佳来源。有研究发现驼乳β-酪蛋白含有8 个苯丙氨酸(一种高度抗氧化的芳香族氨基酸),而牛乳β-酪蛋白只含有5 个,导致驼乳β-酪蛋白可以产生潜在的抗氧化肽[12]。相对于驼乳全蛋白和酪蛋白,Ibrahim等[25]认为其乳清蛋白提取的肽抗氧化活性更高,因为乳清蛋白提取的肽具有两亲性质。这些研究表明,驼乳中不同种类蛋白水解产生的抗氧化肽其活性不同。
2 降压活性肽
血管紧张素转换酶(angiotensin-converting enzyme,ACE)在高血压的形成中发挥着重要作用,因此抑制ACE是抗高血压的首要策略。为此人们目前主要集中在研究更安全、更温和的ACE抑制剂和食物来源的ACE抑制肽,其中无副作用天然的食源性ACE抑制肽更具有研究吸引力。
ACE抑制肽被发现存在于许多食物蛋白源的初级结构中,包括骆驼乳蛋白[49]。Alhaj等[50]指出驼乳蛋白本身就具有ACE抑制活性,这可能是由于原乳受到细菌的感染或者是原乳本身的内源性酶产生了一些生物活性肽,其本质上还是驼乳蛋白水解所致。2018年,Jafar等[13]发现与其他蛋白水解酶相比,用α-糜蛋白酶获得的乳清蛋白水解产物(在芳香族氨基酸残基后特异性裂解)显示出较高的ACE抑制活性,da Costa[51]和Adjonu[52]等也得出同样的结果。水解产物之间ACE抑制活性的差异可归因于酶反应速率、酶专一性和底物的亲和力[53]。2019年,Soleymanzadeh等[48]鉴定出具有ACE抑制作用的肽MYDYPQR(MR7),研究发现该肽含有4 个疏水性氨基酸、2 个极性氨基酸和1 个带电氨基酸。肽的疏水性达57.14%,显示出适度的疏水性。由于肽与ACE活性位点的结合与疏水性氨基酸有着本质的关系,造成MR7具有高的ACE抑制活性[54-55]。此外,在肽的C-末端存在如精氨酸等带正电荷的氨基酸,可能有助于抑制ACE,使ACE抑制活性显著提高[56-57]。分子对接研究也表明,C-末端的精氨酸对MR7和ACE的相互作用有实质性的影响,精氨酸与ACE活性位点的氨基酸残基形成氢键,导致ACE的四面体几何结构发生畸变,ACE失活。同年,Maqsood等[17]比较了驼乳与牛乳以及其模拟胃肠消化后的产物的ACE抑制活性,发现水解后的乳蛋白可提高自身的ACE抑制能力。此外,驼乳蛋白对ACE的抑制作用略强于牛乳蛋白,半抑制浓度(half maximal inhibitory concentration,IC50)分别为0.34 mg/mL和0.35 mg/mL。其水解产物对ACE的IC50也低于牛乳蛋白水解产物。造成这种差异的原因是由于驼乳与牛乳的成分不同,从而产生了不同序列的肽段,说明驼乳蛋白经胃肠道消化后具有优于牛乳蛋白的ACE抑制潜力。
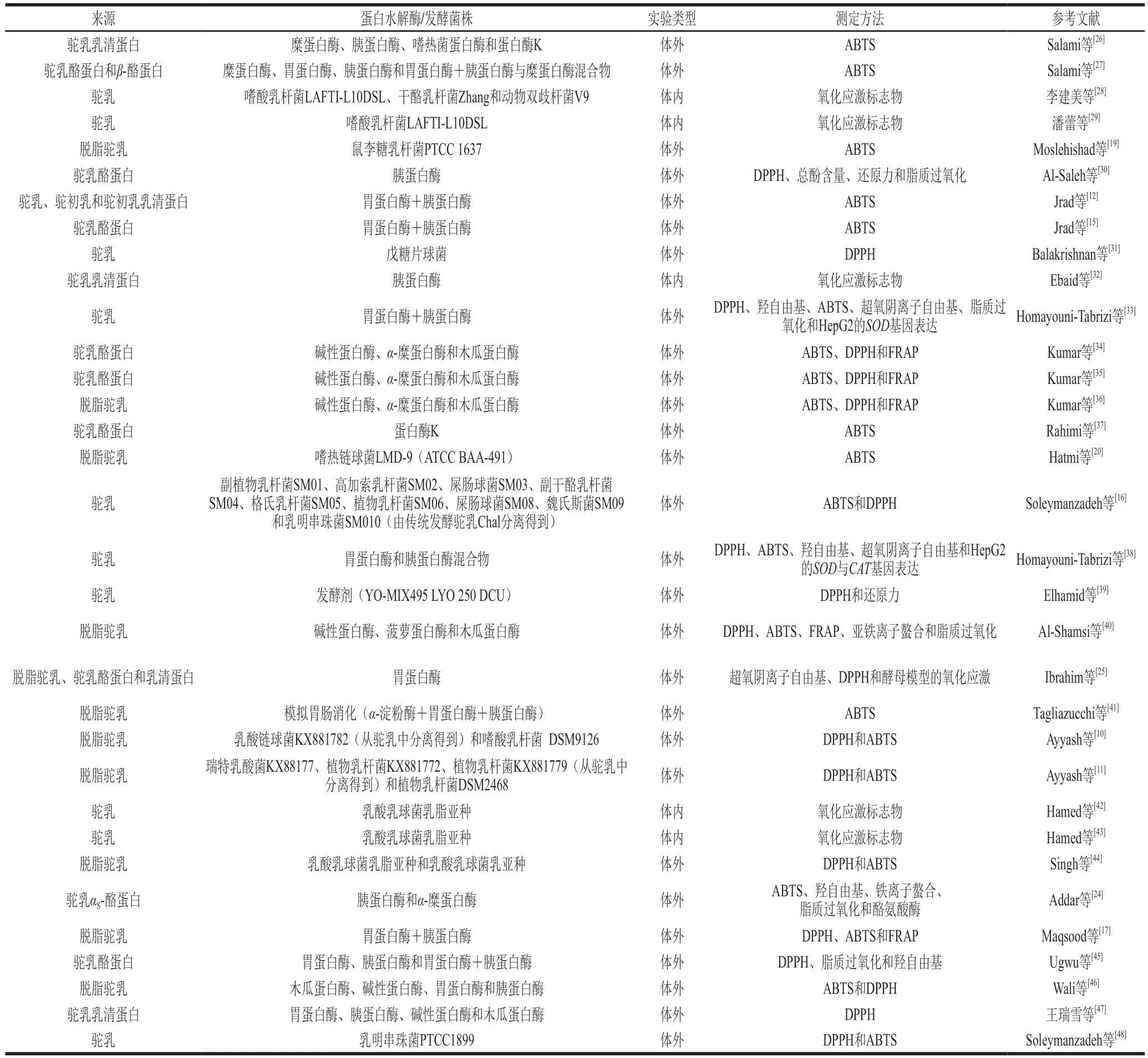
表1 驼乳抗氧化活性肽的研究进展Table 1 Recent studies of antioxidant peptides derived from camel milk

表2 驼乳降压活性肽的研究进展Table 2 Recent studies of antihypertensive peptides derived from camel milk
除酶解外,发酵菌株鼠李糖乳杆菌发酵驼乳后,能够产生一种富含脯氨酸残基的低分子质量生物活性肽,具有较高的ACE抑制活性[19]。这是因为鼠李糖乳杆菌具有多种的蛋白酶系统,如X-脯氨酸二肽氨基肽酶和脯氨酸特异性氨基肽酶,它们能水解乳蛋白产生一些与抑制ACE有关的生物活性肽[58-59]。这种特异性蛋白酶系统也在嗜热链球菌、瑞士乳杆菌和德氏乳杆菌亚种中被发现[60]。Yahya等[61]就利用瑞士乳杆菌LMG11445和嗜热链球菌ATCC19258发酵的脱脂驼乳喂食自发性高血压大鼠,发现与对照组相比,摄入高剂量的发酵驼乳会在短期和长期的作用下具有降压效果。研究发现不管是体外还是体内实验,驼乳蛋白水解后都表现出显著的ACE抑制活性(表2),为以后降压食品或药品的开发提供参考。
3 抗菌活性肽
与母乳相似,驼乳含有重要的抗菌成分,如免疫球蛋白、乳铁蛋白和溶菌酶等保护性蛋白。且驼乳(1.54 mg/mL)中的免疫球蛋白质量浓度远高于母乳(1.14 mg/mL)[65-66];溶菌酶含量也高于其他反刍动物,具有很好的抗菌性能[67-68]。驼乳中的乳铁蛋白可以通过破坏病原菌的细胞膜,从而起到抗菌作用[69]。即使是热处理(70 ℃、30 min)后的驼乳也可以激活其天然的抗菌系统,有效地抑制微生物生长[68]。驼乳蛋白本身具有良好的抗菌作用,为此学者们对这些蛋白进行水解,研究了水解后的活性变化。
近年来,主要是研究驼乳蛋白水解产物对革兰氏阳性菌和革兰氏阴性菌的抵抗能力(表3)。2010年,Salami等[26]发现驼乳乳清蛋白和牛乳乳清蛋白及其水解产物都能抑制大肠杆菌的生长。其中未水解的驼乳乳清蛋白的抗菌活性明显高于牛乳乳清蛋白,这可能与驼乳蛋白中抗菌因子含量高有关。再通过糜蛋白酶、胰蛋白酶、嗜热菌蛋白酶和蛋白酶K对乳蛋白有限的水解,可增强其乳清蛋白本身的抗菌活性,且驼乳乳清蛋白水解产物的抗菌活性更强。2015年,Jrad等[70]对驼乳酪蛋白和驼乳酪蛋白经胃肠模拟消化后的产物进行了比较,结果表明水解产物对革兰氏阳性菌有轻微抑制,而驼乳酪蛋白本身却对革兰氏阳性菌无影响,说明水解后酪蛋白可释放出有效的抗菌肽。2016年,Kumar等[34]发现经过酶解后的驼乳酪蛋白,由于不同分子质量的肽段具有相互协同作用,使得整个水解产物的抗菌活性高于超滤后的各个组分。而Salami等[26]得出利用蛋白酶K水解后的驼乳乳清蛋白3 kDa以下的超滤组分对大肠杆菌的抑制作用最强。2018年Muhialdin等[71]也得出同样的结论,利用植物乳杆菌发酵的驼乳,通过菌株培养过程中产生的蛋白酶,释放出小分子质量的生物活性肽可潜在增强其抗菌活性。这归因于较小的肽更容易穿透微生物细胞的脂膜,增加离子和代谢物的泄漏,破坏细胞功能,导致细胞死亡[72],说明水解后肽段的大小对抗菌活性有着重要的影响。
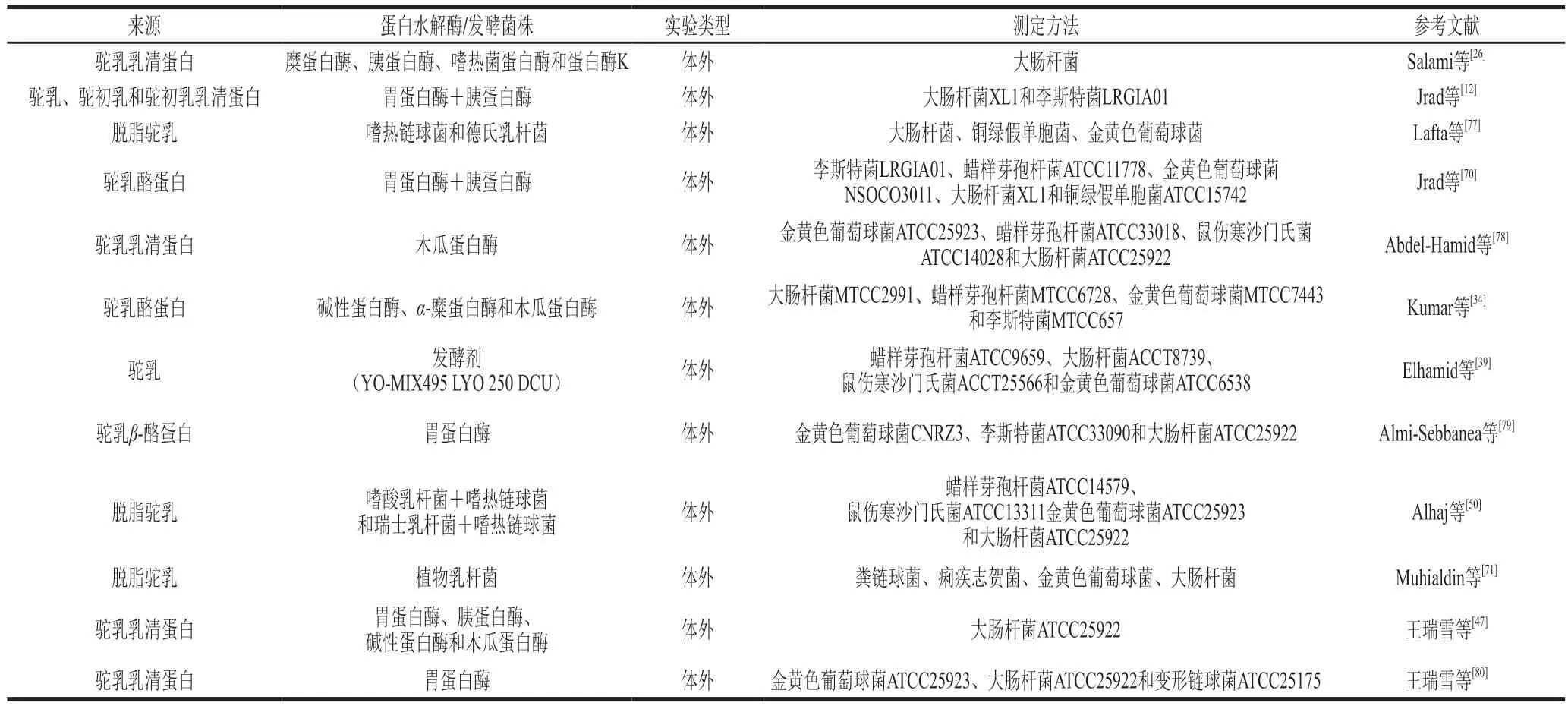
表3 驼乳抗菌活性肽的研究进展Table 3 Recent studies of antibacterial peptides derived from camel milk
研究发现鉴定出的抗菌肽一般具有以下特征:分子质量低于1 kDa,从酪蛋白中提取的抗菌肽在0.4~0.6 kDa之间[73];肽段序列含有2~20 个氨基酸[26],包含大量的疏水性氨基酸[74],肽的疏水性会造成细菌细胞壁或细胞膜的功能紊乱;大多数抗菌肽带正电荷,它们与细菌细胞壁上带负电荷的成分静电结合,导致细胞壁破坏[75-76]。驼乳源抗菌肽会具有其中某一或某些特征以抵抗细菌的生长繁殖,从而发挥抗菌作用。
4 降血糖活性肽
糖尿病是一种以高血糖为主要特征的代谢性疾病,其主要根源在于血糖浓度过高,因此控制并降低血糖是治疗糖尿病的唯一途径。研究证实,经常食用具有降血糖功效的天然食品,再配合药物的治疗,能够达到降血糖目的,同时还能降低传统药物的毒副作用[81]。因此,研发毒副作用小并具有降血糖作用的功能性食品或药品,特别是天然生物活性肽对于糖尿病的防御及辅助治疗是很有必要的[82]。
现有对驼乳中降血糖活性肽的研究主要以二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)、α-淀粉酶和α-葡萄糖苷酶抑制活性作为评定依据,来判断其降血糖活性。2017年,Nongonierma等[83]指出驼乳与牛乳蛋白在相同水解条件下,产生的DPP-IV抑制肽的活性不同,其肽段序列也不同,这与蛋白水解酶在不同乳蛋白中肽键断裂的不同选择性以及氨基酸的序列不同有关。再通过液相色谱-质谱联用仪、定性/定量结构-活性关系和合成肽验证性研究相结合的方法,发现最有效的DPP-IV抑制肽是LPVP和MPVQA,IC50分别为(87.0±3.2)μmol/L和(93.3±8.0)μmol/L。2018年,Mudgil等[6]利用不同蛋白酶对驼乳蛋白水解,对其活性高的肽段A9和B9进行鉴定,筛选出评分大于0.80的肽段,并预测了与DPP-IV和α-淀粉酶结合的活性位点,发现降血糖活性与氨基酸残基的特性、含量和位置有一定的关系。同年,Ayyash等[10-11]根据α-淀粉酶和α-葡萄糖苷酶抑制活性的结果,评价了固有乳酸菌(驼乳中分离的乳酸菌)和非固有乳酸菌(外来乳酸菌)发酵驼乳的抗糖尿病作用。抑制这些与糖尿病相关的代谢酶实质上是减少碳水化合物的水解,从而减少葡萄糖等糖类物质在肠道内的吸收[84]。结果发现,随着贮藏时间的延长,发酵驼乳的α-淀粉酶的抑制活性显著增强,而发酵牛乳无显著变化。固有乳酸菌发酵乳的α-葡萄糖苷酶的抑制活性高于非固有乳酸菌发酵乳。总地来说,发酵驼乳对酶的抑制能力强,可能是由于乳酸菌发酵分泌的蛋白水解酶,作用后释放出小的生物活性肽所致。
目前,驼乳降血糖活性肽的研究甚少,主要集中在水解驼乳全蛋白上,蛋白酶、微生物菌株和底物单一(表4)。基于此,今后应采用多种蛋白酶或发酵菌株水解进一步细化的驼乳蛋白,为驼乳多肽在防治糖尿病方面做出新的贡献。

表4 驼乳降糖活性肽的研究进展Table 4 Recent studies of hypoglycemic peptides derived from camel milk

表5 驼乳其他活性肽的研究进展Table 5 Recent studies of other bioactive peptides derived from camel milk
5 其他活性肽
除上述生物活性肽以外,驼乳中还鉴定出了具有抗炎、抗癌和抗肥胖等多种生物功能特性的肽(表5)。炎症虽是机体对非致死损伤的反应,但过度和不受控制的炎症变化往往导致慢性疾病。经过水解后的驼乳蛋白抗炎作用明显增强,对于各种肽序列的研究表明,具有较强抗炎活性的肽富含正电荷和疏水性氨基酸,特别是在N-端和C-端。此外,谷氨酰胺被认为是抗炎活性肽的关键氨基酸[64]。2018年,Ayyash等[10-11]比较了发酵驼乳与牛乳对Caco-2(人结肠癌细胞)、MCF-7(人乳腺癌细胞)和HeLa(人宫颈癌细胞)的抑制作用,发现发酵驼乳具有更高的抗增殖活性。这种结果可以解释为发酵驼乳较发酵牛乳产生的肽与癌细胞膜受体的生长因子有更强的竞争能力;或者是发酵驼乳产生的肽具有特殊的细胞毒性,能够引起癌细胞凋亡[87-88]。最新研究发现,经木瓜蛋白酶水解驼乳蛋白9 h后,可产生4 个有效的胆固醇酯酶抑制肽WPMLQPKVM、CLSPLQMR、MYQQWKFL和CLSPLQFR,可有效改善肥胖。分子对接显示这4 条肽能够与胆固醇酯酶的活性位点结合,具有良好的对接分数和玻恩比表面积结合能[89]。总地来说,水解后的驼乳蛋白可能通过不同的作用机制在人体内表现出多功能的生物活性。
6 结 语
随着乳源生物活性肽研究报道的多样化和广泛化,乳源生物活性肽的探索成为了研究热点。其中驼乳凭借着丰富的营养成分和众所周知的健康益处,成为制备生物活性肽的优质来源,备受研究学者们的广泛关注。
本文着重介绍了通过酶解、模拟胃肠消化和发酵驼乳蛋白释放的生物活性肽的研究,包括抗氧化、降压、抗菌、降血糖、抗炎和抗癌等活性肽,并对其作用机理和分子机制进行了简单的阐述。驼乳生物活性肽已被证明可以直接或通过体内或体外蛋白酶水解对人体生理和代谢产生积极的影响。驼乳蛋白水解后产生的生物活性肽表现出很高的利用价值,它们相互联系、协同作用,共同促进身体健康。其中生物活性肽的氨基酸组成、序列和结构受到底物、蛋白水解酶和发酵菌株的影响,从而直接关系到活性的大小。驼乳生物活性肽基本都是在某一特定条件下水解驼乳蛋白制得,优化驼乳蛋白的水解条件方面仍缺乏研究。为此,后续研究应对酶解和发酵过程中的外在条件进行优化,以期获得活性更高的生物活性肽。此外,应对其毒性、理化性质以及消化吸收性进行研究,并证实其在动物体内的活性,为今后将制备的生物活性肽运用到现实生活中奠定坚实的基础。在工业规模上水解驼乳蛋白时,还应综合考虑感官质量和经济成本问题,应减少苦味氨基酸的释放,节约成本。
虽然驼乳生物活性肽在理论研究上表现突出,但由于种种原因未真正的应用到实际产品当中,如保健品和功能食品等。为此,人们需要科学的管理和饲养以提高骆驼的产乳量,开发骆驼相关产品,加大投入力度,提高骆驼产业的发展水平;有关部门应该强化骆驼科研建设,研究骆驼潜在的功能特性和作用机制,提高骆驼的利用价值;国家政府需要出台相关政策,大力推动并扶持骆驼产业,鼓励牧民养殖骆驼,推广骆驼副产品,提高骆驼产品的知名度,扩大骆驼市场。这一举措不仅可以充分利用自然环境资源和平衡生态环境,而且还可以推动边疆地区的经济发展和牧民们的经济收入,具有重大的现实意义和广阔的发展前景。
