抗性淀粉生理功能及作用机制的研究进展
2020-11-27闫国森郑环宇孙美馨丁阳月张志华
闫国森,郑环宇,,*,孙美馨,丁阳月,张志华,许 慧,陈 昊,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省绿色食品科学研究院,国家大豆工程技术研究中心,黑龙江 哈尔滨 150028)
近年来,随着经济水平的发展和生活方式的改变,糖尿病、结直肠癌(colorectal cancer,CRC)等各类由于饮食结构不合理导致的疾病也随之产生,使人们逐渐意识到饮食结构和人体健康有着密不可分的联系;因此,健康合理的饮食结构越来越受到重视。抗性淀粉(resistant starch,RS)作为一种来源广泛、口感良好的新兴食品,具有饱腹感强、消化率低、血糖生成指数(glycemic index,GI)低等特点,受到人们的广泛关注。RS有着类似膳食纤维的特点,但相对于高膳食纤维食物粗糙的口感和质地,高RS食物的口感与普通淀粉食物无异,消费者接受程度更高,在代餐和保健食品中有着巨大的发展潜力。RS随着消化系统进入大肠后,可被肠道菌群发酵分解为短链脂肪酸(short-chain fatty acids,SCFAs),进而被吸收利用,被认为与肠道健康有着密切的联系。随着研究的深入,人们普遍发现RS不仅能够通过抗消化、降低GI等简单途径发挥益生作用,而且对肠道微生物菌群及肠道上皮细胞有着调节和保护作用,能有效降低CRC、II型糖尿病(type 2 diabetes,T2D)和慢性肾病(chronic kidney disease,CKD)的风险,对一些由饮食引起的慢性疾病有着良好的预防和缓解作用。本文主要综述了RS及其分解产物对CRC、T2D以及CKD的预防和抑制作用,并对其作用机制进行探讨,最后,对RS的研究方向和在日常饮食及益生食品中的应用做出了展望。
1 RS的定义与分类
RS是20世纪80年代英国生理学家Flans Englyst发现的一种在人体小肠中不能被消化的淀粉,1992年被联合国粮食及农业组织重新定义为:不被健康人体小肠所消化吸收的淀粉及其降解产物的总称[1]。RS来源较多,如马铃薯、豆类、玉米及青香蕉中均有较高含量的RS,RS也常被添加到无麸质饼干、代餐食品、面包中制备低能量食品。通过老化回生、化学改性等处理方式也可人工制备RS,但通过化学改性制备RS存在一定的安全隐患,目前主要以老化回生为主要制备方式。
由于RS来源广泛、形式多样,因此,其抗消化机理也在物理和生理等方面存在差异,根据这些差异将RS分为5 类(表1)。

表1 RS的分类[2]Table 1 Classification of RS[2]
2 RS与CRC的联系
2.1 RS降低CRC发病率
CRC是目前发病率最高的胃肠道肿瘤,在全球范围内,其发病率仅次于肺癌,在男性所患癌症中位居第三[3]。流行病学研究表明,CRC的发生与发展与饮食类型有着密切联系,吃西餐的人比地中海饮食或亚洲饮食的人患CRC的风险更大,这可能因为传统地中海和亚洲饮食包括多种植物性食物和未经精制的谷物[4-7],这些食物中含有更多的RS,这在人类和动物研究中都被证明可以降低CRC发生的风险[8-9]。
已有研究证明CRC的发病机制和肠道上皮细胞的功能密切相关,肠上皮细胞功能障碍激活了肿瘤相关巨噬细胞,引起炎症细胞因子的产生,最终导致肿瘤的形成和发展[10]。
而高RS饮食能增加粪便湿质量和体积,这可以加速肠道转运,缓解便秘,并可以预防憩室疾病,对肠道健康有着积极的作用[11]。同时,RS在肠道中的发酵过程也能够引起肠道菌群丰度的改变,如嗜酸杆菌、大肠杆菌和拟杆菌等与肠道炎症密切相关的促炎微生物,均被发现随RS摄入量的增加而显著降低,这表明RS通过对促炎微生物的抑制作用从而保护肠道健康[12-13]。RS在肠道中被双歧杆菌、拟杆菌等发酵分解,其最终产物为可被肠道上皮细胞直接利用的SCFAs,其中丁酸约占20%~30%[14-15],而丁酸是肠道上皮细胞能量的主要来源,对肠道上皮细胞起着多种作用[16-17]。有研究表明丁酸盐通过调控肿瘤坏死因子(tumor necrosis factor,TNF)-α、炎症白细胞介素等通路发挥抗炎作用[18]。
2.2 RS抑制CRC的发展
组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。在癌细胞中,HDAC的过度表达能够导致去乙酰化作用的增强,通过恢复组蛋白正电荷,从而增加DNA与组蛋白之间的引力,使松弛的核小体变得十分紧密,从而导致p21等肿瘤抑制基因沉默[19-20]。目前已有研究表明,丁酸盐在体内可作为HDAC的抑制剂(histone deacetylase inhibitor,HDACi)[21],通过组蛋白乙酰化调控CRC相关基因的表达,如血管生成因子(vascular endothelial growth factor,VEGF)、抑癌基因、Wnt信号通路以及微小核糖核酸(microRNA,miR),进而抑制CRC细胞的增殖、分化和转移,并促进细胞凋亡。
MicroRNA是一种微小的RNA,转录后可以通过调节mRNA的功能进而抑制或促进蛋白质的产生[22],研究表明miR-203能抑制细胞增殖、侵袭和转移[23]。对皮肤肿瘤的研究发现,丁酸能促进miR-203的表达,从而抑制癌细胞的增殖和转移,促进癌细胞凋亡[24],而Han Ruirui等[25]的研究表明,丁酸盐能够通过同样的方式抑制大肠癌细胞的增殖和扩散,同时,丁酸处理还可抑制与肿瘤分化相关的miR-92a基因[26]。进一步研究表明,肠道中的丁酸盐通过调节CRC中的c-Myc表达来抑制致癌的miR-92a。miR-200是肠道上皮间质转换的重要因子,在Xu Zhiyao等[27]的研究中,丁酸盐通过增强miR-200表达介导BMI-1的下调来抑制CRC细胞的迁移,防止癌细胞的扩散转移。
另有研究发现,在50%以上的人类癌症中都可以检测到p53突变,表明p53是一种与肿瘤消退高度相关的抑癌基因[28],用丁酸处理诱导CRC细胞发现丁酸盐可以抑制结肠癌生长因子β-catenin的表达,降低突变体p53的表达并诱导p53的下游靶点p21的表达上调,同时发现丁酸在G1期对CRC细胞的增殖有着良好的抑制作用[29]。
肿瘤的生长和转移高度依赖新生血管的形成[30]。血管的生成受到生长因子的调控,VEGF是血管生成的核心调控因子。VEGF在许多实体肿瘤中表达上调,包括原发性和转移性CRC。神经肽(neuropeptides,NRP)是VEGF的一种表达受体,临床研究表明,高表达NRP-1的CRC有更高的转移率、增殖指数和凋亡癌细胞数量[31]。体外实验表明,丁酸盐通过抑制转录因子Sp1反活化能下调NRP-1和VEGF在mRNA中的表达和CRC细胞中的蛋白水平,NRP-1的表达受到抑制,VEGF与NRP-1的结合也降低,从而抑制肿瘤血管的生成[32-33]。
在大多数CRC病例中,正常细胞成熟分化的关键因子Wnt信号通路的管制被解除,因而导致其过活化,引起肿瘤细胞的无限增殖[34]。已有研究证明,丁酸处理能调控大肠癌细胞Wnt活性和凋亡,丁酸盐处理后Wnt活性较高的CRC细胞凋亡水平较高,而对Wnt活性较低的细胞无影响[35]。另有研究表明丁酸盐处理可诱导CRC细胞Wnt信号特异性基因表达的改变[36]。此外,Li Qingran等[37]的研究表明丁酸盐处理对细胞增殖过程中驱动细胞周期进展的关键信号通路——细胞外调节激酶(extracellular-regulated kinase,ERK)1/2有显著的抑制作用。
2.3 RS改变CRC细胞代谢途径
正常分化的细胞主要依赖有丝分裂素驱动的氧化磷酸化来产生细胞增殖所需的能量,葡萄糖经糖酵解后进入三羧酸(tricarboxylic acid,TCA)循环彻底氧化放能。与之不同的是,大多数癌细胞依赖更为快速的需氧糖酵解产生能量,在有氧条件下通过糖酵解消耗葡萄糖,而不是将葡萄糖中间产物引入TCA循环,这种细胞代谢的改变称为Warburg效应[38-40]。
由于CRC细胞中TCA循环被抑制,丁酸盐的正常代谢降低,因此CRC细胞中含有较高的丁酸盐浓度,同时丁酸盐的积累强化了其作为HDACi的作用,与Liu Chengxia等[28]发现丁酸盐浓度在2.5 mmol/L以上时才可抑制癌细胞的增殖、促进其凋亡的现象相符,而在健康人体内丁酸盐经TCA循环代谢消耗,浓度通常较低;因此,丁酸盐在健康人体内和癌症患者体内具有着截然不同的表现,即丁酸悖论。
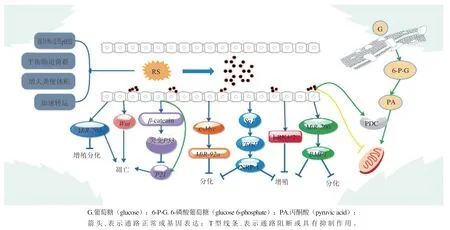
图1 RS及其分解产物对CRC的预防和抑制作用Fig. 1 Preventive and inhibitory effects of RS and its decomposition products on CRC
有研究表明,丁酸盐不仅作为HDACi抑制癌细胞生长,还可通过逆转Warburg效应,促进TCA循环等一系列代谢途径发挥作用。丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDC)是连接糖酵解和TCA循环的酶复合物,由3 种酶组成(丙酮酸脱氢酶(pyruvate dehydrogenase,PDHA1)、二氢酰胺乙酰转移酶和脂酰胺脱氢酶)。在癌变细胞中,PDC的失活可能是Warburg效应发生的主要原因,Xu Sha等[41]的研究表明丁酸盐作为HDACi使PDHA1高度乙酰化,解除了丝氨酸对PDHA1的抑制磷酸化,从而激活糖酵解中间体流入TCA循环,逆转Warburg效应。Zhang Wen等[42]在利用丁酸苯酯对动物模型进行干预的实验中也得出了相同的结论,同时研究还发现,丁酸还可调控sirt3的表达,进而对电子传递链复合物I进行调控,复合物I被抑制时,产生的能量减少,TCA中间体内流增加,因此使得无限增殖的癌细胞发生凋亡。另有研究发现,丁酸还可通过促进丙酮酸激酶M2亚型(pyruvate kinase M2,PKM2)的去磷酸化而激活PKM2,从而抑制重组大肠癌细胞的代谢,抑制Warburg效应,有利于能量的利用[43]。这表明丁酸盐不仅在基因水平上发挥调控作用,还可通过直接参与细胞代谢的方式对癌细胞起到抑制作用。图1总结了RS及其分解产物对CRC发挥预防和抑制作用的途径。
3 RS与CKD的联系
CKD患者由于肾脏结构、功能损害和进行性恶化等原因,其饮食结构及膳食成分与病情控制有着密切联系。Krishnamurthy等[44]通过对14 543 名国家健康和营养检查的参与者进行分析,发现CKD患者的炎症及死亡率与膳食纤维的摄入量存在联系。因为RS具有与膳食纤维类似的特点,而被认为与其有着相同的功效。Younes等[45]向CKD患者的饮食中每天加入25 g RS,并与普通淀粉饮食的患者进行对比研究,5 周后发现摄入RS的患者粪便中氮排出量显著增大,表明RS可能通过排便方式加速体内氮排泄,对CKD患者有益。
3.1 降低血清尿素与肌酐水平
Vaziri等[46]假设RS对CKD患者的病情有缓解作用,用0.7%腺嘌呤诱导雄性大鼠产生CKD后,分别喂食低纤维(支链淀粉)和高发酵纤维(玉米直链RS)3 周,结果发现高发酵纤维组的大鼠肌酐清除率提高,炎症、肾小管损伤以及结肠上皮细胞紧密连接的破坏均显著改善,证明了RS对CKD小鼠的病情有缓解作用。而Khosroshahi等[47]通过分析46 名需要定期进行血透析的肾病患者补充高直链玉米2型RS(high amylose maize-RS type 2,HAMRS2)(25 g/d)后的血液样本,发现HAMRS2组的患者血清尿素和肌酐浓度显著下降,便秘程度明显改善,且患者对HAMRS2的摄入耐受良好,没有明显的副作用;而以普通淀粉作为安慰剂的对照组则无明显变化,证实了RS对CKD的缓解作用。
3.2 增加肠道氮代谢
目前,RS已被证明能够改善CKD大鼠模型的肾功能,其对改善肾病患者的影响主要集中在盲肠、肠道菌群、血液和尿代谢物几个方面。在富含RS的饮食中,大肠菌群发酵作用产生的SCFAs参与了肠道血流的刺激,这一作用可能有助于预防肠缺血,促进肠道健康,同时SCFAs的存在降低了大肠pH值,对肠道起保护作用[48]。RS对有益菌群的增殖作用使其活性升高,通过竞争作用减少脲酶细菌的增殖,从而减少由脲酶细菌生成的NH3和NH4OH对肠道上皮细胞的破坏。RS还能在肠道中吸收水分,这在防止便秘、缩短转运时间的同时也减轻了肾小球重吸收的负担。同时,RS能够依靠吸附氨来提高粪便中铵盐的含量,使之随粪便被排出体外,进而降低CKD患者体内氮的积累。
Kieffer等[49]综合了RS对改善肾功能相关因素的影响,如盲肠、肠道菌群、血液和尿代谢物,对RS改善肾功能的潜在机制进行阐述。分别以低纤维饮食和高纤维饮食59% HAMRS2喂养腺嘌呤诱导CKD雄性大鼠3 周后,对盲肠微生物体进行了鉴定,并对盲肠内容物、血清和尿液代谢物进行了分析,结果发现HAMRS2组大鼠的盲肠菌群结构发生显著改变,可能由于HAMRS2的组分和构型单一,完全由葡萄糖和α-1,4糖苷键组成,从而使肠道菌群比例改变。在HAMRS2大鼠肠道中,双歧杆菌属(放线菌门)、Barnesiellaceae(拟杆菌门)和粪肠杆菌丰度显著增加,分别为1.11%、0.30%、0.84%,且蛋白细菌显著富集,如RF 32(变形菌纲)、肠杆菌科。同时观察到肠道中几类氨基酸含量明显下降,血清和肠道内容物中尿素含量下降,这是因为RS与其他谷物不同,不含蛋白质,因此,肠道成为了菌群生长的“氮库”,这可能会引起肠道尿素转运蛋白的增加,促进尿素微生物对肠道尿素的利用,减少经门静脉进入血清的尿素总量,从而降低了肾脏重吸收的负荷。同时,RS的摄入缩短了盲肠内粪便转运时间,尿素由此快速排出,这加强了肠道对尿素的代谢作用。尿素的快速排出、降解以及SCAFs造成的低pH环境也使得肠道上皮细胞得以修复,增加肠道的屏蔽功能,减少有毒物质及细菌通过体循环的传播,降低肾炎发生的可能[50],RS对CKD的预防和调节机制见图2。
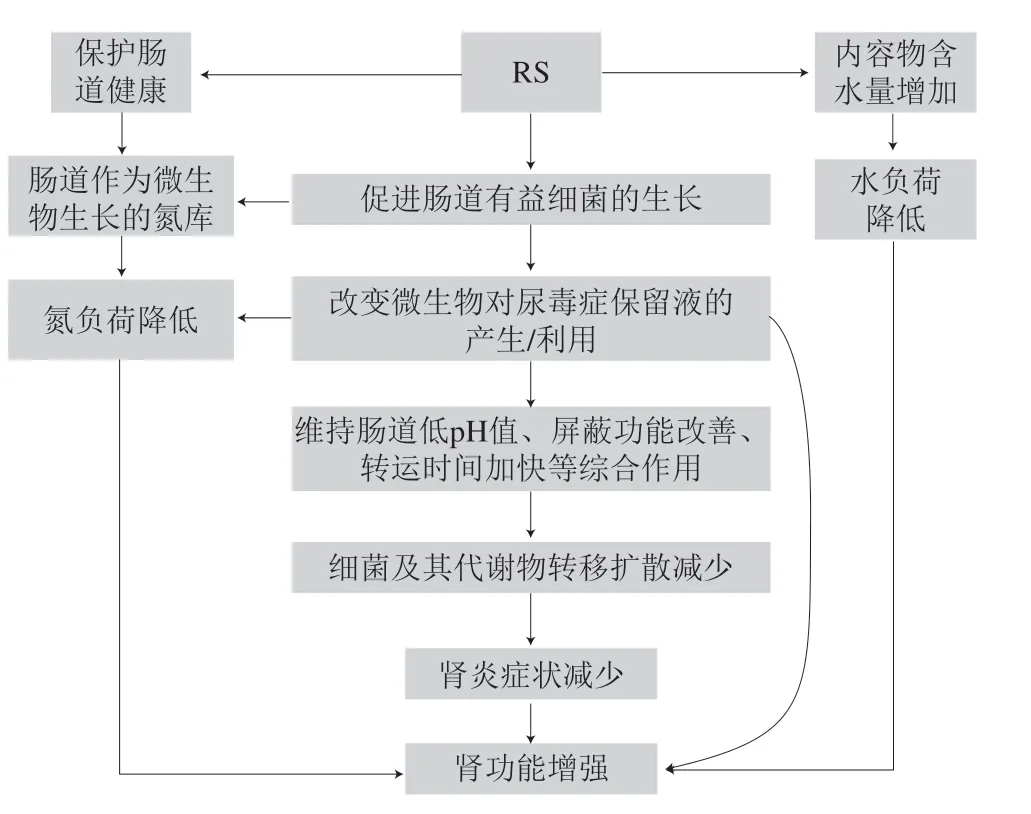
图2 RS对CKD的预防和调节机制Fig. 2 Preventive and regulatory mechanisms of RS on CKD
4 RS与糖尿病
在全球范围内,糖尿病的发病率自20世纪80年代初以来增加了13 倍以上,成为最受关注的公共卫生挑战和经济负担之一[51]。目前全世界糖尿病患者约3亿,如果不进行干预,到2040年,糖尿病患者可能会超过6.42亿[52]。
糖尿病有两种类型,分别称为I型糖尿病(type 1 diabetes,T1D)和T2D,T1D是一种自身免疫性疾病,与胰腺B细胞破坏有关,诊断时最常见的年龄在10~14 岁之间。在T1D中观察到的一些常见症状包括高血糖、多汗、多尿、体质量减轻和酮症[53],而T2D主要是由于日常生活中的各种影响因素引起的,如肥胖、饮食、年龄、运动量较少等,与T1D相比,T2D是由于胰岛素敏感性降低导致的高血糖和高胰岛素症。
4.1 控制血糖水平
在正常情况下,胰岛素分泌在餐后血糖升高时开始,血糖的升高刺激胰腺的B细胞分泌胰岛素,促进葡萄糖转运蛋白-2对葡萄糖的转运作用,加速葡萄糖氧化分解、释放能量[54-55]。近年来,随着研究的深入,发现高RS食品的摄入对一些诱发或加重糖尿病的因素,如空腹和餐后葡萄糖反应增加、胰岛素敏感性下降、肥胖等,有着十分良好的生理功能,在延迟T2D发病方面比药物干预更有效[56]。
在目前的研究报告中,已经证明食用高RS的食物,如高RS饼干、黑麦面包、糙米、高RS百吉饼、纤维松饼[57-60]等,与食用普通淀粉的食物相比,能够显著减少空腹和餐后血糖水平,改善血浆中胰岛素水平。且摄入高RS的食物可能会降低人体对随后一餐的血糖反应,即“第二餐效应”。这可能由于RS的GI较低,在摄入高RS食物后,餐后血糖波动较小,从而稳定血糖水平。因此,用RS代替普通膳食淀粉有助于糖尿病的预防和治疗[61]。摄入高RS的食物后,由于RS消化率低,能量相对较少,使脂肪的利用增加,积累减少,这将有助于缓解肥胖,进而预防糖尿病的发生[62]。同时也发现RS可能会一定程度上影响人们的食欲,这也可能是体质量下降的影响因素[63]。
4.2 提高胰岛素敏感性
对糖尿病动物模型的研究显示,RS的积极作用不仅是控制体质量和血糖水平。Matsumoto等[64]对糖尿病小鼠喂食wx/ae稻米(一种高RS的杂交稻米)12 周后,与喂食普通糙米的小鼠相比,空腹血浆三酰甘油和非酯化脂肪酸含量较低,且注射胰岛素后,喂食wx/ae稻米的小鼠血糖下降更为显著。Johnston等[65]的研究也表明高RS饮食的糖尿病小鼠血糖恢复率显著降低,胰岛素恢复率也显著降低,这可能是因为高RS饮食提高了糖尿病小鼠的胰岛素敏感性。高RS食物对胰岛素敏感性的提高也合理解释了“第二餐效应”的发生。
4.3 调控肠道激素
有研究表明,R S 对人体糖尿病的预防和缓解并不是通过肠道微生物菌群的发酵作用影响,而是通过对胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和肠肽YY(peptides YY,PYY)分泌产生影响[66-67],在食用黑麦面包后的1 2 0 m i n 内,与普通淀粉面包相比,人体餐后血糖水平和胰岛素反应显著降低,血浆中P Y Y 水平显著提高[68],Goldsmith等[69]的研究也表明高RS饮食后小鼠血清中GLP-1的活性提高,说明RS可通过GLP-1介导的途径促进胰岛素的分泌,进而控制糖尿病大鼠的血糖水平。在对葡萄糖和脂代谢途径相关基因的分析也证明了这一点,同时发现脂质氧化基因(acyl-coenzyme A oxidase 1,Acox 1)、糖原合成基因((glycogen synthesis2,GS2)、(glycogenin-1,GYG-1))和胰岛素诱导基因((insulin inducible gene,Insig)-1、Insig-2)的表达水平均显著上调,相反,脂肪酸和甘油三酯的合成和代谢相关基因(sterol regulatory element binding peptide-1,SREBP-1)、脂肪酸合成基因(fatty acid synthesis-1,Fads-1)和糖异生基因(glucose-6-phosphatase catalysis-1,G6PC-1)表达水平明显下调,这合理解释了高RS饮食的小鼠对胰岛素敏感性改变的原因[70-71]。
4.4 缓解炎症发展
另有研究表明,RS的作用还可归因于修复受损的胰腺B细胞,下调血清中C反应蛋白、TNF-α、白细胞介素以及核因子-κ-结合基因等炎症基因的表达[72-73],从而使患者炎症得以缓解。这降低了肾小球的损伤,增强了肾小球的重吸收功能,缓解了糖尿病的发展,与Bahram等[74]的研究结果一致。同时,这也解释了RS对CKD预防和缓解作用的机制。RS对糖尿病预防和调节综合作用见图3。
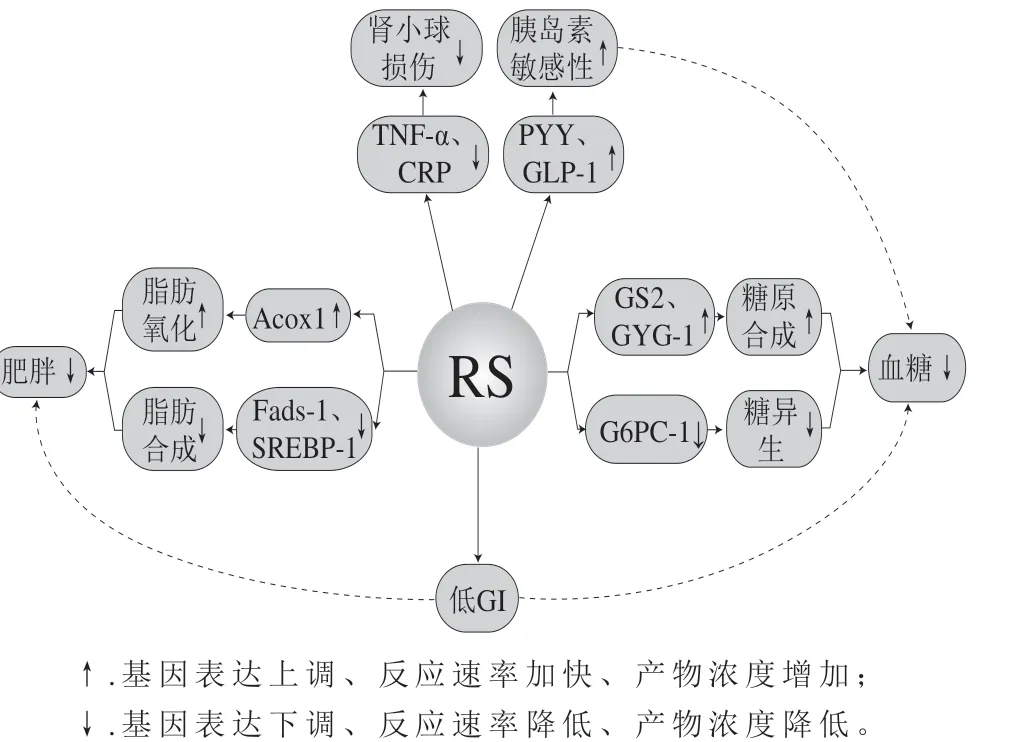
图3 RS对糖尿病的预防和调节作用Fig. 3 Effect of RS on the prevention and regulation of diabetes
5 结 语
RS作为一种来源广泛且口感温和的健康食品,在调节饮食平衡、预防营养疾病等方面有着重要作用。迄今为止,RS已被证实对CRC、T2D、CKD等疾病有预防和缓解作用,其作用机理也逐渐被阐明。RS对人体健康的作用方式主要有3 种:1)作为抗消化、饱腹感强的食物,通过低消化性、低能量及低GI等特点有效防止糖尿病、肥胖等疾病;2)作为可发酵膳食纤维进入人体肠道后,通过对肠道微生物菌群的调控作用,促进益生菌的生长,保护肠道上皮细胞,进而预防肠道炎症、提高肠道屏蔽功能;3)经肠道菌群发酵后,产生的丁酸、丙酸等SCFAs是肠道上皮细胞的主要能量来源,并通过参与细胞代谢、调控基因表达等多种途径发挥作用。
然而,目前国内对RS的研究多集中于其制备方法、生产低能量食物及调控肠道菌群等方面,对其进一步发酵后产生的SCFAs并发挥细胞水平调控作用的研究相对较少。同时还有以下问题亟待解决:1)有关RS的研究大多基于普通食物与高RS饮食,但由于RS吸收率较低,其摄入的能量存在差异,长期研究存在能量摄入、肥胖等因素干扰,对其作用机理的探究可能存在一定影响,因此,在研究中有必要控制摄入能量的一致性。2)高RS食品对营养失衡引起慢性疾病的研究多见于糖尿病、CKD和肠道疾病等,对其他慢性病潜在的积极作用报道较少。由饮食引起的慢性疾病通常伴随着一系列并发症,针对性地对其他慢性疾病及其并发症进行深入研究是今后的重点。3)目前的研究大多采用单一的高RS食品与普通食物进行探究,对不同类型RS的生理功能及其影响是否存在差异鲜见报道。由于RS来源广泛,其制备方法及价格有所差异,对不同类型的RS生理功能进行比较将会是下一步的研究方向。4)高RS食品多种多样,其加工过程也存在差异,不同加工过程及其他食品物料对RS的结构及生理功能的影响也有待研究。
