布拉氏酵母菌联合阿奇霉素序贯治疗肺炎支原体肺炎继发腹泻患儿的效果及对康复进程、肠道菌群的影响*
2020-11-26何玮莫坤梅陈雨彬
何玮 莫坤梅 陈雨彬
在儿科疾病中,小儿肺炎支原体肺炎(Mycoplasmal pneumoniae pneumonia,MPP) 发病频率较高,其主要与肺炎支原体(Mycoplasmal pneumoniae,MP)感染有关,是一种非典型肺炎,临床表现为咳嗽、发热、气促等症状,且严重程度轻重不一,严重时甚至出现缺氧症状和呼吸困难表现[1]。MP 是一种无细胞壁的微生物,且对作用于细胞壁的抗菌药物有天然耐药性,抑制蛋白质合成的抗生素对其有显著临床疗效,其中阿奇霉素属大环内酯类抗生素,具有半衰期长、安全性高的优势,是目前临床治疗MPP 的首选药物[2]。MPP 患儿常继发腹泻症状,有统计表明其发生率25.00%~52.90%,不仅增加患儿身体病痛,也增加治疗难度,因而对MPP 患儿进行有效预防、干预继发性腹泻有重大意义,也是目前的临床研究热点[3-4]。布拉氏酵母菌散是一种口服微生态制剂,属于外源性益生菌,无显著毒副反应,对于维护肠道菌群微生态平衡中有重要意义[5]。本研究采用布拉氏酵母菌联合阿奇霉素序贯治疗MPP 继发腹泻患儿,旨以观察其对临床疗效、康复进程及肠道菌群的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2017 年7 月-2020 年1 月本院收治的90 例MPP 患儿为研究对象。纳入标准:符合MPP 的诊断标准[6],即以咳嗽、发热、气促为主要症状,血清肺炎支原体(MP)IgM 或IgG检测呈阳性,大便呈蛋花汤样或米汤样改变,次数≥5 次/d。排除标准:(1)近6 个月有肠道疾病史;(2)合并营养不良、中重度脱水或肝肾功能异常等,有明显缺氧症状;(3)有阿奇霉素过敏史;(4)既往有影响肠道菌群的药物治疗史。按照随机数表法分为观察组(n=45)和对照组(n=45)。患儿家属对本研究目的知情且同意,本研究经上级医院伦理委员会批准。
1.2 方法 两组均常规给予退热、化痰、止咳、纠正水电解质紊乱、营养支持等治疗。(1)对照组给予阿奇霉素序贯治疗,注射用阿奇霉素[生产厂家:山东罗欣药业集团股份有限公司,批准文号:国药准字H20065406,规格:0.25 g(25 万单位)],剂量根据10 mg/kg 计算,1 次/d,连续治疗5 d 后停药4 d,改为阿奇霉素干混悬剂[生产厂家:辉瑞制药有限公司,批准文号:国药准字H10960112,规格:0.1 g(按C38H72N2O12计)]口服,剂量根据10 mg/kg 计算,连续治疗5 d 后间隔4 d 为一个疗程,治疗2 个疗程,共计36 d。(2)观察组在对照组基础上给予布拉氏酵母菌散[生产厂家:法国BIOCODEX 公司,注册证号:S20150051,规格:0.25 g(菌粉)/袋]温水冲服,3 岁以下患儿250 mg/次,1 次/d;3 岁以上患儿250 mg/次,2 次/d。连续治疗至阿奇霉素序贯治疗结束。
1.3 观察指标与评价标准 观察比较两组康复进程指标、临床疗效、肠道菌群失调情况及不良反应情况。(1)康复进程指标,包括脱水纠正时间、退热时间、腹泻持续时间及住院时间。(2)临床疗效评价标准,显效:治疗3 d 内,发热、咳嗽、气促、腹泻等症状完全消失,1 周后肺部X 线片提示正常;有效:治疗3 d 后体温恢复正常,咳嗽、气促、腹泻等症状明显改善,2 周后肺部X 线片提示正常;无效:临床症状无改善或加重,肺部X 线片仍有阴影[7]。总有效=显效+有效。(3)肠道菌群失调情况。治疗结束后以无菌容器采集患儿新鲜粪便,将其涂抹于洁净载玻片上行革兰染色,记录两组肠道菌群失调情况。根据文献[8]肠道菌群失调严重程度分为Ⅰ~Ⅲ度,其中Ⅰ度代表轻度菌群失调,即革兰阳性(G+)杆菌低于正常值,G+球菌高于正常值,细菌总数轻度改变或处于正常值范围内;Ⅱ度代表中度菌群失调,即G+杆菌明显减少,革兰阴性(G-)杆菌增多90%以上,且细菌总数明显减少;Ⅲ度代表重度菌群失调,即细菌数目减少,且原有菌群大部分被抑制,仅有一种细菌占绝对优势。(4)不良反应(恶心、腹泻、皮疹等)发生情况。
1.4 统计学处理 采用SPSS 20.0 软件对所得数据进行统计分析,计量资料以()表示,组间比较采用独立样本t 检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 观察组男23 例,女22 例;年龄5 个月~12 岁,平均(5.85±1.06)岁;病程3~14 d,平均(8.42±2.50)d。对照组男25 例,女20 例;年龄6 个月~12 岁,平均(6.06±1.18)岁;病程3~15 d,平均(8.61±2.60)d。两组一般资料对比,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组康复进程指标比较 观察组脱水纠正时间、退热时间、腹泻持续时间及住院时间均短于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组康复进程指标比较[d,()]

表1 两组康复进程指标比较[d,()]
2.3 两组临床疗效比较 观察组临床治疗总有效率高于对照组,差异有统计学意义(χ2=4.406,P=0.036),见表2。

表2 两组临床疗效比较 例(%)
2.4 两组肠道菌群失调情况比较 观察组Ⅰ度、Ⅱ度、Ⅲ度肠道菌群失调率均低于对照组,但差异均无统计学意义(P>0.05);观察组肠道菌群总失调率低于对照组,差异有统计学意义(P<0.05)。见表3。
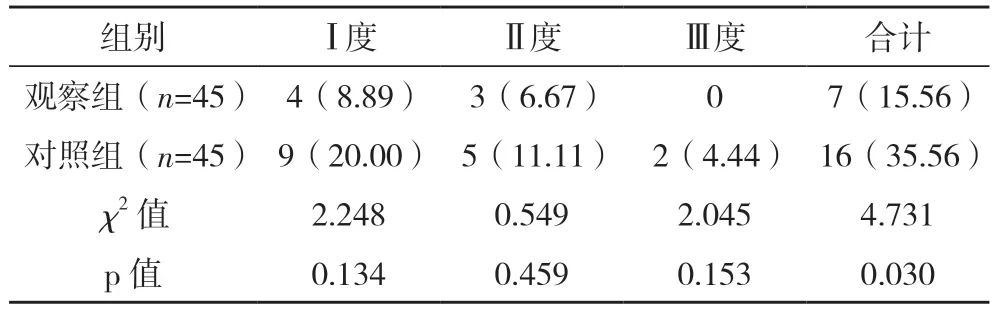
表3 两组肠道菌群失调情况比较 例(%)
2.5 两组不良反应发生情况比较 两组患者均未明显发生恶心、皮疹、腹泻等不良反应。
3 讨论
阿奇霉素是治疗MPP 患儿的一线药物,不良反应少,进入机体后吸收好,扩散快且血药浓度稳定,经吞噬细胞摄取后释放至感染部位,通过与MP 核糖体50S 亚基相结合从而阻断转肽过程,RNA 蛋白质合成受阻,进而抑制MP 增殖[9-10]。MPP 患儿合并继发性腹泻在治疗过程中较为常见,文献[11-13]研究报道,MPP 继发性腹泻的病因主要为以下三点:(1)内源菌感染:抗生素灭菌治疗的同时,肠道菌群的生长受到影响,其中有害致病菌如梭状芽孢杆菌、金黄色葡萄球菌等大量增殖,有益菌如乳酸菌等数量减少,因环境改变导致条件致病菌变为致病菌,内源菌菌群紊乱损害肠黏膜导致腹泻。(2)抗生素直接作用:自青霉素问世以来,大量感染性疾病得以痊愈,但抗生素属于“双刃剑”,在治疗的同时也会带来各种不良反应,如抗生素相关性腹泻(AAD),抗生素直接刺激肠黏膜导致黏膜上皮损伤及纤毛组织萎缩,从而导致腹泻。有研究报道,大环内酯类抗生素引起的ADD 发生率达18%,且患者年龄愈小,发生率愈高[14]。(3)肠道生理结构改变:儿童免疫与消化系统发育尚不成熟,MP 感染后免疫力下降,导致正常菌群定植力下降,平衡肠道菌群微生态环境的能力减弱,易受到各种理化因素影响后发生腹泻。因此,MPP 患儿在进行阿奇霉素治疗时,发生继发性腹泻的风险可增加,原有腹泻症状可加重。目前,临床上尚无公认的可高效预防MPP 继发性腹泻发生的有效措施或防治药物。
布拉氏酵母菌散属于生理性活菌真菌制剂,来源于机体肠道正常菌群,经处理后已无致病性。布拉氏酵母菌对胃肠道黏膜黏附性较强,随温水冲服后可定植于肠道黏膜,一方面可耐受胃酸、胆盐、胃蛋白水解酶等,进而成为胃肠道黏膜的保护屏障,另一方面可消耗氢气、分解过氧化氢从而促进有益菌如乳酸菌、大肠杆菌等繁殖;布拉氏酵母菌可直接黏附于致病菌以抑制生长增殖,分泌的蛋白磷酸酶、糖蛋白等可中和致病菌产生的内毒素,避免肠黏膜受到内毒素等的损伤;布拉氏酵母菌可修复受损的肠黏膜,其分子结构含多胺成分,代谢过程中可产生多种维生素,还可增加肠黏膜上皮细胞内双糖酶含量,可为机体合成氨基酸提供能量和基础物质,还可避免乳糖积滞而加剧腹泻[14-15]。另有研究表明,布拉氏酵母菌可有效预防ADD 发生,再者因其为真菌,故而不存在质粒,耐药菌无法将含有耐药基因的质粒通过真菌传导给正常菌群,因此布拉氏酵母菌还具有天然耐抗生素特征,相比其他益生菌可与抗生素同时长期应用[16-17]。
本研究结果中,观察组脱水纠正时间、退热时间、持续腹泻时间及住院时间均显著短于对照组(P<0.05),临床治疗总有效率明显较对照组高(P<0.05)。表明布拉氏酵母菌联合阿奇霉素序贯治疗合并继发性腹泻的MPP 患儿,相比单用阿奇霉素序贯治疗方法可取得更佳的临床效果,发热、腹泻、脱水等症状更早缓解,康复更快,同文献[18-19]研究结果一致。另根据本研究观察,观察组患儿肠道菌群失调程度显著低于对照组(P<0.05),两组均未出现明显不良反应。表明布拉氏酵母菌联合阿奇霉素序贯治疗可有效纠正肠道菌群微生态平衡,结合前文临床治疗效果显著升高,提示该联合治疗方式是通过改善肠道菌群失调来减少腹泻的发生,且有一定的安全性,在提升疗效的同时不会显著增加不良反应,文献[20-21]也与本文观点相似。
综上所述,采用布拉氏酵母菌联合阿奇霉素序贯治疗MPP 继发腹泻患儿,可显著改善患儿临床症状,缩短持续腹泻及住院时间,促进康复,同时可纠正肠道菌群失调,且不会增加不良反应发生风险。
