草乌甲素通过调节TRPV1受体功能减轻神经病理性疼痛大鼠疼痛的机制
2020-11-26魏建忠寇士顺
魏建忠, 王 云, 寇士顺
(1.北京时珍堂中西医结合医院麻醉科, 北京 100071 2.首都医科大学附属北京朝阳医院麻醉科, 北京 100020 3.北京中医医院麻醉科, 北京 100010)
神经性疼痛可能由外周或中枢神经系统的损伤,炎症或疾病引起,其特征在于自发性疼痛(即持续性,阵发性)和痛觉过敏或异常性疼痛形式诱发性致敏[1,2]。瞬时受体电位香草酸亚型1(The transient receptor potential vanilloid type 1,TRPV1),是一种非选择性阳离子通道,由辣椒素,树脂毒素等外源物激活[3,4];内源性而言,TRPV1通过高温、酸性pH、N-花生四烯酰乙醇胺、ATP,脂氧合酶产物和单酰基甘油打开。TRPV1作为外周和中枢神经系统中化学和有害热刺激的分子整合剂,能确定机体对伤害的反应[5,6]。TRPV1可用作选择性兴奋性阻断剂的载体,特异性阻断疼痛神经纤维传导也通过选择性抑制TRPV1的表达来实现,例如非渗透性钠通道阻滞剂N-(2,6-二甲基苯基氨基甲酰基甲基)[7,8]。草乌甲素是二萜类生物碱,自发现以来一直用于治疗慢性疼痛,如癌症晚期疼痛、良性关节痛、腰及四肢关节扭伤、挫伤、腰肌劳损及腰背痛等[9]。本研究拟探讨草乌甲素通过调节TRPV1受体功能减轻神经病理性疼痛大鼠疼痛的机制,为神经病理性疼痛的治疗提供理论依据。
1 材料与方法
1.1主要药物、试剂与仪器:草乌甲素(原料药,纯度99%,重庆赛普那斯科技有限公司,批号10769-003);地塞米松(原料药,纯度98%,武汉贝尔卡生物医药有限公司,批号LM190317);QuickPrepMicro mRNA纯化试剂盒、SYBR Green RT-PCR试剂盒(上海碧云天生物技术有限公司,批号65415、63127);抗生物素蛋白-生物素复合物试剂盒(上海玉博生物科技有限公司,批号180613);磷酸盐缓冲盐水(PBS)、大鼠抗TRPV1一抗、Tween-20(PBST)试剂(美国sigma公司,批号SA1135、SA2017、SA3249);CAS试剂盒(上海斯信生物科技有限公司,批号20180519);生物素化的二抗山羊抗大鼠(美国Thermo Fisher Scientific公司,批号ab33247);Fas、半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-6(Caspase-6) ELISA试剂盒(美国R&D Systems公司,批号:QA698126、MJ471369、OI479512);Electric Von Frey型电子测痛仪(天津仪数科技有限公司);7370型足底测试仪(北京拜安吉科技有限公司);QuantStudio5型实时荧光定量PCR仪(美国ABI公司);CM3050S型冷冻切片机(德国Leica公司)。
1.2动物饲养及分组:成年SPF级别SD大鼠由昆明医科大学实验动物中心提供,6~8周龄,体重212.36~24.63g,动物生产许可证号:SCXK(云)2018-0017,动物使用许可证号:SYXK(云)2018-0016,动物质量合格证号:20180347,在无特定病原体(Specific Pathogen Free,SPF)环境中单笼喂养,温度受控为(24±1)℃,湿度受控为(50%~60%),光/暗循环为12:12h。所有动物实验程序均经本院动物伦理委员会批准,并按照美国国立卫生研究院关于动物护理的指导原则和有意识动物实验性疼痛调查的伦理指南进行。所有大鼠在进入试验前1周随机分成3组:对照组、模型组、地塞米松、草乌甲素低、高剂量组、每组20只,雌雄各半,动物自由摄取饲料、自由饮水。
1.3各实验组的制备:各组大鼠禁食、禁水12h,进行L5-脊神经结扎。模型组、地塞米松组、草乌甲素低、高剂量组在氟烷(2%)麻醉下,脊柱左侧附近L5脊神经与粘附的组织分离,用四个6-0丝线松散结扎,结扎间距离约1mm,术后缝合肌肉皮肤层。随后按照Decosterd和Woolf描述的程序进行神经损伤程序[10],在麻醉下,分离股二头肌,暴露左侧坐骨神经及其3个末端分支,将普通腓骨和胫神经用6-0丝线缝合,并在结扎的远端横切,移除3~5mm的神经部分,在手术过程中保持腓肠神经完整,避免与神经接触,注意预防感染并尽量减少炎症的影响。对照组大鼠的L5脊神经同样暴露但未结扎,并缝合皮肤层和肌肉。草乌甲素组大鼠于造模成功第1天开始给予相应药物鞘内注射(注射体积:1.0mL/100g),具体操作流程为:在麻醉下,在L5和L6椎骨之间插入26G规格的针头,注入不同剂量草乌甲素(40、80mg/kg;预实验求出草乌甲素LC50为160mg/kg,以1/2 LC50为高剂量,2倍间距为低剂量),每天1次,持续给予3周,地塞米松组注入地塞米松(40mg/kg;预实验求出地塞米松LC50为80mg/kg,以1/2 LC50为有效剂量组),对照组和模型组鞘内注射给予等体积生理盐水。
1.4机械痛阈值、热痛阈、疼痛加权评分的测定:Electric Von Frey电子测痛仪触压大鼠左足第3、4趾间的皮肤,测定机械痛阈值。使用7370足底测试仪测试热痛,将玻璃地板下面的辐射热源瞄准在后爪足足跟底表面上的的脂肪部分,在实验开始时调节光的强度,使得平均基线潜伏期为约22s并且施加25s的截止潜伏期。在每个测试阶段中对每个后爪进行四次潜伏期测量,在连续测试之间至少间隔5min交替测试每只后爪,将每侧潜伏期的4次测量平均值作为每次测试的结果。PIS评分=(TⅡ+2×TⅢ+3×TⅣ)÷300,其中TⅡ、TⅢ、TⅣ分别为5min内出现Ⅱ、Ⅲ、Ⅳ级的时间(s)。足掌轻微接触玻璃缸面,活动时有跛行为Ⅱ级;足抬起,不接触玻璃缸面为Ⅲ级;大鼠舔咬注射足或抽动为Ⅳ级。
1.5TRPV1 mRNA在脊髓组织中表达的测定:根据制造商的说明书使用QuickPrepMicro mRNA纯化试剂盒通过单步骤异硫氰酸胍方法分离总RNA,使用逆转录系统反转录成cDNA。通过使用SYBR Green RT-PCR试剂盒进行TRAP1基因表达的PCR分析,TRPV1的引物序列是(F):5'-GACGCACCGCTCAACAT-3'和(R):5'-CACATCAAACATGGACGGTTT-3'。GAPDH用作内部对照,其引物序列为(F):5'-AGGTCGGTGTGAACGGATTTG-3'和(R):5'-TGTAGACCATGTAGTTGAGGTCA-3'。所有引物均由深圳华大基因股份有限公司纯化和合成。实时PCR循环条件是95℃持续30s的一个循环,接着是95℃持续5s和60℃持续34s的40个循环。2-△△Ct法计算TRPV1 mRNA水平。
1.6TRPV1 蛋白在脊髓组织中表达的测定:实验结束后进行椎板切除术解剖脊髓的L5-6区段,并在4%多聚甲醛中固定6h,之后将它们在4℃下浸入30%蔗糖中48h。在冷冻切片机上将冷冻组织切成3mm的厚度。使用抗生物素蛋白-生物素复合物方法处理组织切片用于免疫染色。具体操作步骤为:将切片用0.05M磷酸盐缓冲盐水(PBS)洗涤,并在3%过氧化氢中温育10min。漂洗后,将切片用CAS块在室温下封闭10min,然后在4℃下在PBS中与大鼠抗TRPV1一抗(1:500)孵育过夜。用含有Tween-20(PBST)的PBS依次冲洗切片,然后在室温下与生物素化的二抗山羊抗大鼠(1:1000)一起温育2h,并用于定量TRPV1蛋白表达。
1.7大鼠脊髓Fas、Caspase-3、Caspase-6蛋白表达水平的测定:快速收获L5脊髓背角的背侧象限并在PBS中匀浆,然后在4℃下以13000×g离心15min,收集上清液用于测量Fas、Caspase-3、Caspase-6的浓度,使用相应的ELISA试剂盒。

2 结 果
2.1各组大鼠机械痛阈值、热痛阈、PIS评分的比较:与对照组比较,模型组机械痛阈值、热痛阈降低,PIS评分升高(P<0.05);与模型组比较,地塞米松组、草乌甲素各剂量组机械痛阈值、热痛阈升高,PIS评分降低(P<0.05),且草乌甲素高剂量组机械痛阈值、热痛阈高于草乌甲素低剂量组(P<0.05),PIS评分低于草乌甲素低剂量组(P<0.05);与地塞米松组比较,草乌甲素低、高剂量组机械痛阈值、热痛阈降低,PIS评分升高(P<0.05),见表1。

表1 各组大鼠机械痛阈值热痛阈PIS评分的比较
2.2各组大鼠脊髓组织HE染色比较:对照组脊髓区神经元细胞结构正常,染色清晰;模型组脊髓区可见大量坏死神经元,可见炎症细胞浸润;地塞米松组及草乌甲素高剂量组炎症细胞浸润减少,神经元细胞坏死程度减轻;草乌甲素低剂量组仍可见明显脊髓破坏,见图1。

图1 各组大鼠右侧脊髓组织HE染色比较(400×)
2.3各组大鼠脊髓TRPV1 mRNA表达水平比较:与对照组比较,模型组TRPV1 mRNA水平升高(P<0.05);与模型组比较,地塞米松组、草乌甲素各剂量组TRPV1 mRNA水平降低(P<0.05),且草乌甲素高剂量组TRPV1 mRNA水平低于草乌甲素低剂量组(P<0.05);与地塞米松组比较,草乌甲素低、高剂量组TRPV1 mRNA水平升高(P<0.05),见表2。

表2 各组大鼠脊髓TRPV1 mRNA表达水平比较
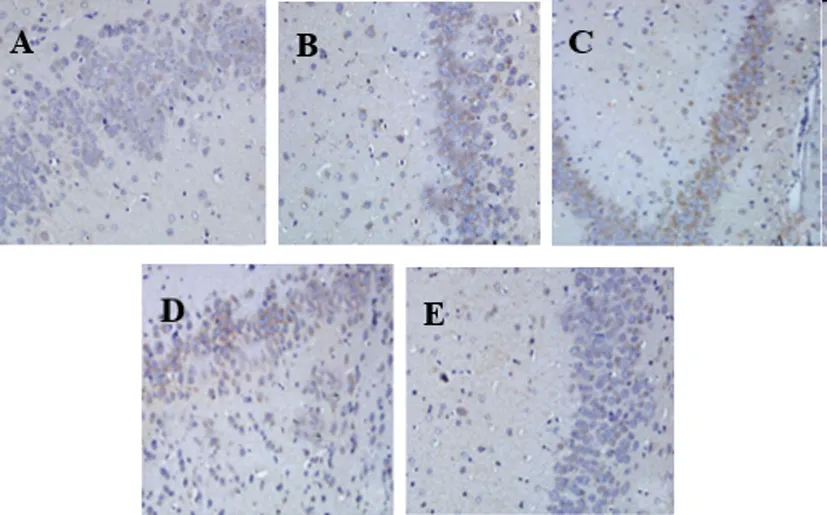
图2 草乌甲素对各组大鼠脊髓部TRPV1表达的影响(400×)

表3 各组大鼠脊髓TRPV1蛋白表达水平比较
2.4各组大鼠脊髓TRPV1 蛋白表达水平比较:免疫组化法下,TRPV1 主要定位于胞核,其阳性表达为棕褐色,见图2。与对照组比较,模型组TRPV1蛋白水平升高(P<0.05);与模型组比较,地塞米松组、草乌甲素各剂量组TRPV1 蛋白水平降低(P<0.05),且草乌甲素高剂量组TRPV1 蛋白水平低于草乌甲素低剂量组(P<0.05);与地塞米松组比较,草乌甲素低、高剂量组TRPV1 蛋白水平升高(P<0.05),见表3。
2.5各组大鼠脊髓Fas、Caspase-3、Caspase-6蛋白表达水平比较:与对照组比较,模型组Fas、Caspase-3、Caspase-6蛋白水平升高(P<0.05);与模型组比较,地塞米松组、草乌甲素各剂量组Fas、Caspase-3、Caspase-6蛋白水平降低(P<0.05),且草乌甲素高剂量组Fas、Caspase-3、Caspase-6蛋白水平低于草乌甲素低剂量组(P<0.05);与地塞米松组比较,草乌甲素低、高剂量组Fas、Caspase-3、Caspase-6蛋白水平升高(P<0.05),见表4。

表4 各组大鼠脊髓Fas Caspase-3 Caspase-6蛋白表达水平比较
3 讨 论
草乌甲素已应用于诸多神经病变疼痛中,如三叉神经痛,疼痛性糖尿病神经病变,复杂区域疼痛综合征(CRPS)和带状疱疹后神经痛。草乌甲素对神经系统和神经性疼痛的作用正在被认识到[11]。研究表明,草乌甲素对含乙酰胆碱的神经末梢具有选择性,通过切割突触体相关蛋白SNAP-25抑制突触前囊泡中的乙酰胆碱释放,体内和体外实验的新证据表明草乌甲素对神经调节剂和发射体的释放具有许多额外的抑制作用,这对神经传递感觉通路至关重要。在背根神经节(DRG)的神经元中,草乌甲素抑制蛋白激酶C(PKC)介导的可溶性N乙基马来酰亚胺敏感因子附着蛋白受体(SNARE)依赖性胞外分泌瞬时TRPV1至质膜。人体研究进一步证明草乌甲素可减少由辣椒素(一种TRPV1受体激动剂)诱导的疼痛和神经源性炎症[12,13]。本次试验结果表明,与模型组比较,地塞米松组、草乌甲素各剂量组机械痛阈值、热痛阈升高,PIS评分降低,且草乌甲素高剂量组机械痛阈值、热痛阈高于草乌甲素低剂量组,PIS评分低于草乌甲素低剂量组;这与上述讨论符合,同时也说明草乌甲素能明显减轻神经病理性疼痛大鼠疼痛。结合各组大鼠脊髓组织HE染色,结果显示,对照组脊髓区神经元细胞结构正常,染色清晰;模型组脊髓区可见大量坏死神经元,可见炎症细胞浸润;地塞米松组及草乌甲素高剂量组炎症细胞浸润减少,神经元细胞坏死程度减轻。这说明草乌甲素能减轻神经元细胞损伤坏死。
本研究同时探讨了草乌甲素对脊髓神经元凋亡作用的影响,其结果显示草乌甲素能明显抑制脊髓神经元凋亡。研究已证实TRPV1通道在伤害性和神经性疼痛中的核心作用。TRPV1在小直径感觉传入C纤维和Ad纤维中表达,这些神经纤维包含各种神经肽,如P物质和/或降钙素基因相关肽;TRPV1也存在于中枢神经系统(CNS)和非神经元组织中[14]。在神经损伤引起的热痛觉过敏和糖尿病神经病变期间,均发现TRPV1的表达水平明显升高。本次研究结果表明,地塞米松组、草乌甲素各剂量组TRPV1 mRNA和蛋白水平低于模型组,且草乌甲素高剂量组TRPV1 mRNA和蛋白水平低于草乌甲素低剂量组;这与上述讨论符合,同时也提示草乌甲素能抑制TRPV1的表达。草乌甲素抑制TRPV1受体/通道表达的机制尚不完全清楚,但可能与其阻断神经元胞吐作用的能力有关。据报道[15],TRPV1通道向神经元表面的活性依赖性递送可能有助于外周伤害感受器终端中热性痛觉过敏的累积和维持。草乌甲素可阻断由佛波酯或代谢型谷氨酸受体mGluR5激活的PKC诱导的TRPV1膜易位,因为TRPV1的轴突表达取决于与SNARE复合物的蛋白质的相互作用,草乌甲素可导致SNAP-25复合物的去稳定化因此抑制TRPV1对细胞表面的SNARE依赖性胞吐作用,降低周围神经轴突中的TRPV1表达。本研究同时探讨了草乌甲素对大鼠脊髓凋亡蛋白Fas、Caspase-3、Caspase-6蛋白的影响,结果显示,草乌甲素可抑制大鼠脊髓凋亡蛋白Fas、Caspase-3、Caspase-6表达,提示草乌甲素抑制脊髓神经元凋亡。
综上所述,草乌甲素能减轻大鼠神经病理性疼痛,其机制与草乌甲素抑制TRPV1受体功能进而抑制脊髓神经元凋亡有关。
