光谱法研究高效氯氰菊酯与牛血清白蛋白的相互作用
2020-11-25孙丽莉张朝陈刚彭晓萌谢映松胡立中葛少林
孙丽莉, 张朝, 陈刚, 彭晓萌, 谢映松, 胡立中, 葛少林
光谱法研究高效氯氰菊酯与牛血清白蛋白的相互作用
孙丽莉, 张朝, 陈刚, 彭晓萌, 谢映松, 胡立中, 葛少林
(烟草化学安徽省重点实验室, 安徽 合肥, 230088)
在模拟生理条件下, 应用光谱法研究烟草农药残留与蛋白质相互作用机理, 为烟草中农药残留在人体中代谢过程、解毒和指导科学使用农药提供理论依据。结果表明: 高效氯氰菊酯与牛血清白蛋白作用机理为静态猝灭; 两者通过氢键和范德华力形成1︰1结合, 且结合距离为3.95 nm; 298和310 K时的结合常数分别为4.17 × 103和3.16 × 103L·mol-1, 结合强度紧密; 同步荧光和圆二色谱证实高效氯氰菊酯影响牛血清白蛋白构象, 使BSA分子-螺旋结构含量减小。
荧光光谱; 圆二色谱; 同步荧光; 高效氯氰菊酯; 牛血清白蛋白
烟叶种植生产中, 由于安全意识淡薄, 农药时有被过量使用, 导致农药残留风险增加。残留的农药可通过空气、食物链等被人体吸收, 与人体中蛋白质反应引起急性中毒, 严重的可导致死亡[1]。目前, 烟叶中农药残留检测和降解方法研究较多, 对农药在生物体内的转运、代谢和中毒机制研究较少, 因此农药与生物体蛋白质的机理研究是目前的研究重点。高效氯氰菊酯(β-CP, 结构见图1)是一种杀虫广谱、生物活性高、高效低毒拟除虫菊酯类杀虫剂[2], 被广泛用于防治烟叶植物害虫。牛血清白蛋白(BSA)是血浆中含量最丰富的载体蛋白, 常被用作蛋白质模型[3]。本文在模拟生理条件下, 运用光谱法研究牛血清白蛋白和高效氯氰菊酯的作用机理, 以期从分子角度分析研判β-CP在生物体内的活性机制, 为研制低毒高效烟草农药、解毒方法和安全使用农药提供理论参考。
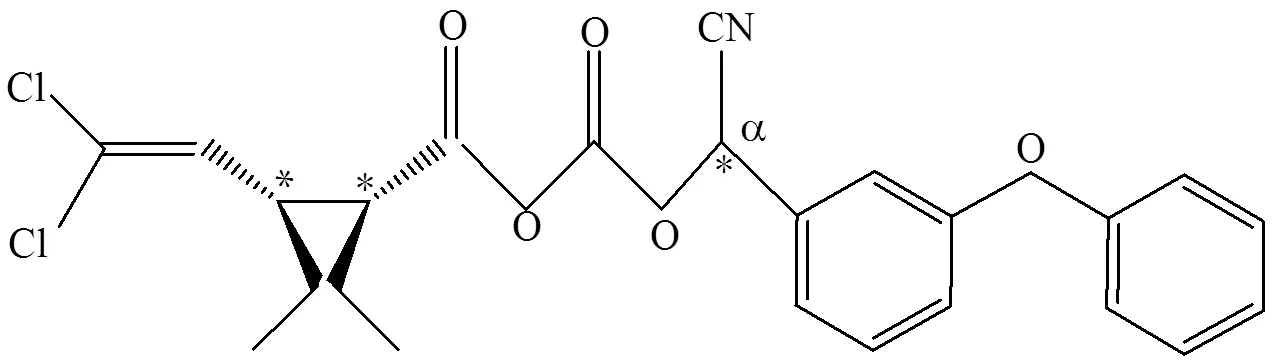
图1 高效氯氰菊酯结构式
1 材料与方法
1.1 实验试剂
高效氯氰菊酯(纯度98%, 阿拉丁); 牛血清白蛋白(纯度>98%, 阿拉丁); NaCl(分析纯, 国药集团试剂公司); pH = 7.4 Na2HPO4-KH2PO4缓冲溶液; 无水乙醇(安徽安特生物化学有限公司); 二次蒸馏水。
1.2 实验仪器
F-4500 荧光分光光度计(日立公司); UV-757CRT紫外可见分光光度计(上海精密科学仪器有限公司); Jasco-20c圆二色谱仪(日本岛津公司)。KQ-500DE超声波发生器(昆山市超声仪器有限公司); AL-204-IC电子天平(感量0.000 1 g, 瑞士Mettler Toledo公司)。
1.3 实验方法
1.3.1 荧光光谱分析
用移液管准确移取1 mL BSA溶液(1.0×10-5mol/L)、1 mL Clark-lubs缓冲溶液(pH 7.40)、1 mL NaCl溶液(0.1 mol/L)于10 mL比色管中, β-CP溶液(1.0×10-4mol/L)依次取0、0.5、1.0、1.5、2.0和2.5 mL, 用二次蒸馏水定容到10 mL, 分别在298和310 K温度下水浴反应15 min, 立即进行荧光测定。
荧光光谱: 在280 nm激发波长下, 扫描溶液300~500 nm的荧光发射光谱。调狭缝宽5 nm, 光电管负高压为400 V, 响应速度2.0 s, 扫描速度1 200 nm/min。
1.3.2 同步荧光
固定发射波长与激发波长差Δλ分别为60 nm和15 nm, 调节仪器参数: 波长范围240~360 nm, 光电管负高压400 V, 狭缝宽度5 nm, 扫描速度1 200 nm/min。
1.3.3 圆二色谱分析
将待测液置于1 mm石英吸收池中, 步幅1 nm, 扫描速度200 nm·min-1, 扫描250~350 nm范围内BSA与β-CP作用前后的CD光谱。
2 结果与讨论
2.1 β-CP与BSA相互作用荧光光谱
BSA的内源荧光由色氨酸、酪氨酸和苯丙氨酸三种荧光团组成, 但BSA 的荧光强度主要来源于色氨酸残基[4]。β-CP与BSA相互作用发生的荧光变化见图2。随着β-CP浓度的逐渐增加, BSA的最大发射峰由352 nm蓝移到344 nm, 最大荧光强度也规律性减小, 表明β-CP和BSA发生相互作用, BSA内源荧光被猝灭。
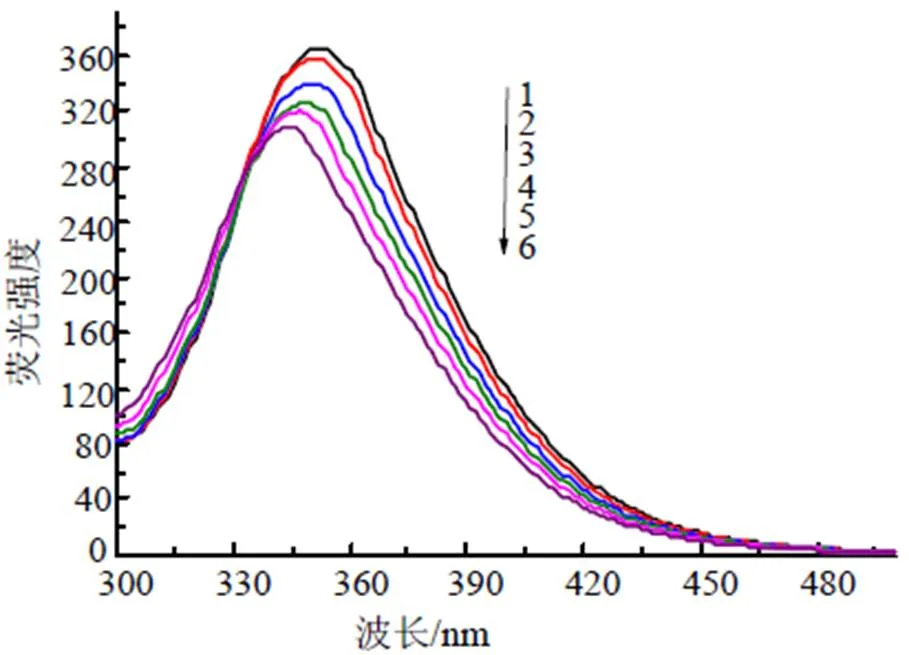
图2 β-CP与BSA相互作用荧光光谱
2.2 β-CP对BSA荧光猝灭机理
2.2.1 β-CP-BSA的动态猝灭常数(SV)
β-CP对BSA的内源荧光猝灭有动态猝灭和静态猝灭[5], 为明确β-CP对BSA的猝灭类型, 研究298和310 K温度下β-CP-BSA反应体系。假设体系是动态猝灭, 遵循Stern-Volmer[6]方程:0/=1+SV[]=1+q0,0为体系的原始荧光强度,为β-CP-BSA作用后的荧光强度; []是β-CP的摩尔浓度;SV是体系的动态猝灭常数;q为猝灭速率常数;τ是BSA的荧光寿命(一般取生物大分子荧光寿命的平均值10-8s[4])。图3是298和310 K下, 由Stern-Volmer方程作出的β-CP对BSA的猝灭图,sv和q值见表1。
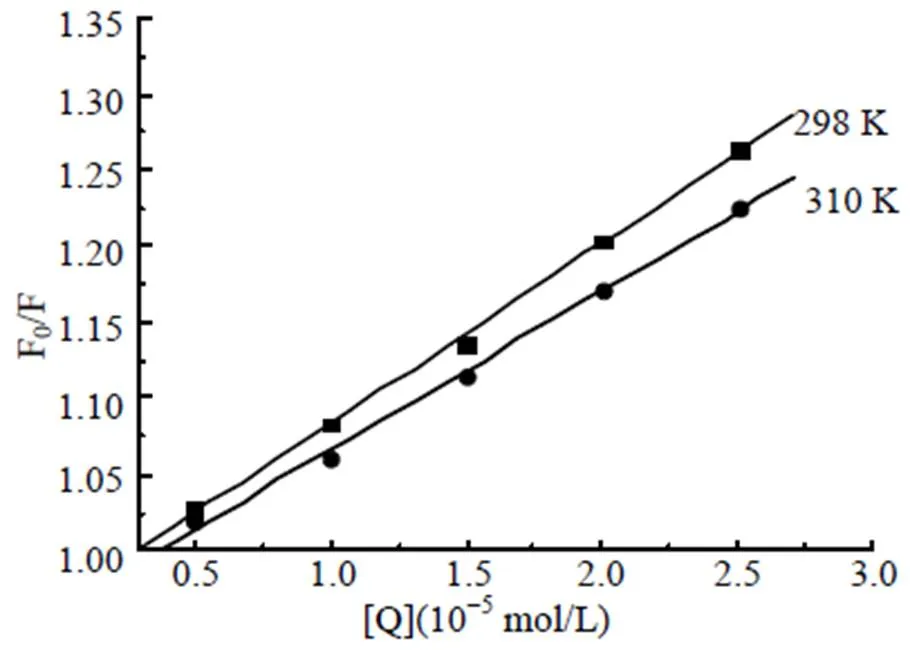
图3 β-CP与BSA相互作用的Stern-Volme曲线
若β-CP-BSA体系为动态猝灭, 则动态猝灭常数随温度的升高而不断增大[7]。但由表1数据可知sv随温度的升高反而降低, 且298 K和310 K时的q均大于猝灭剂对生物大分子最大扩散碰撞猝灭速率常数, 由此判断β-CP-BSA体系不属于动态猝灭, 该体系为静态猝灭, 即β-CP与BSA作用生成不发荧光的复合物, 导致BSA荧光猝灭[7]。
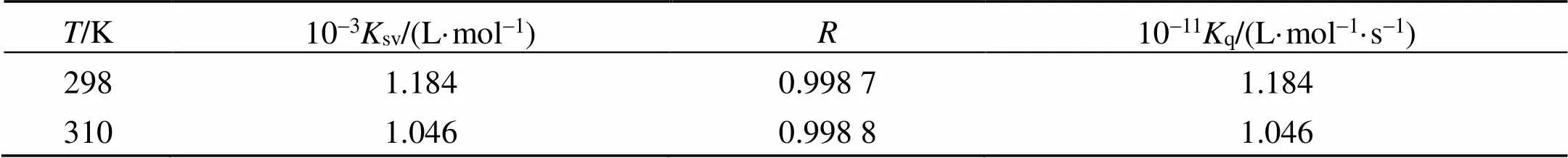
表1 不同温度下β-CP与BSA的动态猝灭常数
2.2.2 静态结合常数(A)和结合位点数()
β-CP与BSA发生静态猝灭作用时可能存在个相同且独立的结合位点[5], 根据公式[8]lg(0-)/= lgA+lg[Q], 由lg(0-)/~lg[Q]作图, 斜率为两者结合位点数(), 截距为二者的表观结合常数A[5], 结果见表2。
由表2可知, 体系的结合常数达到103L·mol-1以上, 说明两者结合较强; 结合位点数近似为1, 说明一个BSA分子有一个β-CP结合位点; β-CP-BSA的结合常数随着温度的升高而减小, 说明该过程是静态猝灭过程, 反应生成的复合物受温度影响较大, 温度升高复合物稳定性降低[5]。
2.2.3 作用力类型
β-CP与BSA之间的作用力有氢键、范德华力、静电引力和疏水力等[4]。根据Van’t-Hoff方程[9]ln=-Δ/+ Δ/Δ= Δ-Δ[10], 以ln对1作图, 由斜率-Δ/和截距Δ/求得Δ和Δ, 得到β-CP-BSA的热力学参数。根据前人的实验经验总结得出: Δ和Δ均大于0时的作用力为疏水作用, ΔΔ均小于0时的作用力为氢键和范德华力, 当Δ<0, Δ>0, 作用力为静电引力[11]。298 K和310 K下, β-CP与BSA体系的热力学参数见表3。
表3中ΔG、Δ、Δ均小于0, 表明β-CP- BSA体系是一个自发的放热过程, 作用力主要是氢键和范德华力; 温度升高时, β-CP-BSA复合物的稳定性减弱, 复合物可能发生分解, 导致β-CP-BSA的结合常数减小[5], 更进一步证实β-CP对BSA为静态猝灭。
2.2.4 结合距离
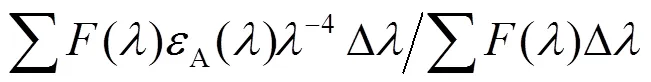
为β-CP︰BSA = 1︰1时的复合物荧光强度,是荧光光谱(BSA)与吸收光谱(β-CP)的重叠积分,为荧光量子产率(BSA),()为BSA在波数为时的荧光强度,ε()为β-CP在波数为时的摩尔吸光系数[5]。对于BSA, 取向因子取给体受体各向随机分布的平均值2= 2/3, 量子产率= 015,折射指数取水和有机物平均值= 1.336[5]。
根据公式计算得出β-CP与BSA的结合距离()为3.95 nm, 结合距离小于7 nm, 符合Förster非辐射能量转移条件, BSA的能量通过形成复合物转移给β-CP, 再一次验证β-CP对BSA为静态猝灭。
2.3 β-CP对BSA构象的影响
2.3.1 同步荧光
β-CP可以猝灭BSA的内源荧光, 推测BSA的构象可能发生变化。酪氨酸、色氨酸和苯丙氨酸是BSA主要的荧光发色团, 但色氨酸对微环境的变化最敏感[4]。Δ= 15 nm主要提供酪氨酸残基的微环境变化信息, Δ= 60 nm主要提供色氨酸残基的微环境变化信息[13], 如图5中(a)和(b)。
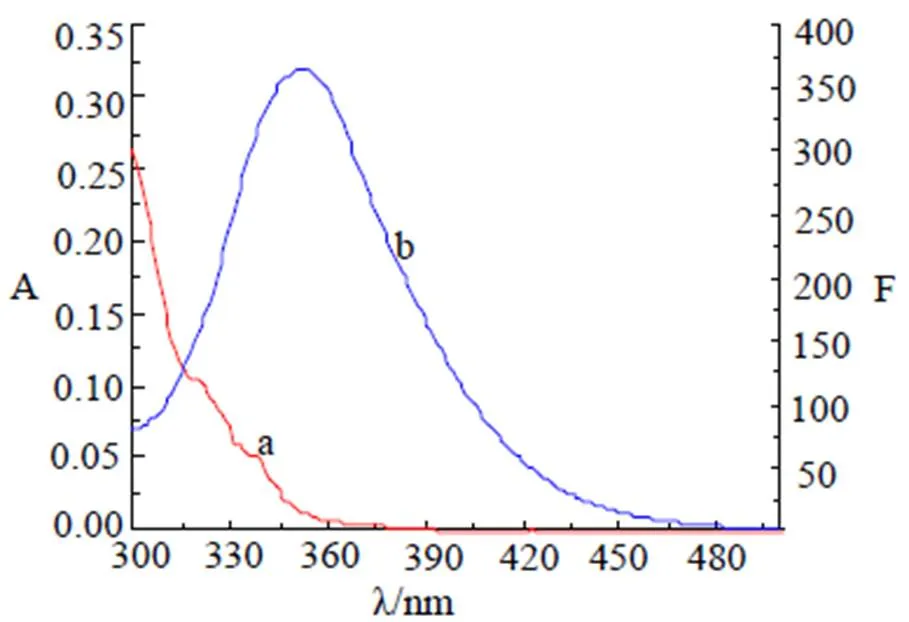
图4 β-CP吸收光谱(a)与BSA荧光光谱(b)的重叠光谱
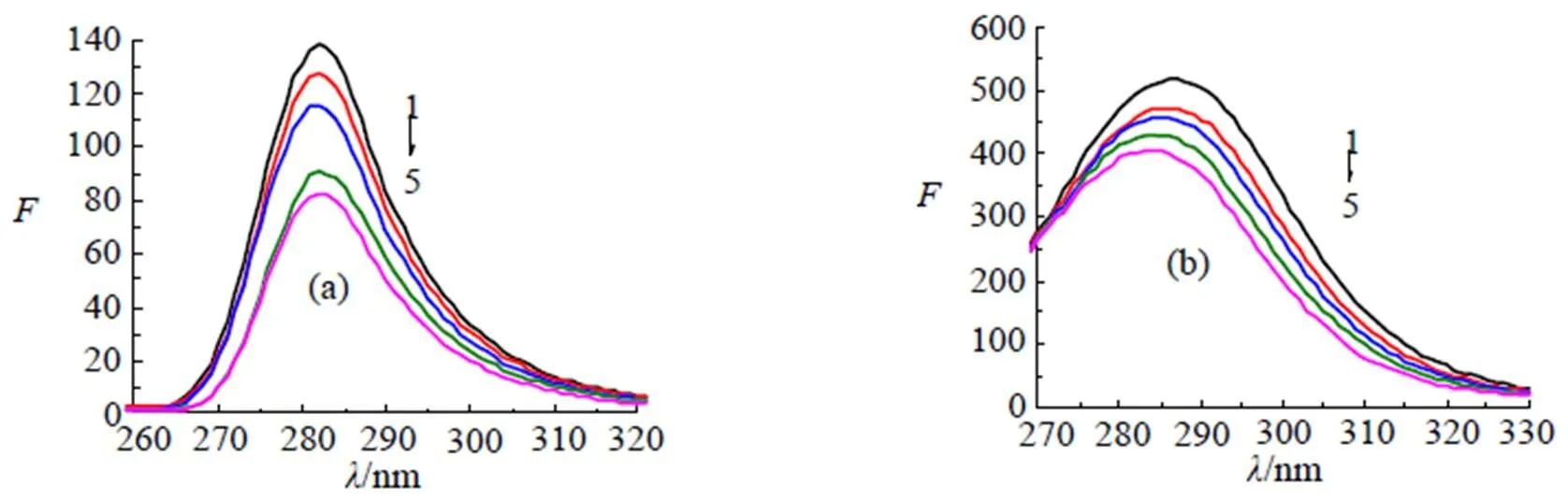
图5 Δλ=15 nm(a)和60 nm(b)的同步荧光光谱
由图4(a)和(b)可知, β-CP对BSA中酪氨酸残基和色氨酸残基均有猝灭作用, 且荧光强度均随β-CP浓度的增加而降低, 但色氨酸残基(Δ= 60 nm)最大发射峰明显蓝移, 酪氨酸残基(Δ= 15 nm)最大荧光峰未发生明显位移, 说明色氨酸残基微环境发生变化, 色氨酸残基对环境变化更敏感, 由此推断β-CP对BSA的荧光猝灭, 主要是BSA分子中色氨酸残基的荧光猝灭, 色氨酸残基所处微环境的疏水性增强, β-CP与BSA可能在疏水空腔内结合, BSA的疏水腔结构被打开, 增加肽链的伸展程度。
2.3.2 圆二色谱
β-CP对BSA二级结构的影响还可以应用CD法研究。图6是β-CP加入前、后BSA的CD谱图。由图6(1)可知, BSA在209 nm和218 nm处有两处负的吸收峰, 加入β-CP后(图6(2))BSA两个负峰向低波数移动, 吸收强度也减弱, 说明β-CP使BSA的二级结构稳定性减弱。根据公式:% = [(-[θ]208-4 000)/(33 000-4 000)] × 100%[14], 计算得出BSA的-螺旋结构含量由31.37%减小到29.22%, 表明β-CP改变BSA的二级结构, β-CP通过氢键和范德华力与BSA分子的肽键形成配位键, 使BSA分子肽链伸展。
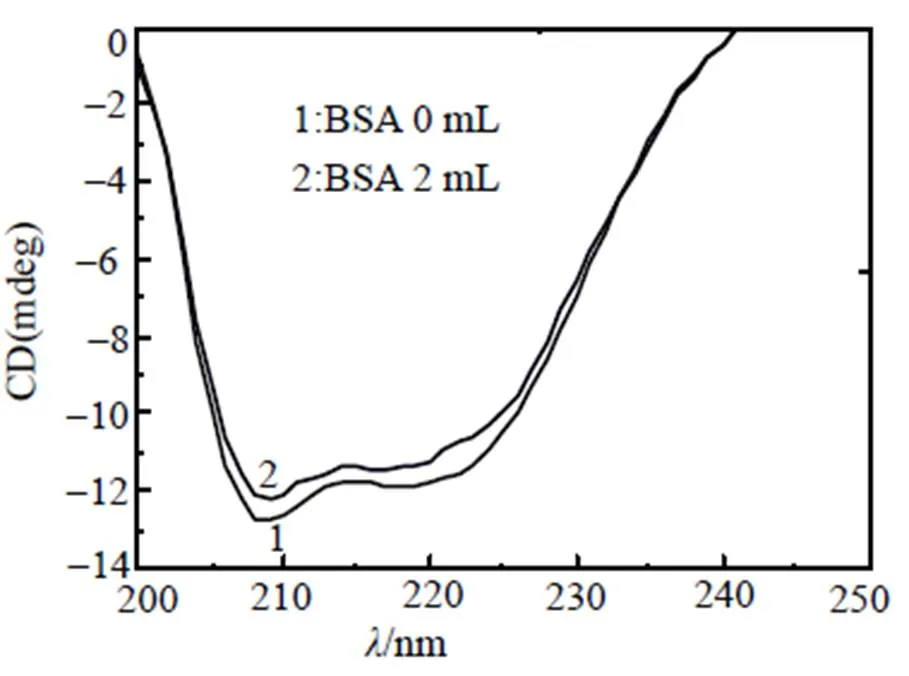
图6 BSA和β-CP-BSA的圆二色谱
3 结论
通过荧光光谱研究得知β-CP与BSA的猝灭机理为静态猝灭, 该反应是一个自发过程; β-CP主要通过氢键和范德华力与BSA分子形成1︰1的较强结合, 结合常数达到103L·mol-1以上, 结合距离是3.95 nm。同步荧光和CD的研究结果表明β-CP使BSA分子中色氨酸残基的疏水性增强, BSA分子的-螺旋结构含量由31.37%减小到29.22%, 证实β-CP影响BSA的构象。
本文详细阐述了烟草中拟除虫菊酯类农药β-CP残留被人体吸收后, 与体内蛋白质相互作用机理, 这对揭示残留农药在人体内代谢过程、解毒和安全科学使用农药提供理论依据。
[1] 赵雪. 作物农残危害及预防措施[J]. 农业与技术, 2019, 39(12): 16–17.
[2] 付志燕, 杜春芸, 姚扬, 等. 高效氯氰菊醋对大鼠海马CA3区神经元电压门控钾通道的影响[J]. 生理学报, 2007, 59(1): 63–70.
[3] 杨洁, 范晓丽, 林佳丽, 等. 荧光光谱法研究24(R)–拟人参皂苷元DQ与牛血清蛋的相互作用[J]. 理化检验–化学分册, 2018, 54(7): 783–787.
[4] 黄朝波, 徐晗, 杨明冠, 等. 光谱法和分子对接研究红斑红曲胺与牛血清白蛋白相互作用[J]. 光谱学与光谱分析, 2019, 39(10): 3 102–3 107.
[5] 孙丽莉, 陈宁生, 夏学文. 噻嗪酮与牛血清白蛋白相互作用的光谱法研究[J]. 分析科学学报, 2011, 2(27): 222–225.
[6] Luo X, Du C, Wei J R, et al. Study of the interaction between sodium salts of (2e) -3- (4’-halophenyl) prop-2-enoyl sulfachloropyrazine and bovine serum albumin by fluorescence spectroscopy [J]. Luminescence: the journal of biological and chemical luminescence, 2013, 28(11): 202–210.
[7] 陈国珍. 荧光分析法[M]. 北京: 科学出版社, 1990: 201.
[8] Tarlok S. Banipal, Amandeep Kaur, Parampaul K. Banipal.Physicochemical aspects of the energetics of binding of sulphanilic acid with bovine serum albumin [J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2017, 170(5): 214–225.
[9] Chaturvedi S K, Ahmad E, Khan J M, et al. Elucidating the interaction of limonene with bovine serum albumin: a multi-technique approach [J]. Molecular Biosystems, 2015, 11(1): 307–316.
[10] Bhogale A, Patel N, Mariam J, et al. Comprehensive studies on the interaction of copper nanoparticles with bovine serum albumin using various spectroscopies [J]. Colloids Surfaces B Biointerfaces, 2013, 9(21): 276–284.
[11] Ross P D. Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemistry, 1981, 20(11): 3 096–3 099.
[12] 杨频, 高飞, 马贵斌. 生物无机化学导论[M]. 西安: 西安交通大学出版社, 1991: 152.
[13] Chengbin Xu, Jiali Gu, Xiping Ma, et al. Investigation on the interaction of pyrene with bovine serum albumin using spectroscopic methods [J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2014, 1(132): 391–395.
[14] 孙荣梅, 于丽燕, 陈昌云. 曲克芦丁与牛血清白蛋白相互作用的光谱研究[J].江苏大学学报, 2009, 19(5): 389–390.
Spectrctroscopic studies on the interaction between beta cypermethrin residue in tobacco and bovine serum albumin
Sun Lili, Zhang Zhao, Chen Gang, Peng Xiaomeng, Xie Yingsong, Hu Lizhong, Ge Shaolin
(Anhui Key Laboratory of Tobacco Chemistry, Hefei 230088, China)
The interaction between Beta cypermethrin and BSA is studied by spectroscopic methods in orde toprovide theoretical reference for the transport, metabolism and poisoning mechanism of residual pesticides in tobacco leaves, and provide guidance for the scientific and effective use of pesticides under simulative physiological conditions. The results show that fluorescence quenching mechanism of Beta Cypermethrin with BSA is a static quenching procedure, the interaction are mainly the hydrogen bond and Van der Waals force; The distance between them was 3.95 nm by Förster non-radiative energy transfer theory and the apparent binding constants (A) are 4.168×103(298 K) and 3.162×103(310 K) L·mol-1, and the binding sites () is 1; The results of CD spectra and the synchronous fluorescence indicate that the secondary structure of BSA is changed when beta cypermethrin is bound to BSA, and the content of-helical structure decreases.
fluorescence spectroscopy; CD spectroscopy; synchronous fluorescence; Beta cypermethrin; BSA
O 657.39
A
1672–6146(2020)04–0032–05
10.3969/j.issn.1672–6146.2020.04.006
孙丽莉, 18756997517@126.com; 葛少林, 236897248@qq.com。
2019–11–18
烟草化学安徽省重点实验室开放课题(2017137)。
(责任编校: 郭冬生)
