微生物共培养降解β-氯氰菊酯的适宜条件
2018-08-10苏宏南陈切希赵甲元迟原龙贾冬英姚开
苏宏南,陈切希,赵甲元,迟原龙,贾冬英,姚开*
1(四川大学 轻纺与食品学院,四川 成都,610065) 2(旌阳区食品药品监督管理局,四川 德阳,618000) 3(四川师范大学 生命科学学院,四川 成都,610101)
β-氯氰菊酯(β-cypermethrin,β-CY)是一种高效拟除虫菊酯类农药,被广泛应用于果蔬、谷物等虫害的防治。β-氯氰菊酯疏水性强、对光热稳定,自然条件下降解缓慢,在中性土壤中的半衰期可达165 d[1],长期施用易造成土壤和农产品中残留量超标,进而对生物体造成危害[2]。微生物降解法因其高效、安全等特点,已成为降解农药的首选方法之一[3]。
通常,土壤环境中的混合菌株比单一菌株具有更强的农药降解能力[4],尤其是具有菌丝体结构的菌株,不仅自身对污染物会有一定的降解作用[5],还能使其他微生物借助其菌丝体穿越土壤的空隙层,实现更大范围的分散,增大微生物与土壤中污染物的接触概率,提高污染物的降解率。此外,菌丝体还能刺激其他微生物的生长和生物活性的表达,从而更有利于微生物作用于土壤中的污染物[6]。
本文以长期喷施拟除虫菊酯类农药的菜园土壤为菌源,筛选得到对β-氯氰菊酯具有降解能力的放线菌,并将其与前期筛选得到的对β-氯氰菊酯具有较强降解能力的地衣芽孢杆菌B-1共同培养,考察其对β-氯氰菊酯的适宜降解条件和降解效果,为农产品和粮食中残留的拟除虫菊酯类农药生物降解的深入研究提供参考数据。
1 材料与方法
1.1 试剂与培养基
(1) 试剂:β-氯氰菊酯标准品(纯度为99.7%,国家标准物质中心),色谱纯乙腈(美国TEDIA试剂公司),其他试剂均为国产分析纯。
(2) 查氏培养基(CDM):蔗糖30 g,NaNO31.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO4·3H2O 1.0 g,Fe2(SO4)30.01 g,胰蛋白胨0.5 g,吐温80 2.0 mL,去离子水1 000 mL,pH 7.2~7.4,121℃灭菌20 min。
(3) 高氏一号培养基(GSM):可溶性淀粉20 g,KNO31.0 g,K2HPO4·3H2O 0.5 g,NaCl 0.5g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,吐温80 2.0 mL,去离子水1 000 mL,pH 7.2~7.4,121℃灭菌20 min。
(4) LB培养基:胰蛋白胨5.0 g,酵母膏2.0 g,NaCl 10 g,吐温80 2.0 mL,去离子水1 000 mL,pH 7.0,121℃灭菌20 min。
1.2 仪器与设备
LC-10AT高效液相色谱仪,日本岛津公司;TU-1800PC紫外分光光度计,北京普析通用仪器有限责任公司;KQ5200DB数控超声波清洗器,昆山市超声仪器有限公司;GL-20G-C高速冷冻离心机,上海安亭飞鸽有限公司。
1.3 菌株筛选和鉴定
(1) 菌株B-1:本实验室前期从茶园土壤中筛选和驯化得到的地衣芽孢杆菌B-1(BacilluslicheniformisB-1),其在一定条件下对β-氯氰菊酯的降解率为77.0%。
(2) 菌株K-1:从长期喷洒拟除虫菊酯类农药的菜园土壤中筛选得到的放线菌。
取土样1.5 g,置于装有28.5 mL CDM培养基(β-氯氰菊酯含量为50 μg/mL)的250 mL锥形瓶中,35℃振荡(150 r/min)培养72 h;然后按5.0%转接量,依此条件再进行3次重复培养,并依次提高培养基中β-氯氰菊酯含量,分别为100、200、300 μg/mL;将最后一级培养液稀释后涂布于GSM琼脂培养基上,35℃培养72 h,对菌落进行分离和纯化,从中筛选出对β-氯氰菊酯具有较强耐受性和较好降解能力的理想放线菌。
参照陈少华等的方法对筛选的理想菌株进行生理生化鉴定[8]。菌株16S rDNA测序由上海生工生物工程技术服务有限公司完成,从GenBank数据库中选择同源性高的16S rDNA基因序列,利用软件ClustalX2.3和MEGA6.0构建菌株系统发育树。
1.4 β-氯氰菊酯含量的测定
用乙腈配制一系列不同含量的β-氯氰菊酯的标准溶液,参照刘芳芳的方法[7],测定β-氯氰菊酯的HPLC峰面积,平行重复3次,取其平均值。对β-氯氰菊酯含量(X)与其峰面积(Y)进行线性拟合,得到标准曲线方程:Y=68 023X+26 227,R2=0.999 9。
将降解体系匀浆,取5.0 mL降解液与等体积乙腈混合,超声(80 Hz,160 W)30 min,离心(8 000 r/min)20 min,上清液过有机滤膜(0.45 μm),滤液进行HPLC检测,根据标准曲线方程计算β-氯氰菊酯含量,并按公式(1)计算降解率。
降解率/%=(1-D/Dk)×100
(1)
式中:D,降解液中β-氯氰菊酯含量;Dk,空白对照组中β-氯氰菊酯含量。
1.5 菌悬液的制备
(1) 菌株B-1菌悬液:将活化的菌株B-1接种于LB培养基中(β-氯氰菊酯含量为50 μg/mL),35 ℃振荡(150 r/min)培养48 h,冷冻离心(4 ℃,8 000 r/min)10 min,沉淀用无菌生理盐水复溶,调整细胞浓度,制成OD600值为0.8的菌株B-1菌悬液。
(2) 菌株K-1孢子悬液:将活化的菌株接种于GSM琼脂培养基上(β-氯氰菊酯质量浓度为100 μg/mL),30 ℃培养72 h。用无菌生理盐水洗下孢子,振荡混匀,调整其浓度,制成OD600值为1.0的菌株K-1孢子悬液。
1.6 菌株共培养降解β-氯氰菊酯适宜条件的选择
(1) 培养基组成:将GSM培养基与LB培养基分别按1∶0、1∶1、0∶1(v/v)的比例混合,分别取β-氯氰菊酯含量为50 μg/mL的混合培养基28.5 mL,分装于250 mL锥形瓶中。以1∶1(K-1∶B-1,v/v)的接种比例,分别接入菌悬液或孢子悬液,总接种量为5.0%(v/v),以等量的无菌生理盐水替代菌悬液及孢子悬液作为空白对照,35℃振荡(150 r/min)培养72 h,检测β-氯氰菊酯的含量,并计算其降解率。
(2) 接种比例:取β-氯氰菊酯质量浓度为50 μg/mL的混合培养基28.5 mL,分装于250 mL锥形瓶中。按5.0%(v/v)的接种量,分别以3∶1、2∶1、1∶1、1∶2、1∶3、1∶0、0∶1(K-1∶B-1,v/v)的比例接入其菌悬液或孢子悬液,以等量的无菌生理盐水替代菌悬液及孢子悬液作为空白对照,35 ℃振荡(150 r/min)培养72 h,检测β-氯氰菊酯的含量,并计算其降解率。
(3) 接种方式:取β-氯氰菊酯质量浓度为50 μg/mL的混合培养基28.5 mL,分装于250 mL锥形瓶中。分别按以下3种方式接入适宜比例的菌悬液或孢子悬液,总接种量为5.0%(v/v),以等量的无菌生理盐水替代菌悬液及孢子悬液作为空白对照,35 ℃振荡(150 r/min)培养72 h,检测β-氯氰菊酯的含量,并计算其降解率:
①先接种菌株K-1,培养24 h后接种菌株B-1;
②先接种菌株B-1,培养24 h后接种菌株K-1;
③同时接种菌株K-1和菌株B-1。
1.7 菌株共培养降解β-氯氰菊酯的动力学分析
分别取β-氯氰菊酯质量浓度为50、100、200 μg/mL的混合培养基28.5 mL,分装于250 mL锥形瓶中,按5.0%(v/v)的接种量和2∶1的比例(K-1∶B-1,v/v)接入菌悬液或孢子悬液,35 ℃振荡(150 r/min)培养5 d,定时取样,检测β-氯氰菊酯的含量。选用Logistic方程[9]并利用软件Origin 8.0对不同β-氯氰菊酯含量随培养时间的变化进行非线性拟合。
2 结果与讨论
2.1 菌株K-1的鉴定
菌株K-1的生理生化特征如表1所示,其16S rDNA基因的PCR扩增结果如图1所示。可以看出,菌株K-1符合链霉菌特征[8],其16S rDNA扩增产物凝胶电泳的显示结果与测序长度1 273 bp吻合。BLAST基因同源性分析结果表明,菌株K-1与Streptomycesneopeptiniusstrain T41(GenBank登录号为KU317914.1)及Streptomyceschartreusisstrain S14(GenBank登录号为KT958872.1)均有99%的同源性,据此建立的系统进化树如图2所示。综合菌株K-1的生理生化特征及序列比对结果,最终鉴定其为一株链霉菌(Streptomycessp. K-1)。

表1 菌株K-1的生理生化特征Table 1 Physiological and biochemical characteristics ofstrain K-1
注:“+”表示为阳性;“-”表示为阴性。
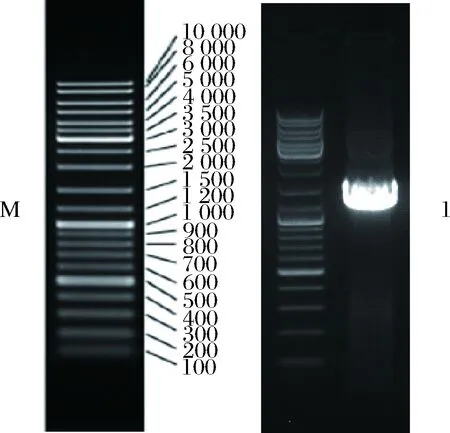
M-Maker; 1-菌株K-1的PCR产物图1 菌株K-1 16S rDNA的PCR扩增产物电泳图Fig.1 Electrophoretogram of 16S rDNA PCR product of strain K-1

*参考菌株来源于GenBank数据库,括号内为菌株在数据库中的登录号图2 菌株K-1的系统发育树Fig.2 Phylogenetic tree of strain K-1
2.2 菌株共培养降解β-氯氰菊酯的培养基组成确定
不同培养基组成对β-氯氰菊酯降解效果的影响如图3所示。可以得出,当培养基为GSM(GSM∶LB=1∶0)和LB(GSM∶LB=0∶1)时,β-氯氰菊酯降解率分别为18.3%和75.3%,而当混合培养基的比例为1∶1(GSM∶LB,v/v)时,β-氯氰菊酯降解率可达80.6%,其原因可能是由于单一培养基中缺乏两菌株共同生长的营养物质[10]。因此,GSM和LB比例为1∶1(v/v)的混合培养基是菌株B-1和菌株K-1共同培养的适宜培养基。
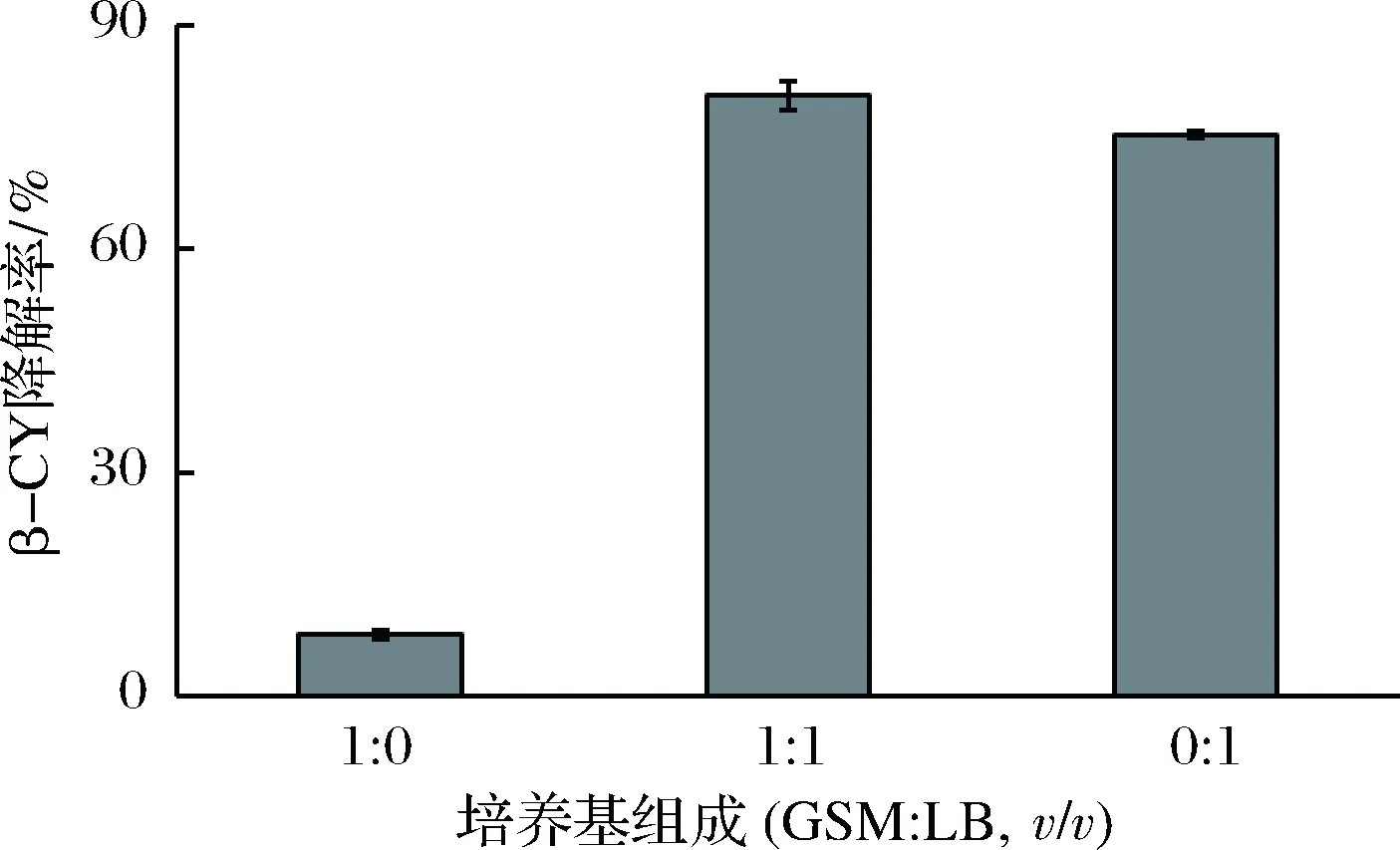
图3 培养基组成对菌株共培养降解β-氯氰菊酯的影响Fig.3 Effect of culture compositions on β-CY degradation by co-culture of the strains
2.3 菌株共培养降解β-氯氰菊酯的接种比例确定
两菌株接种比例对β-氯氰菊酯降解效果的影响如图4所示。可以得出,当菌株K-1和菌株B-1的接种比例为2∶1(v/v)时,β-氯氰菊酯的降解率可达84.1%,为适宜的接种比例。菌株生存有其适应的适度空间,两菌株混合培养时为夺取生存空间及营养物质等资源而相互抑制[4],且同时接种也会导致两菌株生长的竞争作用加剧[9],一定程度上影响了β-氯氰菊酯的降解。
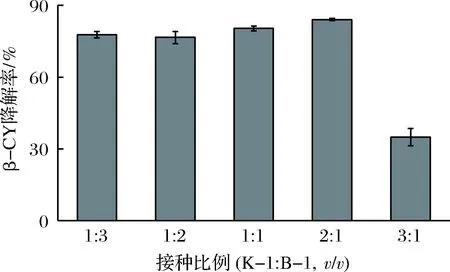
图4 接种比例对菌株共培养降解β-氯氰菊酯的影响Fig.4 Effect of inoculation ratios on β-CY degradation by co-culture of the strains
2.4 菌株共培养降解β-氯氰菊酯的接种方式确定
菌株接种方式对β-氯氰菊酯降解率的影响如图5所示。可以得出,3种不同接种方式的β-氯氰菊酯降解率分别为88.3%、72.55%和83.91%,其中接种方式1的降解效果最佳。一般认为,微生物降解目标底物的过程主要发生在菌体细胞内或胞外酶液环境,但无论哪种过程的目标底物都需与菌体细胞或降解酶发生直接接触,即生物吸附作用[11],且生物吸附先行于生物降解。因此,共培养体系中先接种菌株K-1有利于其生长繁殖和菌丝吸附β-氯氰菊酯,并借助生物膜运输将β-氯氰菊酯传送给随后接入的菌株B-1,使后者更大程度地接触β-氯氰菊酯,并将其降解[12]。
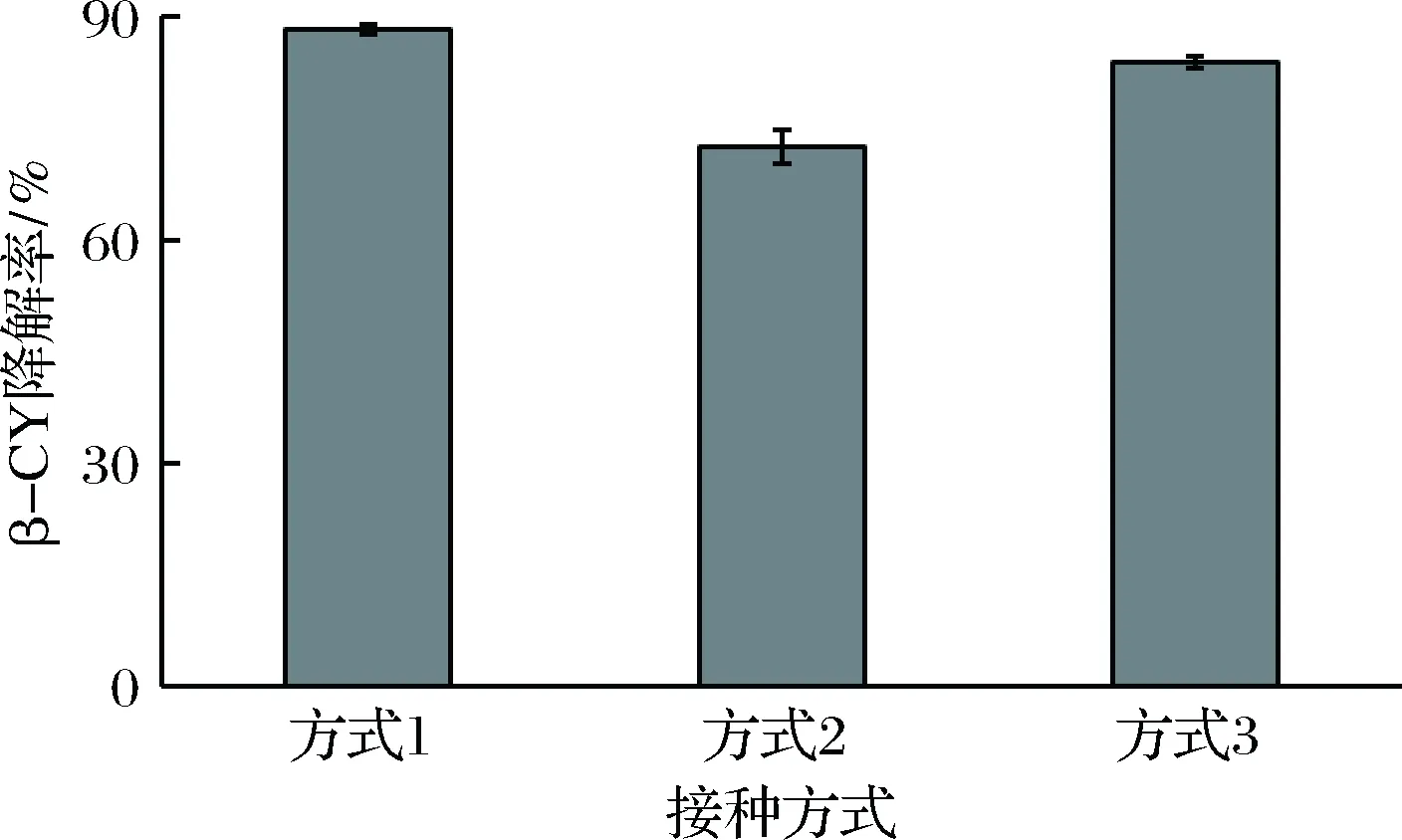
图5 接种方式对菌株共培养降解β-氯氰菊酯的影响Fig.5 Effect of inoculation methods on β-CY degradation by co-culture of the strains
2.5 菌株共培养降解β-氯氰菊酯的动力学特征
对适宜条件下菌株共培养降解不同含量β-氯氰菊酯的过程进行动力学分析,依据得到的动力学方程计算β-氯氰菊酯的降解速率常数(k)、半衰期(T1/2)和最大比生长速率(Vmax),结果见图6和表2。可以看出,0~1 d时,β-氯氰菊酯含量缓慢下降,降解速率较低,这是因为接种初期的菌株K-1尚处在生长适应期的缘故;1~4 d时,β-氯氰菊酯降解速率明显增大,这可能是由于菌株K-1的生长形成的菌丝体使加入的菌株B-1更好地接触并降解β-氯氰菊酯;培养5 d时,不同含量(50、100、200 μg/mL)β-氯氰菊酯的降解率依次为94.0%、85.7%和65.1%。动力学方程的相关系数(R2)均大于0.95,表明其可较好地反映菌株共培养过程中β-氯氰菊酯含量与培养时间的关系。
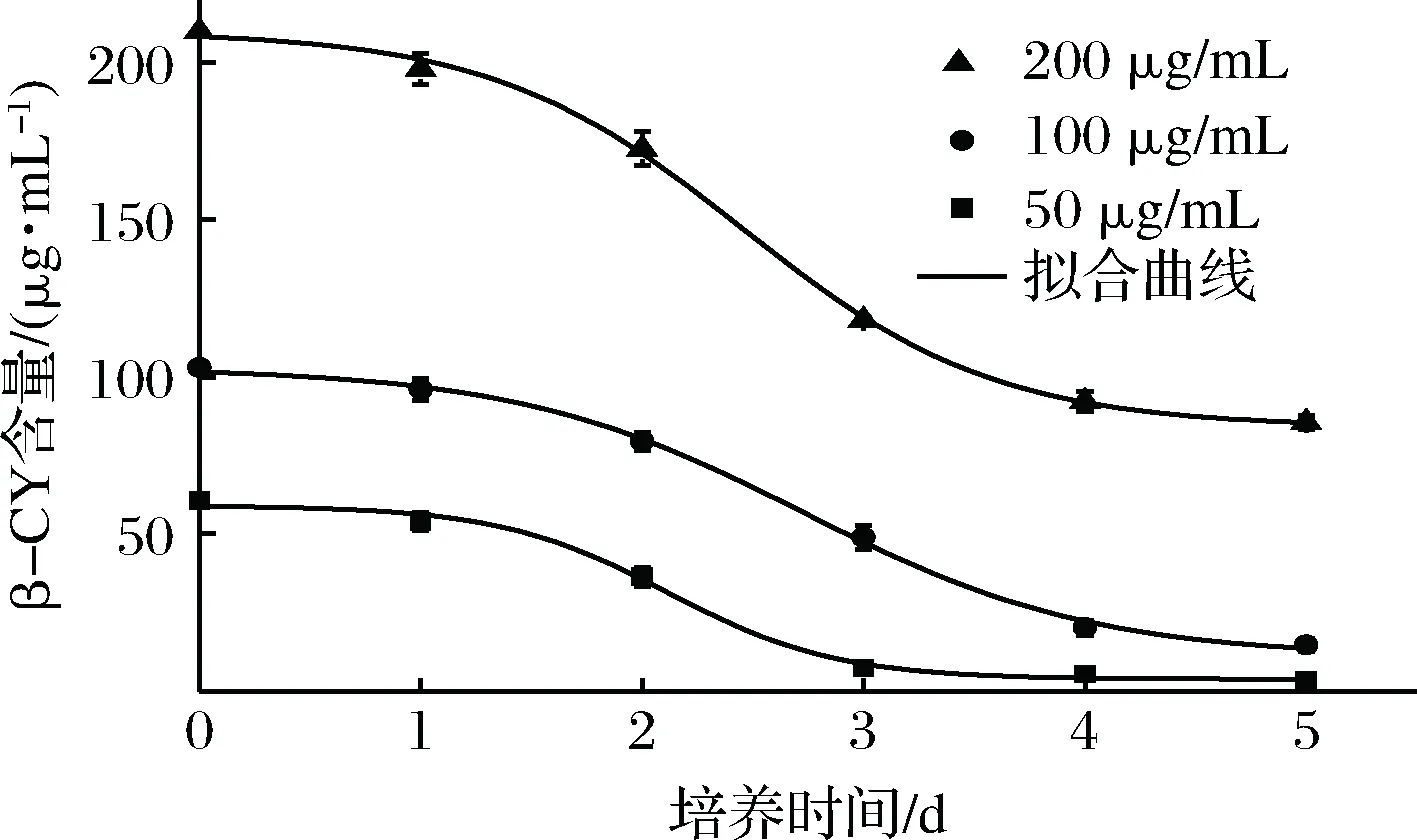
图6 菌株共培养降解β-氯氰菊酯的动力学曲线Fig.6 Kinetic curves of β-CY degradation by co-culture of the strains

β-氯氰菊酯/(μg·mL-1)动力学方程R2k/d-1T1/2/dVmax/[μg·(mL·d)-1]50Ct=59.04-59.04[0.94/(1+257.63e-2.6252t)]0.996 32.632.400.62100Ct=102.96-102.96[0.90/(1+65.43e-1.5323t)]0.998 51.533.450.34200Ct=210-210[0.60/(1+75.25e-1.7584t)]0.999 01.7612.290.26
3 结论
从长期喷施拟除虫菊酯类农药的菜园土壤中筛选得到1株对β-氯氰菊酯具有较强降解能力的放线菌,根据生理生化特征及16S rDNA测序结果鉴定其为链霉菌(Streptomycessp. K-1)。适宜条件下,链霉菌K-1与地衣芽孢杆菌B-1共培养对β-氯氰菊酯的降解率较之单独使用地衣芽孢杆菌B-1提高了11.3%,表明2菌株共培养更有利于β-氯氰菊酯的降解。研究结果可为拟除虫菊酯类农药污染农作物土壤的修复和减少农产品中农药残留途径提供参考依据。
