复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化的系统评价Δ
2020-11-24杨凤霞贺永刚
杨凤霞,米 娜,贺永刚,尤 楠,张 英
(中国人民解放军陆军军医大学第二附属医院肝胆外科,重庆400037)
随着社会的发展,人们平均饮酒量增加,酒精性肝硬化的发病率呈升高趋势,并有赶超病毒性肝硬化的趋势[1-2]。酒精性肝硬化早期并无明显症状,发展至后期,患者可出现黄疸、乏力和脾肿大等表现,严重威胁患者生命。在疾病早期发现并积极治疗,对于改善患者疾病预后、提高患者生活质量具有重要意义。还原型谷胱甘肽通过维持肝脏的氧化还原反应平衡,达到保护肝脏的目的,在临床应用广泛[3]。以甘草酸苷、甘草酸单铵盐和甘氨酸为主要活性成分的复合物复方甘草酸苷,以抗炎、保肝为主要功效[4]。近年来,不少研究者将酒精性肝硬化药物治疗的重点转移到复方甘草酸苷联合还原型谷胱甘肽上面,先后进行了多项体内体外试验来验证上述2种药物联合应用的效果,结果表明,联合用药能够有效降低肝损伤程度,延缓肝纤维化进程。为了对复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化的疗效和安全性做出全面、系统的评价,为临床使用复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化提供循证学依据,本研究在现有文献基础上,对已有的随机对照试验(randomized controlled trial,RCT)进行荟萃分析(Meta分析),为未来上述2种药物的临床试验和体外实验提供新的参考和借鉴。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准:入选的文献必须同时满足以下条件。(1)研究对象。原始研究中,观察组为经复方甘草酸苷联合还原型谷胱甘肽治疗的酒精性肝硬化患者,对照组为经常规或常规治疗联合其中一种药物治疗的酒精性肝硬化患者。(2)研究类型为常规治疗+复方甘草酸苷+还原型谷胱甘肽治疗与常规治疗或常规治疗+复方甘草酸苷或常规治疗+还原型谷胱甘肽比较的RCT。(3)观察指标。①肝功能指标水平,包括血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(GGT)和总胆红素(TBIL);②肝纤维化指标水平,包括透明质酸酶(HA)、血清Ⅲ型前胶原(PC-Ⅲ)和Ⅳ型胶原(Ⅳ-C)。(4)对于同一作者或者机构的多篇类似文献,只纳入与截止搜索时间间隔最近或研究数据最完整的文献。
1.1.2 排除标准:(1)理论阐述、动物实验、体外实验及案例分析等非临床RCT类型的研究;(2)未对研究对象的饮酒史及病程长短进行描述的研究;(3)未排除肝硬化由药物、自身免疫或者其他因素造成的研究;(4)未排除肝硬化患者其他影响到治疗效果的疾病的研究。
1.2 文献检索策略
在中国知网(CNKI)、万方数据库(WFD)、维普数据库(VIP)、PubMed和the Cochrane Library等数据库中进行文献检索,并以中文“复方甘草酸苷”“复方甘草甜素”“还原型谷胱甘肽”“还原性谷胱甘肽”和“酒精性肝硬化”、英文“Compound Glycyrrhizin”“Reduced Glutathione”和“Alcoholic Cirrhosis”为检索词;为了保持研究对象基因群组的一致性和文献的时效性,取近十年内完成的RCT,将检索时间设置为2010年1月1日至2020年5月31日。
1.3 文献筛选、数据提取与质量评价
由2名评审员独立进行文献筛选和数据提取。剔除重复发表文献,并通过阅览标题和摘要对检索到的文献进行初步筛选,在这个过程中严格执行文献纳入和排除标准;初筛完成后,完整阅览全文,认真分析方案的可行性,数据的真实性,以完成复筛。提取的数据包括研究发表的年份、第一作者、干预措施、病例数、患者年龄、病程、疗程和观察指标等。以RevMan 5.3软件内置的Cochrane偏倚风险评估工具的质量评价标准为基础,由2名评审员独立对纳入的文献进行质量评价。
1.4 统计学方法
采用RevMan 5.3软件进行Meta分析,采用I2检验评判各RCT之间的统计学异质性,P>0.05、I2≤50%表示统计学异质性不存在,采用固定效应(fixed effect,FE)模型进行Meta分析;P≤0.05,50%
2 结果
2.1 文献筛选结果和纳入文献的基本特征
文献初检总共获得44篇文献,剔除重复发表的文献26篇;以纳入标准和排除标准为基础进行初筛,阅览文献标题和摘要,剔除4篇;通读筛出的14篇文献,认真核实内容、细节与数据,剔除9篇,最后纳入5篇文献[6-10],涉及543例患者,其中观察组271例,对照组272例。文献筛选流程与结果见图1;纳入文献的基本特征见表1。

表1 纳入文献的基本特征
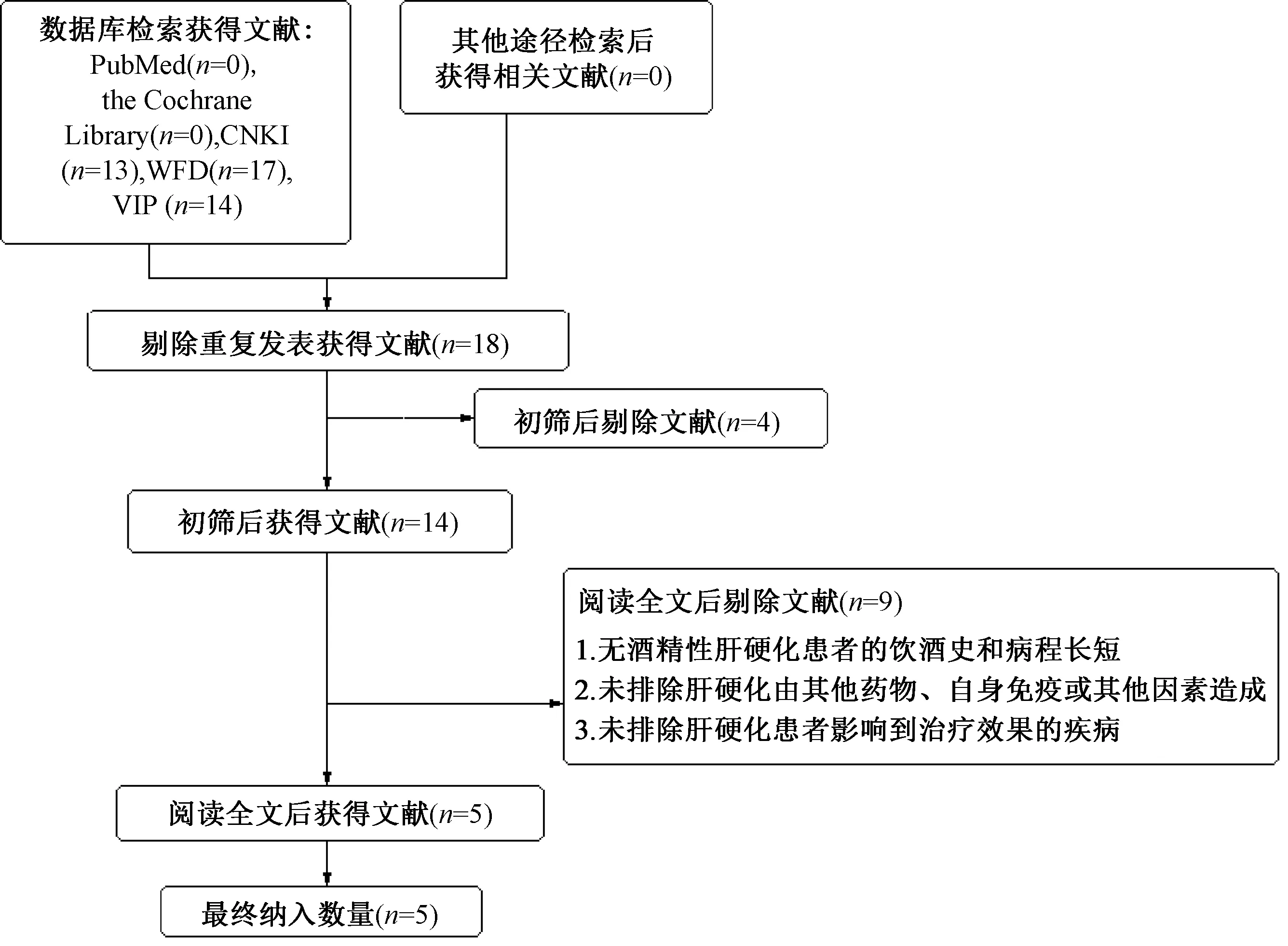
图1 文献筛选流程与结果
2.2 纳入文献的质量评价
(1)随机分配方法:5项RCT中,只有1项RCT[10]按照治疗方法分组;其余4项RCT[6-9]均提及“随机”,但只有2项RCT采用随机数表法分组,其余2项RCT未进行具体阐述。(2)分配隐藏:5项RCT均未提及是否进行分配隐藏,存在选择性偏倚的可能性。(3)盲法:4项RCT[6-9]阐述与患者签署了知情同意书,只有1项RCT未阐述是否采用盲法。(4)随访:所有RCT中的患者均未失访。(5)报告偏倚:有1项RCT[8]未报告AST水平,1项RCT[6]未报告TBIL水平,可能存在发表偏倚;其余3项RCT[6,9-10]均对所有观察指标进行了阐述。(6)其他偏倚:有3项RCT[6-7,10]未阐述患者是否在进入研究前3个月内服用相关药物,可能对结果产生影响;有2项RCT[8-9]明确患者在进入该研究之前未曾使用相关药物。纳入文献的质量评价结果见图2。

图2 纳入文献的质量评价结果
2.3 Meta分析结果
2.3.1 肝功能指标:(1)ALT。5项RCT[6-10]均报告了ALT水平,共543例患者,其中观察组271例,对照组272例。Meta分析结果显示,各项研究间存在较大异质性(P<0.000 01,I2=93%),见图3。采用文献逐篇剔除法进行敏感性分析,以探查影响I2的原因。分析发现,在剔除4项RCT[6-7,9-10]后,P<0.000 01,I2未有明显改变;但剔除1项RCT[7]后例外,证明该项RCT的ALT水平可能是异质性来源。由于剔除该项RCT后,P<0.05,I2>75%,不宜采用Meta分析,故改用描述性分析。分析结果显示,治疗后,对照组和观察组患者的血清ALT水平较治疗前都出现降低,观察组患者降低的幅度明显大于对照组,差异有统计学意义(P<0.05)。(2)AST。4项RCT[6-7,9-10]报告了AST水平,共453例患者,其中观察组227例,对照组226例。Meta分析结果显示,各项研究间存在较大异质性(P=0.002,I2=80%),见图4。采用文献逐篇剔除法进行敏感性分析,未发现异质性来源,此时改用描述性分析。分析结果显示,4项RCT中,治疗后,观察组和对照组患者的血清AST水平较治疗前均有降低,观察组患者降低的幅度明显大于对照组,差异有统计学意义(P<0.05)。(3)GGT。5项RCT[6-10]均报告了GGT水平,共543例患者,其中观察组271例,对照组272例。Meta分析结果显示,P<0.05,I2=65%,采用RE模型进行分析得到,SMD=-1.38,95%CI=-1.71~-1.06,观察组患者的GGT水平低于对照组,说明观察组患者的疗效优于对照组,见图5。(4)TBIL。4项RCT[6-7,9-10]报告了TBIL水平,共443例患者,其中观察组221例,对照组222例。经Meta分析发现,P>0.05,数据无效,见图6。

图3 两组患者ALT水平比较的Meta分析森林图

图4 两组患者AST水平比较的Meta分析森林图

图5 两组患者GGT水平比较的Meta分析森林图

图6 两组患者TBIL水平比较的Meta分析森林图
2.3.2 肝纤维化指标:4项RCT[6-7,9-10]报告了肝纤维化指标水平,共443例患者,其中观察组221例,对照组222例。(1)PC-Ⅲ。通过Meta分析发现,P>0.05,I2=0%,数据无效,见图7。(2)Ⅳ-C。通过Meta分析发现,P<0.05,I2=84%,见图8。采用文献逐篇剔除法进行敏感性分析,未发现异质性来源,采用描述性分析。分析结果显示,4项RCT中,观察组和对照组患者的血清Ⅳ-C水平较治疗前降低,观察组患者降低的幅度明显大于对照组,差异有统计学意义(P<0.05)。(3)HA。由于4项RCT中HA采用了不同的单位,所以采用SMD进行分析。结果显示,P<0.05,I2=82%,见图9。采用文献逐篇剔除法进行敏感性分析,发现1项RCT[10]对异质性存在较大影响。剔除该项RCT后,I2>75%,故采用描述性分析。分析结果显示,治疗后,观察组患者HA水平降低幅度明显优于对照组,差异有统计学意义(P<0.05)。
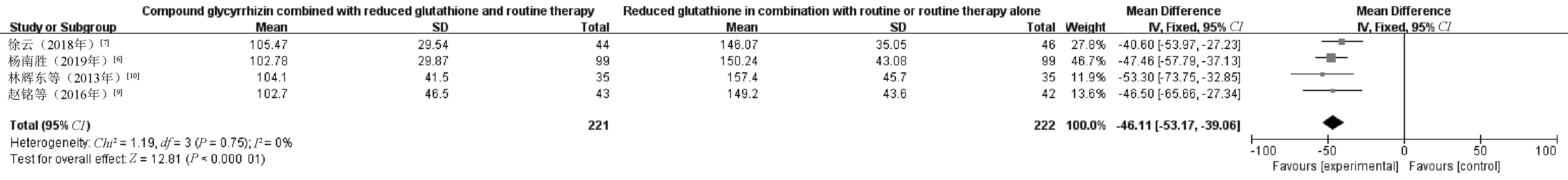
图7 两组患者PC-Ⅲ水平比较的Meta分析森林图
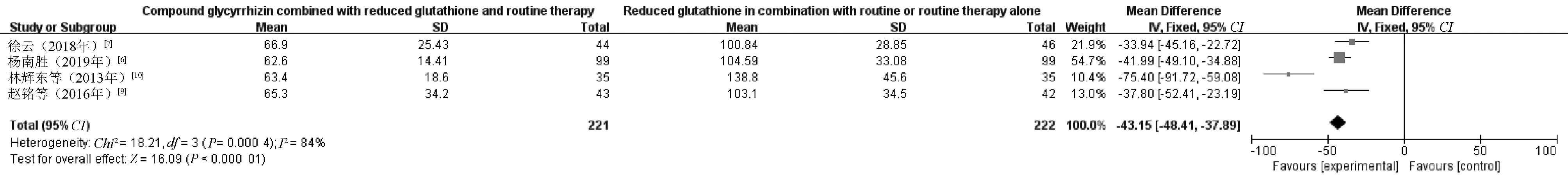
图8 两组患者Ⅳ-C水平比较的Meta分析森林图
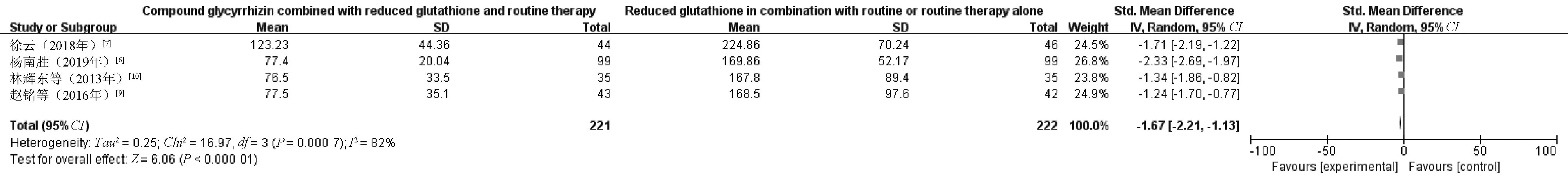
图9 两组患者HA水平比较的Meta分析森林图
3 讨论
酒精性肝硬化以肝脂肪细胞变性为基本病理改变,病变程度与患者的饮酒量呈正相关。多项研究结果证实,乙醇能够促进氧化作用,加速炎症发生,导致肝脂肪细胞病变,而肝脂肪变性能增强乙醇的肝毒性,最终形成恶性循环[11-12]。从药理学角度而言,复方甘草酸苷和还原型谷胱甘肽的活性成分能够延缓酒精性肝硬化病情发展[13-14]。
酒精性肝硬化能够引起血清肝功能指标和肝纤维化指标升高[15]。一项研究结果表明,当酒精作用于肝细胞,导致肝细胞被破坏,原本存在于肝细胞内的ALT和AST同工酶被释放入血,引起血清ALT和AST浓度升高[16]。长期持续大量饮酒后,还会引起存在于肝细胞微粒体内的GGT被释放入血。肝细胞被破坏,肝脏对TBIL的摄取降低,导致血清TBIL浓度升高,引起黄疸[17]。肝细胞损伤发展为肝硬化的关键一步即是肝纤维化,血清PC-Ⅲ、Ⅳ-C和HA水平是评价肝纤维化的重要指标,血清PC-Ⅲ、Ⅳ-C和HA浓度越高,表示肝纤维化程度越严重,肝硬化的预后越不好。
目前,虽有多项RCT结果显示复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化的效果良好,不仅能够降低血清肝硬化指标,且能延缓肝纤维化进展,但还没有研究对这些RCT的结果进行系统、全面的评价。
结合本研究中的Meta分析、描述性分析结果及药理学证据[18],可见复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化能够降低患者血清ALT、AST、GGT、TBIL、PC-Ⅲ、Ⅳ-C和HA水平。但本研究中发现,各指标涉及的研究间的I2普遍偏高,即异质性偏大,部分采用文献逐篇剔除法也未找到异质性来源,而发现异质性来源依旧改变不了I2偏高的情况。另外,在分析TBIL和PC-Ⅲ时,发现P>0.05,出现数据无效的现象。分析其原因,可能包括:(1)样本量偏小;(2)5项RCT中对照组的处理方式存在差异;(3)研究对象的年龄、饮酒史和病程存在差异;(4)复方甘草酸苷和还原型谷胱甘肽的药品规格、使用剂量和用法存在差异;(5)只有2项RCT明确阐述了研究对象在进入研究之前未接受其他可能影响研究结果的治疗,其余3项RCT未进行相关阐述。
本研究的局限性:(1)未能检索到灰色文献,可能遗漏阴性结果;(2)初检及最终纳入的RCT数量均偏少;(3)各项RCT对于疗效的评价指标不完全一致;(4)各项RCT之间存在较大异质性,部分即使采用文献逐篇剔除法也未能减小异质性;(5)各项RCT未交待研究是否运用分配隐藏,可能导致结果存在发表偏倚;(6)未能纳入外文文献,可能因为种族或基因组差异,导致结果评价不具有统一性;(7)未对比复方甘草酸苷联合常规治疗酒精性肝硬化的治疗效果。
综上所述,复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化的效果较常规治疗优越,但原始文献的RCT研究质量偏低,使得Meta分析的运用空间受到限制,进而影响了Meta分析的可靠性。未来相关学者应在本研究基础上,完善RCT研究内容,提高RCT研究质量,为复方甘草酸苷联合还原型谷胱甘肽治疗酒精性肝硬化提供更为可靠的循证学依据。
