IgA 肾病合并贫血患者临床和病理特点分析
2020-11-24朱华艳朱鸣任凌燕戴竹泉张晓岚邱锋平王霄一
朱华艳 朱鸣 任凌燕 戴竹泉 张晓岚 邱锋平 王霄一
IgA 肾病是最常见的原发性肾小球疾病之一,其病理特征主要指肾小球系膜区以IgA 沉积为主,同时伴有肾小球系膜增生。其临床表现多种多样,最常见表现为血尿,可伴有不同程度的蛋白尿、肾功能受损及高血压等表现。已有研究表明,贫血是加速其病情进展的重要危险因素之一,早期干预可明显降低心血管及患者的远期死亡率[1]。本研究旨在通过回顾性分析法研究合并贫血的IgA 肾病患者临床和病理特征,为IgA 肾病的治疗及预后提供依据。
1 资料与方法
1.1 一般资料 收集2015 年11 月30 日—2019 年11 月30 日在浙江省湖州市第一人民医院肾内科住院,行肾穿刺活检术并且病理诊断为原发性IgA 肾病患者共105 例,其中女63 例,男42 例,年龄32~57岁。按照患者血红蛋白水平分为贫血组与非贫血组,其中贫血组40 例,非贫血组65 例。本研究已获得本院伦理委员会审核通过,符合《赫尔辛基宣言》伦理原则。所有患者知情同意并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)根据WHO 推荐,居住于海平面水平地区的成年人,男性血红蛋白<130g/L,非妊娠女性血红蛋白<120g/L,妊娠女性<110g/L,即可诊断为贫血[2]。(2)IgA 肾病的病理分级为lee 氏分级Ⅱ~Ⅲ级。排除标准:(1)继发性IgA 肾病,如过敏性紫癜相关性肾炎、原发性干燥综合症、关节炎、乙型病毒性肝炎、系统性红斑狼疮等全身性疾病合并的继发性IgA 肾病;(2)糖尿病、高血压等疾病及相关药物引起的肾损害;(3)行肾活检前估算的肾小球滤过率<15mL·min-1·1.73m-2;(4)病理数据资料或者临床数据资料欠完整的患者。
1.3 临床资料收集 收集患者临床相关指标,包括性别、年龄、血压(包括收缩压和舒张压)。实验室相关指标包括血清尿素氮、血清肌酐、血清胆固醇、24h尿蛋白定量、血清尿酸、血清三酰甘油、红细胞、血清白蛋白、血清高密度脂蛋白、血红蛋白、血清低密度脂蛋白。

表1 两组IgA 肾病患者临床指标比较
1.4 病理资料收集 肾脏病理标本选择光镜及免疫荧光检查,其中光镜下活检小球数目至少10 个以上,行HE 染色、PAS 染色、Masson 染色、六胺银染色,观察肾小球、肾小管及间质血管病变情况。新月体、节断硬化计数、球形硬化参考IgA 肾病Lee 氏分级标准,病理损伤积分参考Katafuchi 积分标准[3]:节段损伤、球性硬化积分为0~4 分;间质炎细胞、间质纤维化、小管萎缩积分为0~3 分;肾动脉病变(血管壁增厚或玻璃样病变)积分0~3 分。肾小管间质萎缩程度分级标准:0 级(无改变);1 级(0%~25%);2 级(26%~50%);3 级(51%~75%);4 级(>76%)。
1.5 统计学方法 应用SPSS 21.0 统计软件进行统计学数据处理。计数资料以绝对数或百分率表示。正态分布数据以均数±标准差() 表示,连续性数据或非正态分布数据以中位数(四分位间距)表示。计数资料的比较采用卡方检验,正态分布的数据采用独立样本t 检验,不符合正态分布的数据采用中位数检验。采用双变量相关法及线性回归分析危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床指标比较 与非贫血组比较,贫血组收缩压、舒张压、血清肌酐、血清尿素氮、血清胆固醇、24h 尿蛋白定量、血清尿酸、血清三酰甘油水平均显著升高,差异有统计学意义(P<0.01,P<0.05),见表1。
2.2 肾组织病理学改变 与非贫血组比较,贫血组患者新月体和肾小球硬化数目显著增多(P<0.05)。非贫血组患者的肾小管间质萎缩多以0 级和1 级为主(59/65,74.5%),贫血组则以1 级和2 级为主(37/40,92.5%),提示贫血组患者病理损伤更严重。见表2-3。
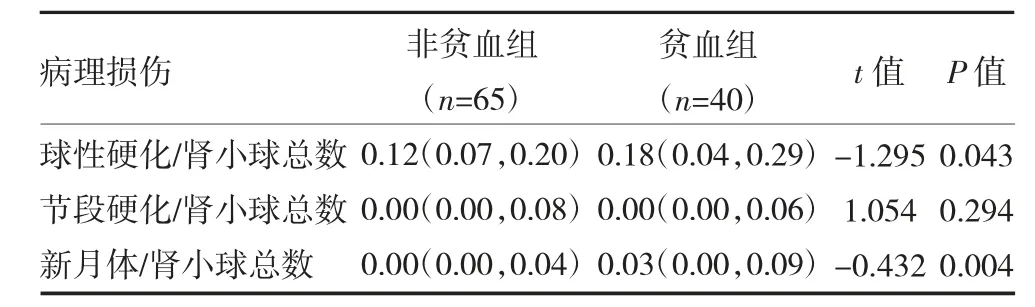
表2 两组IgA 肾病患者肾小球病理损伤程度比较[M(P25,P75)]
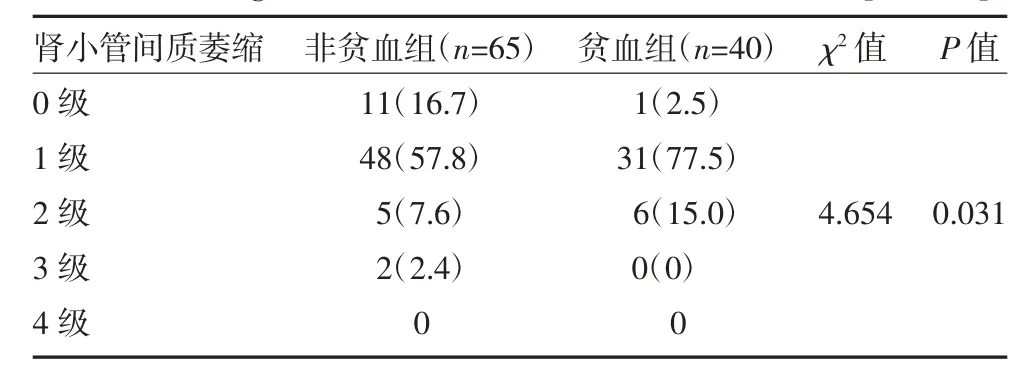
表3 两组IgA 肾病患者肾小管间质萎缩程度比较[例(%)]
2.3 两组IgA 肾病患者Katafushi 积分比较 对两组IgA 肾病患者的病理损伤积分进行比较发现,贫血组患者的节段损害、小球积分、血管壁增厚、间质炎细胞及间质纤维化的病理积分更高,差异有统计学意义(P 均<0.05)。见表4。
2.4 临床数据指标与肾脏病理损伤数据相关影响因素分析 血清肌酐分别与肾小球球性硬化、节段硬化、新月体及肾小管间质萎缩比率呈显著正相关(P均<0.01);血清尿酸分别与肾小球节段硬化、肾小管间质萎缩比率呈显著正相关(P 均<0.01);24h 尿蛋白定量分别与肾小球球性硬化、新月体及肾小管间质萎缩比率呈显著正相关(P 均<0.01);血红蛋白与肾小球节段硬化比率呈显著正相关(P<0.01),分别与新月体及肾小管间质萎缩比率呈显著负相关(P均<0.01)。见表5。
表4 两组IgA 肾病患者Katafushi 积分比较(分,)

表4 两组IgA 肾病患者Katafushi 积分比较(分,)
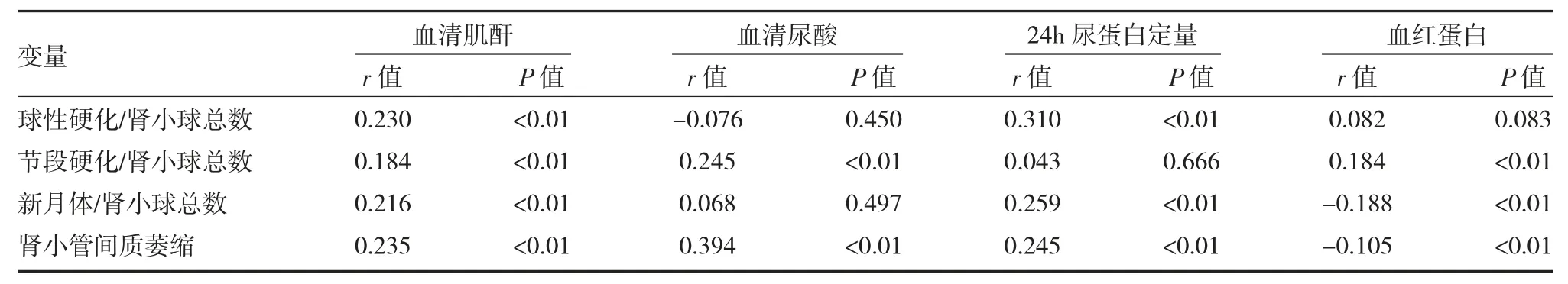
表5 IgA 肾病患者肾脏病理损伤相关影响因素分析
2.5 肾小管间质萎缩危险因素分析 将肾小管间质萎缩(>25%肾小管间质萎缩=1,≤25%肾小管间质萎缩=0)相关因素纳入回归方程,结果提示血红蛋白是肾小管间质菱缩的独立保护因素,而血清肌酐、血清尿酸和24h 尿蛋白定量是其独立危险因素(P<0.01),见表6。

表6 IgA 肾病患者肾小管间质萎缩相关因素分析
3 讨论
肾性贫血是慢性肾脏病进展过程中较为常见的并发症之一,与此同时它也是慢性肾脏病心脑血管系统的并发症和死亡率增加的独立危险因素之一[1],因此早期积极纠正贫血对改善慢性肾脏病(CKD)患者的预后具有非常重要的意义。曾有研究结果显示,相比普通人群,CKD 患者贫血的患病率至少高出2倍,可达15.4%,同时血红蛋白水平与估算肾小球滤过率(eGFR)也成线性正相关[4]。因此,研究肾性贫血对干预和改善IgA 肾病患者的预后以及肾脏存活率具有重要意义。
本研究发现,与非贫血组比较,贫血组IgA 肾病患者的收缩压、舒张压、血清肌酐、血清尿素氮、血清胆固醇、24h 尿蛋白定量、血清尿酸、血清三酰甘油水平均高,提示合并贫血组IgA 肾病患者的临床表现更加严重。一项关于CKD3~5 期患者贫血状况的单中心研究发现,肌酐随着血红蛋白下降而下降,且两者之间存在线性关系[5]。贫血不仅加重CKD 患者病情进展[6],更与心脑血管事件的发生密切相关,随之带来患者的住院率、死亡率随之升高,同时疾病临床情况也与贫血情况密切相关。由此可以把贫血作为评估CKD 进展的观察指标之一。
肾脏病理损伤与肾性贫血相互影响,一方面,肾小管间质改变导致EPC(EPO 生成细胞)受损,EPC转化为成纤维细胞,丧失生成EPO 的能力,从而导致红细胞生成减少[7],另一方面,贫血也反过来加重肾小球及肾小管的病理损伤。另外在低氧诱导因子(HIF-1)的作用下,肾小管间质会大量合成EPO[8],同时HIF-1 会产生一系列相关因子如血管内皮细胞生长因子、血小板衍生因子等,这些因子拮抗EPO 的生成,从而导致系膜细胞增生、间质纤维化,最终导致肾脏损害加重。本研究结果提示,与非贫血组比较,贫血组患者新月体和肾小球硬化数目显著增多,肾小管间质萎缩级别更高,提示贫血组在肾小球、小管间质损伤方面更加严重,进一步证实了贫血能够明显加重肾脏病理损伤。对两组IgA 肾病患者的病理损伤积分比较发现,贫血组患者的节段损害、小球积分、血管壁增厚、间质炎细胞及间质纤维化的病理积分更高,也进一步证实IgA 患者贫血与临床病理损伤存在一定相关性,其原因可能有以上多种机制参与。
动物实验已证实,贫血组大鼠的肌酐越高,肾脏病理损害越严重[9]。研究表明,血清肌酐、血清尿酸、24h 尿蛋白定量均与肾脏病理损伤相关,均可能提示疾病预后不良[10-11]。一项前瞻性队列研究结果发现,基础尿酸水平较高的人群发生肾脏疾病的风险远远高于基础尿酸正常的人群[12]。血尿酸可能通过肾脏缺血性损伤造成肾小球炎性细胞浸润及肾小管纤维化[13]。此外近期相关研究表明,IgA 肾病早期血尿酸轻度升高即可导致肾小管间质损伤,且与其损伤程度成线性正相关[14]。其发病机制可能与尿酸激活RASS 系统导致相关炎症介质和炎症因子产生,造成肾脏血管细胞、内皮细胞过度增生,过激的炎症反应等有关。有学者发现,24h 尿蛋白定量>1.0g 比定量<1.0g 的人群其肌酐下降明显,每年eGFR 平均下降6~7mL/min,且最终进入肾衰竭阶段的病程缩短[15-16]。本研究也进一步证实,血红蛋白与肾小球新月体及肾小管间质萎缩比率呈显著负相关,同时是肾小管间质萎缩的独立保护因素,而肌酐、尿酸和24h 尿蛋白与肾小球硬化、新月体及肾小球萎缩比率呈显著正相关,同时是肾小管间质菱缩的独立危险因素,这为IgA 患者的临床病情评估、治疗及预后等方面做出了很好的提示。
IgA 肾病是慢性进展性疾病,仅以单次血红蛋白水平来评估患者的预后存在一定的局限性。同时本研究以单中心医疗机构数据,样本数量有限,可能造成研究结果误差,有待于收集更多的病例资料进行进一步的研究。
综上所述,贫血是影响IgA 肾病患者临床损伤和病理损伤的重要因素之一,因此,早期纠正贫血对延缓慢性肾病的进展有重要意义。
