P16及FHIT基因异常表达在非小细胞肺癌发病机制中的研究
2020-11-19佘天宇佘真真徐海涛张庆广李文晶
佘天宇,佘真真,徐海涛,刘 帅,贾 腾,张庆广,李文晶
(1.滨州医学院附属医院 a.胸外科,b.肿瘤科,山东 滨州 256600;2.山东省无棣县人民医院普外科,山东 滨州 251900)
非小细胞肺癌(NSCLC)约占全部肺癌的85%,发病率约为45.39/10万[1],我国NSCLC每年新发病例约73.3万,死亡病例约59.1万[2]。原癌基因和抑癌基因参与NSCLC的发生发展,多个基因异常表达,长期积累下引起正常细胞增殖调控失常,细胞恶性增殖导致肿瘤发生[3,4]。NSCLC 基因异常表达的发病机制为临床研究热点,P16及FHIT基因为NSCLC主要的抑癌基因[5],当发生基因变异如杂合性缺失、DNA甲基化等情况,可能造成抑癌基因失活[6]。本研究分析P16及FHIT基因杂合性缺失、DNA甲基化与P16及FHIT蛋白表达缺失的关联,为NSCLC发病机制研究提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料2018年10月至2019年12月我院肺癌切除术NSCLC患者65例,均符合NSCLC诊断标准[7],术后病理确诊为NSCLC。收集NSCLC肿瘤组织标本和距离癌灶组织边缘5 cm以外的正常肺组织标本。男41例,女24例,年龄47~75岁[(61.39±7.22)岁];临床分期:Ⅰ期10例,Ⅱa期17例,Ⅱb期25例,Ⅲa期13例;病理分型:鳞癌37例,腺癌28例;有吸烟史45例。
1.2 仪器设备Taq DNA聚合酶、限制性内切酶(Takara公司),兔抗人P16单克隆抗体、兔抗人FHIT单克隆抗体(三生制药集团),Trizol试剂、免疫组化试剂盒(美国赛默飞世尔科技公司)。变性聚丙烯酰胺凝胶、硝酸银溶液等由实验室自行配置。主要仪器:ABI QuantStudio 7实时荧光定量PCR仪(美国赛默飞世尔科技公司),“六一牌”电泳仪(北京六一生物科技有限公司)。
1.3 方法
1.3.1聚合酶链式反应(PCR) 取10 mg组织标本研磨、匀浆,加入PBS溶液200 μl,离心6 min,弃上清,再加入Trizol试剂2 ml,在室温下培育5 min。向EP管中加入0.2 ml氯仿/1 ml Trizol,室温培育3 min。离心15 min吸取上层水相,加入0.5 ml异丙醇/1 ml Trizol再离心15 min。再弃上清,沉淀加入70%乙醇清洗,离心10 min。弃上清,取管底沉淀物DNA晾干10 min,干燥DNA沉淀物待检。P16及FHIT基因的PCR引物序列、反应体系及条件见表1。扩增产物在琼脂糖凝胶电泳上观察。
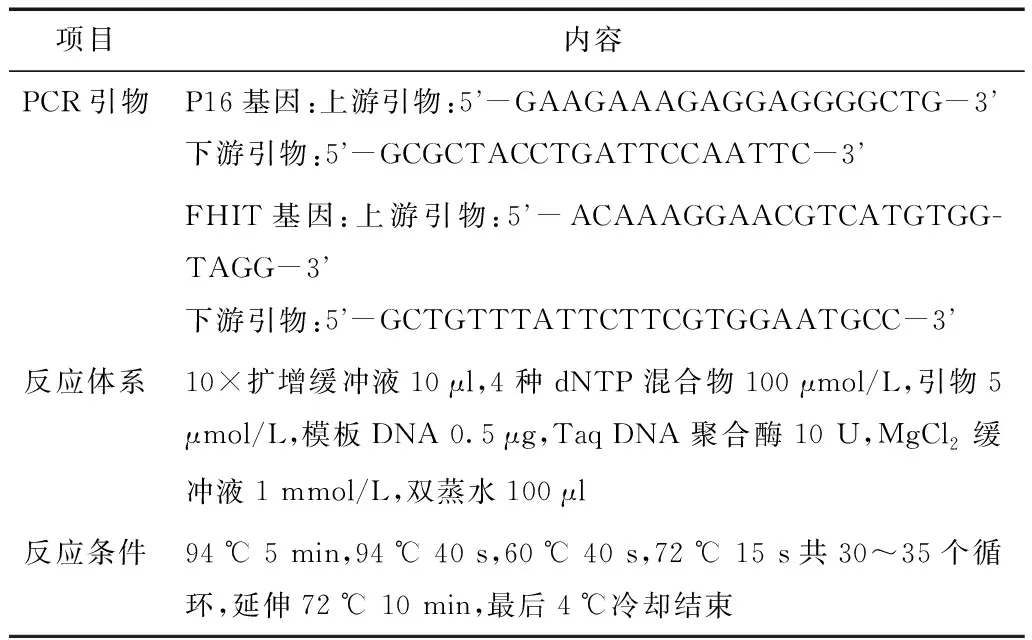
表1 PCR反应条件
1.3.2基因杂合性缺失检测 采用变性聚丙烯酰胺凝胶电泳-硝酸银染色法检测。方法:取PCR扩增产物8 μl,加入等体积双链DNA变性缓冲液,97 ℃变性10 min,经变性聚丙烯酰胺凝胶电泳分离。硝酸银染色法:将变性聚丙烯酞胺凝胶在双蒸水中漂洗一次,0.1%硝酸银溶液染色30 min,双蒸水中漂洗3次,加入3%碳酸钠溶液(含0.014%乙醇)显色,当DNA带较清晰时,倒掉显色液,加入7.5%冰乙酸终止。杂合性缺失判定标准:等位基因扩增信号缺失为(+)。
1.3.3DNA甲基化检测 采用限制性内切酶法处理。方法:取组织标本中提取的沉淀物DNA 3 μl,加入甲基化敏感限制性内切酶1 μl,25 ℃水浴过夜(未酶切处理的DNA为对照)。再进行PCR扩增,扩增产物进行琼脂糖凝胶电泳。DNA甲基化判定标准[8]:经限制性内切酶处理后的DNA仍能扩增出完整的DNA片段为(+)。
1.3.4免疫组化法检测蛋白表达 组织标本常规石蜡切片4 μm制片,放入80 ℃烘箱内烤片30 min。二甲苯、无水乙醇透明、脱水。再使用蒸馏水洗,封闭液室温孵育30 min,PBS缓冲液冲洗3次。采用链霉菌抗生物素蛋白-过氧化物酶法(SP法)。冲洗后,滴加10%非免疫羊血清封闭液,孵育30 min。加入兔抗人P16或FHIT单克隆抗体(一抗)过夜,以PBS缓冲液代替一抗为阴性对照,再加入标记有辣根过氧化物酶(HRP)的羊抗兔抗体(二抗)过夜。滴加DAB显色溶液,显微镜下观察特异性显色。免疫组化结果判定采取Bresalier半定量法,判定标准[9]:①阳性细胞评分:0分为阳性细胞<10%,1分为10%~25%阳性细胞,2分为26%~50%阳性细胞,3分为51%~75%阳性细胞,4分为≥76%阳性细胞;②显色深浅评分:0分为不显色,1分为浅黄色,2分为棕黄色,3分为棕褐色。两项评分相加,≥3分为蛋白表达阳性(+),<3分为蛋白表达缺失(-)。
1.4 统计学方法采用SPSS 22.0软件分析数据。计数资料比较采用χ2检验;关联性分析采用列联表χ2检验,并计算列联系数c;以Logistic回归分析筛选独立影响因素。检验水准ɑ=0.05。
2 结果
2.1 两组P16基因杂合性缺失、甲基化发生率以及P16蛋白表达情况比较NSCLC组织P16基因杂合性缺失发生率为58.46%,甲基化发生率为49.23%,蛋白表达缺失率为67.69%。正常肺组织未见P16基因杂合性缺失、甲基化、蛋白表达缺失。两组比较差异有统计学意义(P<0.05),见表2。

表2 两组P16基因杂合性缺失、甲基化发生率以及P16蛋白表达情况比较 [n(%)]
2.2 两组FHIT基因杂合性缺失、甲基化发生率以及FHIT蛋白表达情况比较NSCLC组织FHIT基因杂合性缺失发生率为70.77%,甲基化发生率为66.15%,蛋白表达缺失率为72.31%。正常肺组织未见FHIT基因杂合性缺失、甲基化、蛋白表达缺失。两组比较差异有统计学意义(P<0.05),见表3。
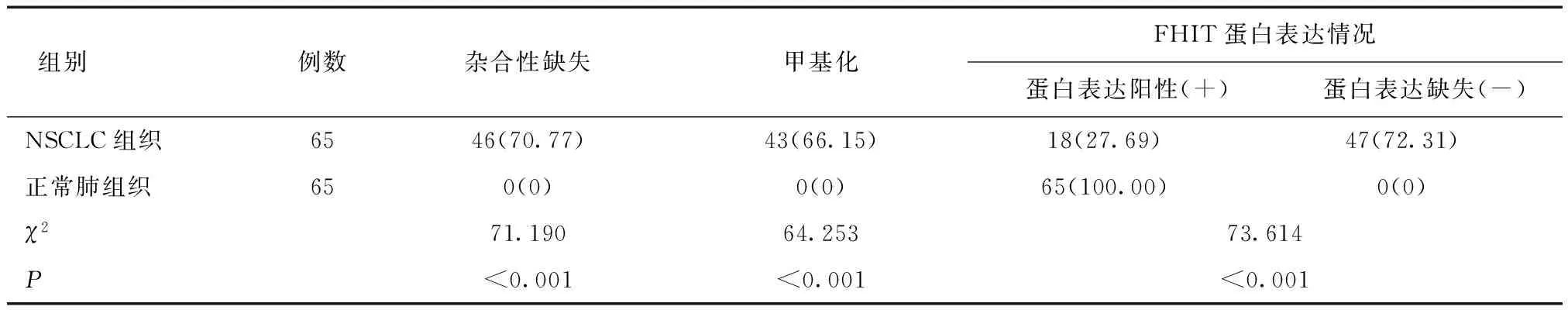
表3 两组FHIT基因杂合性缺失、甲基化发生率以及FHIT蛋白表达情况比较 [n(%)]
2.3 NSCLC组织P16基因杂合性缺失、甲基化与P16蛋白表达缺失的关联性分析P16基因杂合性缺失与P16蛋白表达缺失具有关联(χ2=15.340,列联系数c=0.437,P<0.001),见表4。P16基因甲基化与P16蛋白表达缺失具有关联(χ2=30.083,列联系数c=0.562,P<0.001),见表5。

表4 NSCLC组织P16基因杂合性缺失与P16蛋白表达缺失的关联性分析
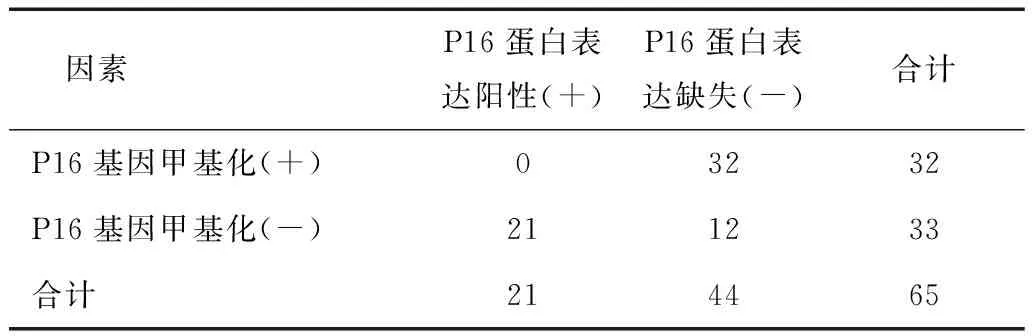
表5 NSCLC组织P16基因甲基化与P16蛋白表达缺失的关联性分析
2.4 NSCLC组织FHIT基因杂合性缺失、甲基化与FHIT蛋白表达缺失的关联性分析FHIT基因杂合性缺失与FHIT蛋白表达缺失具有关联(χ2=16.865,列联系数c=0.484,P<0.001),见表6。FHIT基因甲基化与FHIT蛋白表达缺失具有关联(χ2=40.827,列联系数c=0.621,P<0.001),见表7。

表6 NSCLC组织FHIT基因杂合性缺失与FHIT蛋白表达缺失的关联性分析

表7 NSCLC组织FHIT基因甲基化与FHIT蛋白表达缺失的关联性分析
2.5 P16、FHIT蛋白表达缺失与临床特征的影响因素分析临床分期是P16蛋白表达缺失的独立影响因素,性别、吸烟史是FHIT蛋白表达缺失的独立影响因素(P<0.05),见表8,表9。

表8 P16蛋白表达缺失与临床特征的影响因素分析

表9 FHIT蛋白表达缺失与临床特征的影响因素分析
3 讨论
恶性肿瘤发生发展受原癌基因与抑癌基因调控,P16及FHIT基因为NSCLC主要的抑癌基因,起负调节作用,与原癌基因相互制约,抑制肺上皮细胞异常增殖。P16基因位于人类染色体9p21,直接参与细胞周期的调控,负调节细胞增殖及分裂。大多数人类肿瘤细胞株纯存在P16基因杂合性缺失、甲基化、碱基置换突变或缺失等多种基因变异现象,可能与NSCLC易感性相关。本研究结果显示,在NSCLC组织中,P16基因杂合性缺失发生率为58.46%,甲基化发生率为49.23%,蛋白表达缺失率为67.69%,而在正常肺组织中未见P16基因杂合性缺失、甲基化、蛋白表达缺失;而且P16基因杂合性缺失与P16蛋白表达缺失具有关联。上述说明,NSCLC易发生P16基因杂合性缺失、甲基化,这与Wang等[10]、钟云华等[11]研究报道一致。而且这种基因突变造成了P16基因失活,导致P16蛋白表达缺失,丧失了P16基因的抑癌功能,肺上皮细胞周期G1期(DNA合成前期)向S期(DNA合成期)加速转变,G1期的DNA修复、RNA和核糖体准备不完善,过早的进入到S期,导致细胞恶性增殖发展为NSCLC。本研究还发现,临床分期是P16蛋白表达缺失的独立影响因素,临床分期高的患者P16蛋白表达缺失风险是临床分期低的患者的2.809倍,可以解释为:P16基因突变与临床分期升高存在相互效应,P16基因突变越多,蛋白质表达缺失也相应增多,患者越易发生细胞恶性增殖,也使得NSCLC生物学行为趋向于恶性。黄芬芬等[12]研究也证实,P16基因突变与NSCLC肿瘤分期具有相关性。
FHIT基因位于人类染色体3p14.2,目前研究发现大多数肺癌患者存在FHIT基因突变及蛋白表达缺失。本研究结果显示,在NSCLC组织中,FHIT基因杂合性缺失发生率为70.77%,甲基化发生率为66.15%,蛋白表达缺失率为72.31%,而正常肺组织未见FHIT基因杂合性缺失、甲基化、蛋白表达缺失;而且FHIT基因杂合性缺失与FHIT蛋白表达缺失具有关联。上述说明,NSCLC易发生FHIT基因杂合性缺失、甲基化,而且这种基因突变造成了FHIT基因失活,导致FHIT蛋白表达缺失。Geng等[13]研究也表示,NSCLC易发生FHIT基因甲基化。刘莹等[14]研究指出FHIT基因甲基化水平升高,NSCLC患病风险增加2.927倍,这对NSCLC具有较高的诊断价值。FHIT基因的抑癌作用尚不明确,Lee等[15]研究指出可能与诱导癌细胞凋亡有关,FHIT蛋白是一种肿瘤抑制蛋白,通过14-3-3τ诱导NSCLC细胞自噬。本研究还发现,性别、吸烟史是FHIT蛋白表达缺失的独立影响因素,男性、吸烟者的FHIT蛋白表达缺失风险是女性、不吸烟者的2.442倍、4.433倍。FHIT基因与吸烟密切相关,FHIT基因可能是烟草致癌物诱发癌变的靶基因。肺癌男性发病率通常高于女性,FHIT蛋白表达缺失率也较高,可能是因为男性患者吸烟率较高。
综上所述,P16及FHIT基因异常表达在NSCLC的发生发展中起重要作用,发病机制可能与P16及FHIT基因的杂合性缺失和甲基化导致的P16及FHIT蛋白表达缺失有关。P16及FHIT蛋白表达缺失,造成抑癌基因对细胞正常生长负调节的作用失控,导致NSCLC发生。在临床上,检测P16及FHIT基因突变情况,或许有助于NSCLC的诊断、分型及治疗,这可作为下一步的研究方向。
