雷公藤红素对A549肺癌细胞增殖及自噬的影响
2020-11-17赵楠穆春青王红王秋宁才志阳
赵楠,穆春青,王红,王秋宁,才志阳
(1.锦州医科大学附属第一医院转化医学研究院;2.锦州医科大学药理教研室;3.锦州医科大学附属第一医院药品管理科,辽宁 锦州 121000)
肺癌分类中以非小细胞癌最为常见[1],且发现时常常已处于晚期,治疗晚期非小细胞癌的一线药物为铂类药物,但长时间使用此类药易导致机体的耐药性。文献表明,很多中药成分可以单独或联合铂类药物治疗肺癌,减少肿瘤转移或增殖[2-4]。雷公藤红素是雷公藤中一种天然化合物,除具有抗炎作用外,还可抑制肿瘤细胞的增殖[5-6]。自噬是一种真核细胞维持细胞稳态的特殊机制,是一个动态发展的过程,生理状态下自噬可以清除体内受损的细胞器和蛋白质[7-8]。近年来,自噬现象在不同肿瘤中被广泛观察到,有研究表明自噬在肿瘤的发生发展中有着“双面”作用[9],它既可以在适当的条件下通过减少有害因素保护肿瘤细胞[10-11],又可以在过度作用时诱导肿瘤细胞的死亡[12-14]。有文献表明,雷公藤红素可以诱导细胞自噬,从而抑制多种肿瘤细胞如宫颈癌、前列腺癌、骨肉瘤等的增殖或迁移[15-17]。但雷公藤红素对A549肺癌细胞的增殖及自噬的相关研究相对较少,故本研究主要探讨雷公藤红素对A549肺癌细胞的增殖及自噬的影响。
1 资料与方法
1.1 一般资料
人肺癌细胞A549由锦州医科大学王秋宁老师提供;MTT购自纳川公司;雷公藤红素购自鸿汲康润生物医药公司;结晶紫购自碧云天生物技术公司;Trizol购自invitrogen公司;反转录试剂盒及SYBR荧光定量购自锐博生物科技有限公司;β-actin、LC3B、P62、Beclin 1基因引物购自上海生工;蛋白提裂解液、BCA测定试剂盒、凝胶制备试剂盒购自北京索莱宝科技有限公司;兔抗人一抗β-actin、LC3B、P62、Beclin 1购自万类生物科技公司;HRP羊抗兔二抗购自Proteintech公司。
1.2 方法
1.2.1 细胞培养
复苏细胞,加入含有双抗(100 U/mL青霉素+100 μg/mL链霉素)和10%胎牛血清的DMEM培养基,细胞置于37 ℃,5% CO2的培养箱中,传5代后取对数期细胞实行后续实验。
1.2.2 MTT检测细胞增殖情况
于96孔板每孔接种约5×104个细胞,置于培养箱中24 h待细胞贴壁稳定,次日分别应采用0、1、2、3、4、5和6 μmol/L雷公藤红素处理A549细胞0、24、48、72 h。配制MTT溶液,取出96孔培养板,在所需检测孔中加入20 μL MTT溶液培养4 h,后吸掉培养液,加入150 μL DMSO,读取490 nm处吸光度(A)值。细胞增殖率=A实验组/A对照组。
1.2.3 结晶紫染色法检测细胞集落形成
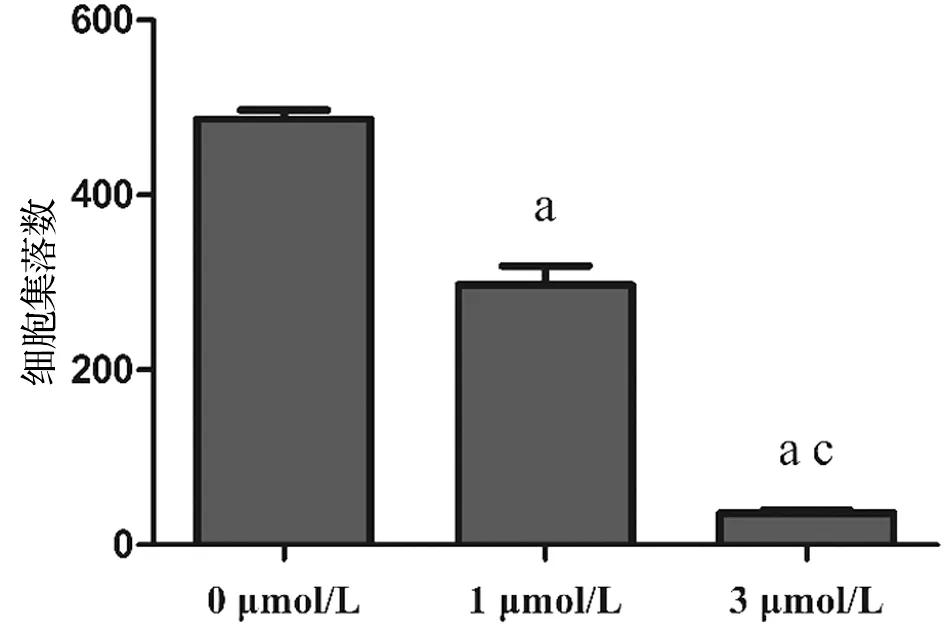
于12孔板每孔接种约1×103个细胞,置于培养箱中24 h待细胞贴壁稳定,次日分别采用0、1、3 μmol/L雷公藤红素处理A549细胞,连续培养7 d,取出12孔板弃培养基,PBS缓冲液清洗1遍,用4%多聚甲醛固定约10 min,三蒸水冲洗3遍,再用结晶紫染色10 min,三蒸水冲洗干净拍照。
1.2.4 实时定量PCR检测LC3B、P62、Beclin 1的mRNA水平
雷公藤红素0、1、3 μmol/L处理细胞48 h,弃去培养液PBS清洗3次,Trizol法提出总RNA后反转录为cDNA,-80 ℃保存。15 μL PCR反应总体系:7.5 μL SYBR+5.9 μL水+1 μL cDNA+0.6 μL引物,反应程序:95 ℃ 3 min;40×(95 ℃ 15 s,60 ℃ 30 s,72 ℃ 15 s)。引物序列如下:β-actin正向引物为5′- CATGTACGTTGCTATCCAGGC-3′,反向引物为5′- CTCCTTAATGTCACGCACGAT-3′;LC3B正向引物为5′-AAGAGTGGAAGATGTCCGGC3′,反向引物为5′-TGCAAGCGCCGTCTGATTA-3′;P62正向引物为5′-AGTCTCTGGCGGAGCAGATGA-3′,反向引物为5′-TCTGGCATCTGTAGGGACTGGA-3′;Beclin 1正向引物为5′-ATCTAAGGAGCTGCCGTTATAC-3′,反向引物为5′-CTCCTCAGAGTTAAACTGGGTT-3′。
1.2.5 Western blot检测LC3B、P62、Beclin 1蛋白水平
雷公藤红素0、1、3 μmol/L处理细胞48 h,弃去培养液PBS清洗2~3次,提取蛋白并测定蛋白浓度,每孔上样量为30 μg。根据蛋白分子量配制相应浓度的凝胶,后将蛋白条带转印到PVDF膜上,封闭液室温封闭2 h,后加入一抗冷库过夜,次日TBST漂洗2~3次,加入二抗室温孵育1 h,TBST漂洗2~3次后呈像定影。
1.3 统计学方法
使用SPSS 17.0统计软件进行数据分析,采用单因素方差分析及两两比较的q检验,P<0.05为具有统计学意义。
2 结 果
2.1 雷公藤红素可以抑制A549细胞增殖
雷公藤红素0、1、2、3、4、5、6 μmol/L处理A549细胞,随着浓度与时间增强,细胞增殖抑制作用越明显。根据不同浓度及时间对细胞数量及生长状态的影响,后续实验浓度选用0、1、3 μmol/L,处理时间选择48 h。
2.2 雷公藤红素可以抑制A549细胞集落形成
雷公藤红素0、1、3 μmol/L处理细胞7 d,与0 μmol/L组比较,经1、3 μmol/L处理的A549细胞集落形成显著减少,差异具有统计学意义(P<0.05),见图2。
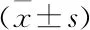
表1 细胞增殖率比较
图1 雷公藤红素对A549细胞增殖的影响

注:aP<0.05 vs 0 μmol/L雷公藤红素;cP<0.05 vs 1 μmol/L雷公藤红素
表2 各组细胞集落数量比较
2.3 雷公藤红素可以上调A549细胞LC3B、Beclin 1、P62的mRNA水平
雷公藤红素0、1、3 μmol/L处理细胞48h,与0 μmol/L组比较,经1、3 μmol/L处理的A549细胞中LC3B、Beclin 1的mRNA水平显著升高,经3 μmol/L处理的A549细胞中P62的mRNA水平显著升高,差异具有统计学意义(P<0.05),见图3。

注:aP<0.05 vs 0 μmol/L雷公藤红素;cP<0.05 vs 1 μmol/L雷公藤红素
2.4 雷公藤红素可以上调A549细胞LC3B、Beclin 1的蛋白表达水平、降低P62的蛋白表达水平
雷公藤红素0、1、3 μmol/L处理细胞48 h,与0 μmol/L组比较,经1、3 μmol/L处理的A549细胞中LC3B、Beclin 1蛋白水平显著升高;P62 蛋白水平显著降低,见图4。
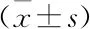
表3 PCR检测中LC3B、Beclin 1及P62蛋白表达水平
注:aP<0.05 vs 0 μmol/L雷公藤红素;cP<0.05 vs 1 μmol/L雷公藤红素
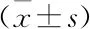
表4 Western blot检测中LC3B、Beclin 1及P62蛋白表达水平
3 讨 论
近年来研究显示,雷公藤红素不仅具有抗炎、抗氧化等作用,还可以抑制多种肿瘤细胞的增殖。自噬是一种II型程序性细胞死亡,很多研究表明自噬与肿瘤的发展存在密切关系,自噬对于肿瘤细胞而言,虽然具有“双面”作用,但许多研究表明,诱导自噬可以抑制肿瘤的发展[18-20]。近些年,雷公藤红素对多种肿瘤细胞的抑制作用及相关机制已经得到了充分的证实,但其对A549肺癌细胞的作用尚无太多文献报道,故本研究首先采用MTT方法,通过查阅雷公藤红素对其他肿瘤的作用浓度[21-23],初步选用0、1、2、3、4、5、6 μmol/L的雷公藤红素作用于A549细胞24 h、48 h和72 h,从而检测药物对细胞增殖能力的影响。结果发现雷公藤红素可浓度/时间依赖性抑制A549细胞增殖。在确定雷公藤红素可以抑制A549细胞增殖后,选取3种浓度0、1、3 μmol/L和处理时间(48 h)作为后续实验浓度及时间。采用结晶紫染色法观察药物对肿瘤细胞集落的形成,结果发现,随着药物浓度的增大,活细胞数量显著减少,这进一步证实了雷公藤红素可以抑制A549肿瘤细胞的生长,促进细胞死亡。目前,许多研究结果已经证实雷公藤红素可以抑制或诱导对多种肿瘤细胞的自噬作用,从而对细胞的生存及生长产生不同的影响,但却较少有雷公藤红素对A549细胞中自噬作用的研究,所以本研究选取自噬相关指标Beclin 1、LC3B及P62[24-26],通过对其基因及蛋白水平结果的分析,进而探讨雷公藤红素对A549细胞的自噬影响。Beclin 1作为自噬体形成过程中的关键蛋白,它可以促使自噬体膜的形成进而诱导自噬[27-28]。LC3是公认的自噬标记物,LC3B作为其中的一种蛋白,它的表达与自噬诱导相关,也是自噬体形成的标志。P62是一种泛素结合蛋白,可以反映自噬活性,当过度自噬时P62蛋白被降解,反之则不断累积。本研究结果显示,经雷公藤红素处理A549细胞后,Beclin 1和LC3B的mRNA及蛋白表达水平均升高;P62 mRNA表达水平升高,但最终蛋白表达降低,这可能是由于在自噬增强时,P62的表达原本也是增多的,但由于自噬发生时蛋白降解速度快,所以在进行蛋白检测时是降低的,mRNA检测时是增多的[29-31]。综合以上结果表明,雷公藤红素可以增强A549细胞的自噬活性。虽然本研究结果与部分雷公藤红素对肿瘤细胞的自噬作用结果相似,但尚不能确定A549细胞增殖抑制与自噬增强之间的关系,故雷公藤红素对A549细胞增殖抑制与自噬增强的机制还需进一步研究。
综上所述,本研究证实了雷公藤红素可以抑制A549细胞增殖,并初步证实雷公藤红素可以促进A549细胞的自噬,但自噬的增强对A549细胞的具体作用有待进一步研究。
