骨髓间充质干细胞治疗小鼠糖尿病模型的实验研究
2020-11-17沈晓颖杨宁高瑜单伟
沈晓颖,杨宁,高瑜,单伟
(1.锦州医科大学基础医学院解剖学教研室;2.锦州医科大学附属第一医院,辽宁 锦州 121000;3.山东青岛市黄岛区人民医院,山东 青岛 266000;4.锦州医科大学附属第一医院眼科,辽宁 锦州 121000)
II型糖尿病(T2DM)是全球最常见的慢性疾病之一,常常会引起大血管和微血管并发症[1]。在T2DM治疗上,目前仍然是以改善高血糖水平以及提高目标组织中胰岛素反应为目标。此外,由于大多数患者治疗依从性较低,很多患者血糖控制的不好[2]。肥胖抑制素(OB)是一种有争议的肠道激素。它是由23氨基酸组成的多肽,由编码饥饿素(Ghrelin)的同一基因编码。因为它对食物的摄取有抑制作用,故此命名为肥胖抑制素[3]。肥胖抑制素最初是从老鼠的胃中分离并提取出来,后来,在胰腺中也发现了产生肥胖抑制素的细胞。肥胖抑制素多表达在胎儿、新生儿和成人胰腺中,在胰腺发生发育和维持体内平衡中发挥着关键作用[4]。 通过对肥胖小鼠的血液中的肥胖抑制素的研究,发现其浓度水平较正常小鼠降低,这表明低浓度的肥胖抑制素可能通过自分泌/旁分泌机制影响胰腺[5]。此外,体外研究表明肥胖抑制素可增强胰岛β样细胞功能,这为我们采用新的细胞替代疗法策略治疗糖尿病提供了思路。
间充质干细胞(MSCs)是具有多向分化潜能成体干细胞中的一种,能够对受损组织进行微环境改造,通过抗炎和抗凋亡介质促进组织再生和修复[6]。因此,本研究观察MSCs联合OB对T2DM小鼠胰腺β细胞内分泌功能损伤的治疗潜力。
1 实验材料与方法
1.1 实验材料
1.1.1 实验动物
50只昆明小鼠,体重40~50 g,雄性,在恒温恒湿环境的动物饲养房中饲养,定期更换垫料以及消毒环境。允许自由进食和饮水。
1.1.2 主要试剂
兔抗CD105、 Bax、insulin抗体、购于北京博奥森生物技术公司。胰岛素和血清C肽ELISA试剂盒购于上海恒远生物科技有限公司。STZ、肥胖抑制素购于Sigma-Aldrich化学公司。低糖DMEM/F12,MEM培养基、FBS、GFP质粒、Lipofectamine2000、MTT购于Gibco-Invitrogen公司。
1.2 实验方法
1.2.1 BM-MSCs细胞培养、鉴定及GFP标记
用含有2 mL EDTA的 PBS从小鼠胫骨中冲出骨髓细胞。用15 mL的Ficoll-Paque分离液对35 mL的稀释细胞小心地进行分层,以400 ×g速度进行离心30 min,丢掉上清层,留下中间单核细胞(MNC)层。吸出MNC层,在PBS中洗2次,并在900×g转速下离心10 min。用300 μL的缓冲液重新悬浮细胞。分离的MSCs在25 mL的培养瓶中采用MEM培养基(15%的胎儿牛血清),并在37 ℃和5%的二氧化碳培养箱中培养。倒置显微镜观察细胞生长情况。通过流式细胞仪检测CD29和CD90。
当MSCs生长到对数生长期时,细胞接种到培养皿中过夜。当达到30%~50%壁率时,将GFP表达载体质粒2 μg和脂质体2 mL分别溶于100 mL无抗生素、无血清的MEM培养基中,充分混匀后,室温放置15 min,再将两种溶液充分混匀,室温放置30 min。同时用无血清、无抗生素的MEM洗涤待转染的培养细胞2~3次,向DNA-脂质体混合物中加入800 mL无抗生素、无血清的MEM培养基,混合后加入到培养细胞中。培养皿放入37 ℃孵箱孵育6~8 h后吸去双无培养液,加入2~3 mL含抗生素和10% FBS的DMEM完全培养基,继续培养24~72 h。使用荧光显微镜观察标记MSCs细胞荧光情况。
1.2.2 T2DM模型制备与实验分组
给予动物高脂饮食(HFD)饲养8 w,通过腹腔注射给予小鼠单次低剂量的STZ(30 mg/kg)。经过5 d的STZ注射后,通过血糖仪检测葡萄糖。当葡萄糖水平超过160 mg/dL的小鼠确认为糖尿病模型成功。实验分为5组,每组动物10只:
I组(对照组):小鼠正常饮食饲养8 w,不给予任何干预措施;II组(T2DM):T2DM小鼠,不接受治疗;III组(T2DM+MSCs):T2DM小鼠给予MSCs移植治疗,连续2次(2×106)首次在1 w后通过尾静脉注射,第2次是在3 w后注射;IV组(T2DM+OB):T2DM小鼠按照100 μg/kg浓度1天2次通过皮下注射OB;V组(T2DM+MSCs+OB):T2DM小鼠MSCs联合OB治疗。
1.2.3 血液样本和组织收集
胸骨左侧做一横切口,暴露肋骨。在第五和第六肋骨之间用弯钳扩大间隙,暴露心脏,从右心室抽取血液样本。继续切开腹膜暴露胰腺并切除,胰腺组织10%福尔马林液固定,行组织学和免疫组织化学检查。
1.2.4 肥胖评估与生化检测
每周记录各组实验动物体重。长度采用鼻尖-肛门的长度为测量标准。通过肥胖参数身体质量指数(body mass index,BMI)(BMI = 体重/长度的平方,g/cm2)确定肥胖程度。空腹血糖通过葡萄糖氧化酶-过氧化物酶法进行检测。而空腹血清胰岛素水、C肽血清总胆固醇(TC)、甘油三酯(TG)和高密度脂蛋白胆固醇(HDL-C)采用酶联免疫试剂盒进行检测。
1.2.5 稳态模式评估
抗胰岛素性稳态模式评估计算方程为HOMA-IR = 胰岛素(μIU/mL)×葡萄糖(mmol/L)。β细胞功能体内稳态模式评估测量公式为HOMA-β = 20×胰岛素(μIU/mL)/(葡萄糖)(mmol/L)。
1.2.6 免疫组织化学检测及形态学定量分析
胰腺组织石蜡包埋,5 μm切片,0.3%的过氧化氢阻止内源性过氧化物酶活性。5%的牛血清白蛋白减少非特异性结合。分别滴加兔抗CD105抗体、兔抗Bax抗体、兔抗insulin抗体孵育1 h,然后加入HRP标记的二抗。DAB显色并适时终止显色。胰岛素和Bax免疫组化表达的定量分析采用随机选取5个非重叠区域的5张图片进行量化,用图像分析软件计算区域内阳性细胞的平均百分比。
1.3 统计分析方法
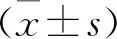
2 结 果
2.1 MSCs和OB对T2DM小鼠体重、BMI、血糖、胰岛素、C肽、HOMA-IR和HOMA-β的影响
T2DM组与对照组相比,体重、体重指数、血清葡萄糖和HOMA-IR水平显著升高(P<0.05),而胰岛素、C肽和HOMA-β水平显著降低(P<0.05)。MSCs治疗组与T2DM组相比,血清葡萄糖和HOMA-IR明显下降(P<0.05),同时血清胰岛素、C肽和HOMA -β明显增加(P<0.05)。然而,在体重和BMI方面MSCs治疗组未能产生显著影响。另一方面,OB治疗组(IV组)较T2DM组动物在体重、体重指数、血清葡萄糖和HOMA-IR参数上明显降低(P<0.05),同时胰岛素、C肽和HOMA-β水平显著增加(P<0.05)。MSCs与OB联合应用组(V组)以上各参数均达到控制水平。另外,IV组较III组动物在体重、BMI、血糖、HOMA-IR上有降低(P<0.05),同时HOMA -β有明显增加,P<0.05,见表1。

表1 各组动物体重、BMI、血清葡萄糖、胰岛素、C肽、HOMA-IR和HOMA-β水平
2.2 MSCs和OB对T2DM小鼠血脂的影响
与对照组相比,给予高脂饮食(HFD)和STZ处理(II组)的动物TC、TG、LDL水平显著升高(P<0.05),而 HDL显著降低(P<0.05)。与T2DM组相比,给予MSCs或OB治疗后的动物血清TC、TG和LDL均显著降低(P<0.05),而HDL显著升高(P<0.05)。另一方面,V组(T2DM+MSCs+ob)的脂质水平接近于控制水平。与III(T2DM+MSCs) 相比,IV组(T2DM+ob)TC、TG、LDL水平显著降低(P<0.05),这表明OB较MSCs具有更好的保护作用,见表2。

表2 不同动物组的脂质分布水平
2.3 免疫化学结果
免疫组织化学结果显示:治疗组胰腺组织中CD105表达阳性,表现为细胞质呈褐色染色。表明移植的MSCs的存活了下来,见图1A。CD105阳性细胞分布在正常胰岛周围的边缘部位,有的甚至定位在β细胞上,见图1A。胰腺组织中GFP的表达阳性,显示细胞活力良好,见图1B。

A:移植MSCs中CD105的表达;B:移植MSCs中GFP的表达,400倍
2.3.1 胰岛素免疫组织化学染色
I组可见移植小鼠的胰腺胰岛β细胞呈强阳性染色,可见明显的分泌颗粒,见图2A;而II组小鼠的胰腺胰岛β细胞显示的分泌颗粒染色强度有所减弱,见图2B;然而,III组小鼠的胰腺β细胞染色强度较与组II相比又有所回升,见图2C;IV组与II组比较胰岛β细胞染色强度也相对有所回升,见图2D;另外,V组较II组胰岛β细胞染色强度显著增强,见图2E。
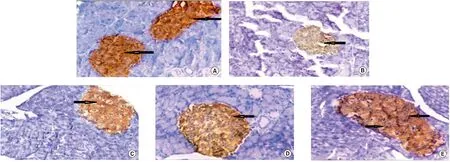
A:I组小鼠胰岛β细胞分泌颗粒染色强阳性;B:II组胰岛β细胞分泌颗粒染色呈弱阳性;C:III组小鼠胰岛β细胞分泌颗粒染色中等强度;D:IV组胰岛β细胞分泌颗粒呈中等强度;E:V组胰岛β细胞分泌颗粒染色呈强阳性,400倍
2.3.2 Bax免疫组织化学染色
I组小鼠胰岛细胞Bax免疫染色呈阴性,见图3A;II组胰岛细胞Bax免疫染色呈高表达,提示小鼠细胞凋亡率增高,见图3B;III组小鼠胰岛切片显示胰岛Bax免疫染色呈弱阳性,见图3C;同时,第IV组小鼠胰腺切片显示胰岛Bax免疫染色呈弱阳性,见图3D;最后,V组小鼠胰腺切片上胰岛细胞Bax表达最低,见图3E。
2.4 图像测量结果
各组胰岛素免疫染色的平均面积百分比见表3。与I组比,II组胰岛素免疫染色平均面积百分比有明显降低(P<0.05),而治疗组(III组和V组)较II组胰岛素免疫染色平均面积百分比有显著增加(P<0.05)。此外,V组与对照组比较,差异无统计学意义。同样,表3显示Bax免疫染色的平均面积百分比。与对照组相比II组面积有显著增加(P<0.05),而III组和IV组表达平均面积百分比较组II有明显降低(P<0.05)。V组与对照组比较,差异无统计学意义。

表3 各组动物胰岛素和Bax免疫染色平均面积百分比(%)

A:I组小鼠β细胞组织化学染色阴性;B:II组胰岛Bax免疫染色呈强阳性;C:III组小鼠胰岛Bax免疫染色呈弱阳性;D:IV组小鼠胰岛Bax免疫染色呈弱阳性;E:V组胰岛Bax免疫染色低表达,400倍
3 讨 论
在本研究中,经高脂饲养8 w联合STZ注射导致动物体重指数显著增加,而HOMA-IR的增加则表明血清葡萄糖的胰岛素抵抗增强,HOMA -β的降低表明了胰腺胰岛素显著减少和β细胞功能的下降。本研究还发现糖尿病小鼠血清C肽水平降低。血清C肽水平是胰岛素水平变化的真实指标,因为它是胰岛素原酶降解成胰岛素的副产物,与胰岛素共同分泌。免疫组化显示胰岛素染色强度降低。表明HFD联合STZ可诱导T2DM小鼠模型发生进展性的β细胞功能障碍。Song等[6]468-475研究也认为STZ给药后,胰腺组织出现退行性组织学改变和胰岛萎缩,B细胞的胰岛素反应变弱。他们认为STZ通过产生活性氧、激活胰腺NF-κB和诱导免疫反应和炎症等几种机制破坏胰岛细胞。
目前的研究显示,通过MSCs移植控制了胰岛损伤,表现为葡萄糖,胰岛素抵抗,血清胰岛素、C肽、β细胞功能有了显著改善。这些结果与Mansor等人[7]的研究结果一致,他们认为MSCs具有组织修复和细胞保护的特性,这可能是由于MSCs对损伤胰腺组织具有优先归巢的特性,而且胰岛重建效果显著。此外,MSCs治疗显著提高胰岛素敏感性以及降低胰岛素抵抗。这些结果表明,MSCs可以通过调节外周靶组织的胰岛素敏感性来降低高血糖[8]。
MSCs通过使胰岛组织结构的恢复从而改善了糖尿病的指标。III组结果显示胰岛素的免疫反应活性增强以及胰岛Bax反应的降低,这也从另一个角度说明了MSCs的对糖尿病的改善作用。另一方面,给予OB后,体重指数、血清葡萄糖、胰岛素抵抗明显降低,而血清胰岛素、C肽水平、胰腺组织β细胞功能显著增加。通过HE染色发现动物胰岛组织结构改善、胰岛素免疫反应活性增加和胰岛Bax反应降低,这3个方面都证明了OB的改善作用。
Shamaony等[9]针对糖尿病小鼠血脂异常高的现象,指出了胰岛素抵抗会促进胆固醇的生成。血清LDL-C水平的升高可能是LDL-C非酶糖基化的结果,也可能是LDL-C清除率降低的结果。在本研究中,MSCs对糖尿病小鼠的治疗使血脂表达正常。这个结果与Ahmed[10]等人的一致,他们认为血脂的改善是因为MSCs改善了胰岛β细胞功能,并降低胰岛素抵抗。另一方面,本研究中给予OB后显著改善了血脂情况。Granata等[11]对TG和TC降低给出了另一种解释,他们认为可能是由于OB对肠道TG的吸收产生了影响。此外,OB可以通过刺激脂肪酸的摄取和抑制其释放或脂解,参与到食物摄入和能量稳态的神经内分泌调节过程。
此外,与未接受治疗的糖尿病小鼠相比,接受OB治疗的糖尿病小鼠的BMI明显下降。Baragli等[12]研究表明,在服用了OB的肥胖小鼠体重指数下降,认为其食物摄入量的减少和产生厌食症的作用。通过比较OB和MSCs治疗的效果,发现OB在体重、体重指数、血清葡萄糖、TC、TG、LDL、HOMA-IR和HOMA-β 等方面有优越的保护作用。这种保护作用可能是与OB的厌食作用和食物摄入量的减少作用有关。
