心房颤动的转子机制与标测
2020-11-12秦牧刘韬刘旭
秦牧 刘韬 刘旭
折返是心房颤动(房颤)维持的关键。利用目前最新的标测方法,在基础和临床研究模型中可识别出由螺旋波产生的折返活动——转子。转子作为房颤重要的驱动机制,现已被大量研究所证实。然而,转子的特性和转子消融的效果仍需进一步深入探讨。为此,我们总结了转子标测与消融相关的基础和临床研究,并对其发展历史和现状进行系统综述。
1 房颤理论的演变和转子概念的提出
1913年,Mines等[1]首次提出了基于解剖异常的折返激动机制,随后Lewis[2]将这一理论整合为“折返引起的环形激动假说”(图1A),即由于折返环的大小和组织不应期的差异,围绕解剖障碍的折返激动可引起心房扑动或颤动样的电活动。1949年,Scherf等[3]发现在犬的右心耳心外膜面给予小剂量乌头碱可产生局灶激动,进而诱发房速或房颤(图1B)。1959年,Moe等[4]提出了多子波学说,即房颤的维持需要15~30个子波,并发表了经典的多子波计算机模型(图1C)[5]。1985年,Allessie等[6]通过犬类在体研究发现,房颤的维持仅需4~6个子波。Wang等[7]发现应用ⅠC类抗心律失常药物可以通过减少子波的数量抑制房颤。由此,多子波学说得到了广泛认同[8-10]。然而,这些子波形成及维持的电生理机制并未得到详尽阐明。1973年,Allessie等[11]发现兔的心房中存在不依赖解剖障碍的功能性折返,并提出了主导环学说(图1D),认为该折返不依赖解剖屏障,且波长越短、心房越大,同时存在的主导折返环越多,而这些折返环的稳定存在可以成为房颤维持的基础。然而,后续基础和临床研究显示,房颤电活动的抑制并不依赖于波长的缩短[12]。随后,对功能性折返的进一步研究逐渐引出了螺旋波的概念(图1E)。1990年,螺旋波于离体的羊心脏中首次被发现,且研究证实螺旋波在心室中快速移动可引起室颤[13-14]。然而,同步激动标测并未在离体羊房颤模型中发现稳定的螺旋样激动;直到光学标测方法的引入,才使得研究者能更详细地定义和描述螺旋波。1998年Gray等[15]首次通过光学标测记录到了由组织传导功能和不应期的异质性触发的转子样螺旋波。
2 转子的电生理机制
2.1 转子的形态学特点
转子作为“螺旋波发生器”,是一种在二维平面上做旋转运动而形成的弧形“涡流”[16]。在形态上,螺旋波由弧形的波前(图1E中的红色实线,扫描前页OSID码可查阅彩图)和波尾(图1E中的红色虚线)连接而成,其中,波前代表去极化的区域,持续向外传导激动;波尾代表已完全去极化﹑正在恢复为静息状态的心肌细胞;波前和波尾之间的区域代表处于绝对不应期的心肌细胞。波前与波尾的连接部分是螺旋波的中心点(图1E中的红点),所有的激动状态(包括除极和复极)在此处汇集,使心肌细胞进入无法被激动的状态,因此,这个连接点也被称为相位奇点。在螺旋波围绕相位奇点的旋转运动中,相位奇点可进行不规则移动并形成相应的轨迹,被此轨迹包围的区域即螺旋波的核心(图1E中的蓝圈)[17-18]。波前和波尾在在相位奇点处交汇、可激动间隙消失,且此处较短的动作电位时程和较慢的传导速度使得折返能够围绕核心进行[12]。
随着光学标测技术的发展,一些研究指出,在心房表面记录到的螺旋波与在三维空间上延伸于心房壁全层的涡卷波之间存在关联(图1F)[19-21]。这种涡卷波的特点在于,当其旋转时存在一条相对静止的轴线(图1F中的绿线)。该轴并不总是呈“I”形延伸于心肌内外膜表面,轴的张力和稳定性取决于心肌厚度、延展性和心肌重构(如离子重构和解剖重构)的异质性。轴线形态遵循“最小阻力”原则,可通过数学模型进行预测(图2A)[20]。在离体房颤模型中,通过联合心内膜和心外膜光学标测可观察到具有L或U形轴的涡卷波(图2B)[21],其导致的心内外膜电活动的非一致性在二维平面上可表现为局灶激动或螺旋波。
2.2 转子的电生理特点
在高密度光学标测和计算机数学模型中,转子的特点包括波裂、游移和波长易变[22-23]。
2.2.1 波裂 波裂现象指转子遇到解剖或功能屏障时,会分裂成两个或多个子转子。子转子围绕着两个新的相位奇点进行反向旋转[24]。大部分子转子
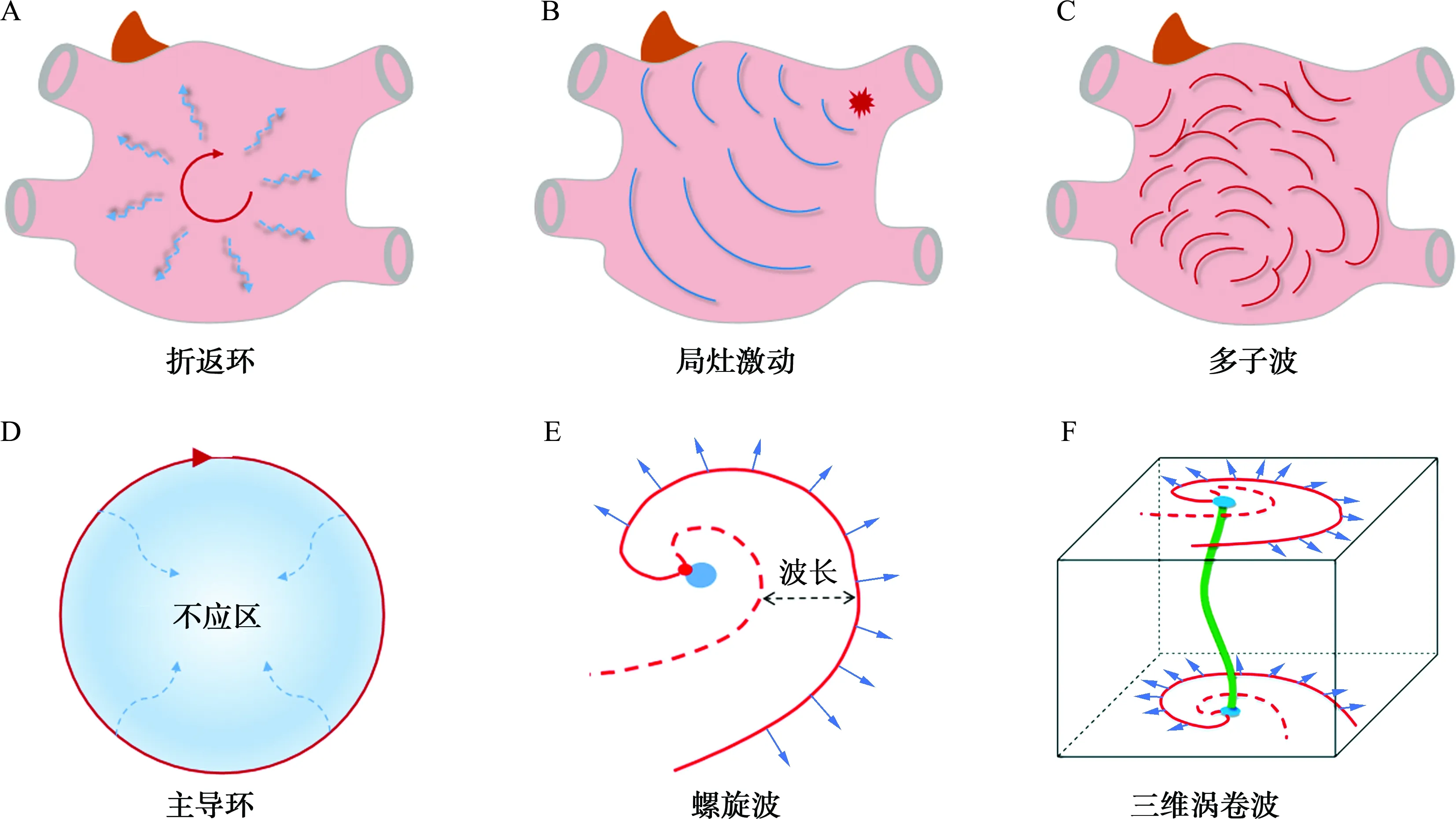
A: 围绕固定解剖障碍的折返导致颤动样激动。B: 肺静脉来源的异位灶驱动的房颤。C: 可能由左房后壁多子波驱动的房颤。D: 主导环折返,激动从处于功能不应期的核心扩布。E: 围绕一可激动、但未被激动的核心(蓝色)旋转的螺旋波波前(红色实线)。与核心(红点)连接处的波前曲度最大,核心是波前与波尾(红色虚线)汇聚的相位奇点。转子的波长高度可变(黑色箭头),可激动间期通常不可预测。F: 围绕旋状轴(绿线)产生的三维涡卷波及其在心房心内膜和心外膜面的不同激动形式不能稳定存在,在与其他转子或不应组织的碰撞中湮灭,其余相对稳定的子转子可继续产生新的子转子。当波裂的速度超过或等于子转子湮灭的速度时,房颤即可维持[25]。这一现象解释了持续性房颤难以自行终止的原因。
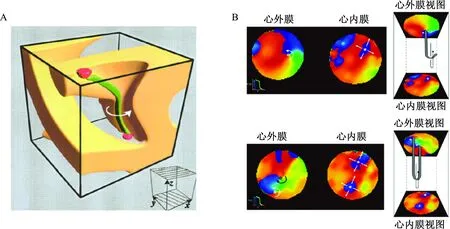
A: 稳定状态的涡卷波和轴;B:心内膜-心外膜联合光学标测显示的L或U形轴,以及心内膜-心外膜的折返突破分离形式[20-21]
2.2.2 游移 游移是指转子相位奇点的运动范围和运动方向存在不确定性。心肌离子通道分布的异质性很大程度上影响了其游移轨迹。一项研究[26]发现,转子会向内向整流钾通道(IK1)分布较少、心肌兴奋性较低、不应期较长的区域游走。另外,在光学标测实验中,亦能观察到转子通常锚定于心肌厚度和心肌纤维排列异质性显著的区域[25-27]。因此,电学异质性促进了转子的游移,而解剖异质性促进了转子的锚定。
2.2.3 波长易变 转子的波长即波前至波尾的距离,是可变的。在不同的离子通道状态下,转子的波长、核心区域和可激动间隙随离子通道状态的变化而变化。Nattel等[25]总结了离子通道改变对转子波长的影响:钠电流的减少会降低转子扩布和旋转的速度,减小波前曲率,增加核心区域面积﹑扩大游走范围;IK1电流的增大会缩短转子波长、核心区域面积和游走范围。而IK1电流减少则会增加转子波长、增大核心区域面积和游走范围。因此,不同的离子通道状态对转子的波长和电生理特点有着不同的影响,导致转子活动的复杂性和不确定性,给临床转子标测和识别带来了巨大挑战。
2.3 转子的产生机制
1978年,Krinsky[28]首次提出了螺旋波在复杂结构中的机制(图3A):在不应期高度异质的心肌中,一对激动波在二维心肌组织中扩布,其偶联间期与长不应期区域的不应期无限接近。不同区域不应期的差异导致波裂发生,波裂的边缘进一步形成螺旋波。但是,这一数学模型对组织不应期和两个激动波的偶联间期的异质性匹配具有特殊要求,因而很难在房颤动物模型中复制。随后,Davidenko等[29]与Cabo等[30]提出了螺旋波产生的“旋涡脱落理论”(图3B):在心肌组织中,由于细胞膜钠通道的部分阻滞或高频刺激,形成了边缘锐利、无法被激动的障碍区,降低了电激动波扩布时的稳定性,从而形成旋涡波。它在视觉上类似于流体动力学中的旋涡波,是引起自发高频心脏电活动的可能机制。它为心肌严重纤维化、钠电流密度及可兴奋性下降的病理状态(如心肌梗死后的心室肌和持续性房颤的心房肌)下的螺旋波形成提供了理论和实验基础。
值得注意的是,在Krinsky[28]和Cabo等[30]的研究中,螺旋波的波前弯曲度(wavefront curvature,WC)会在波前到达处于不应期的区域或障碍的边缘时陡然增加。该现象可用“源-汇关系”(source-sink relationship)解释(图3C)[12]:在兴奋传导过程中,波前所代表的去极化区域可被定义为“源”,波前前方处于静息状态的心肌可被定义为“汇”。当兴奋在狭窄区域内传导时,“源”和前方即将被兴奋的“汇”处于较高匹配状态,此时WC较小;而当波前在临近较大待兴奋区域时,波前前方的“汇”突然增大,而“源”并无明显的变化,此时“源”与“汇”的匹配程度降低;为使兴奋更容易向前扩布,WC因此增大,形成旋涡并脱落产生螺旋波。应用钠通道阻滞剂可降低心肌细胞的兴奋性,缩小“汇”区域,从而相对提高“源”与“汇”的匹配程度,阻碍WC的增大和“旋涡脱落”的形成。
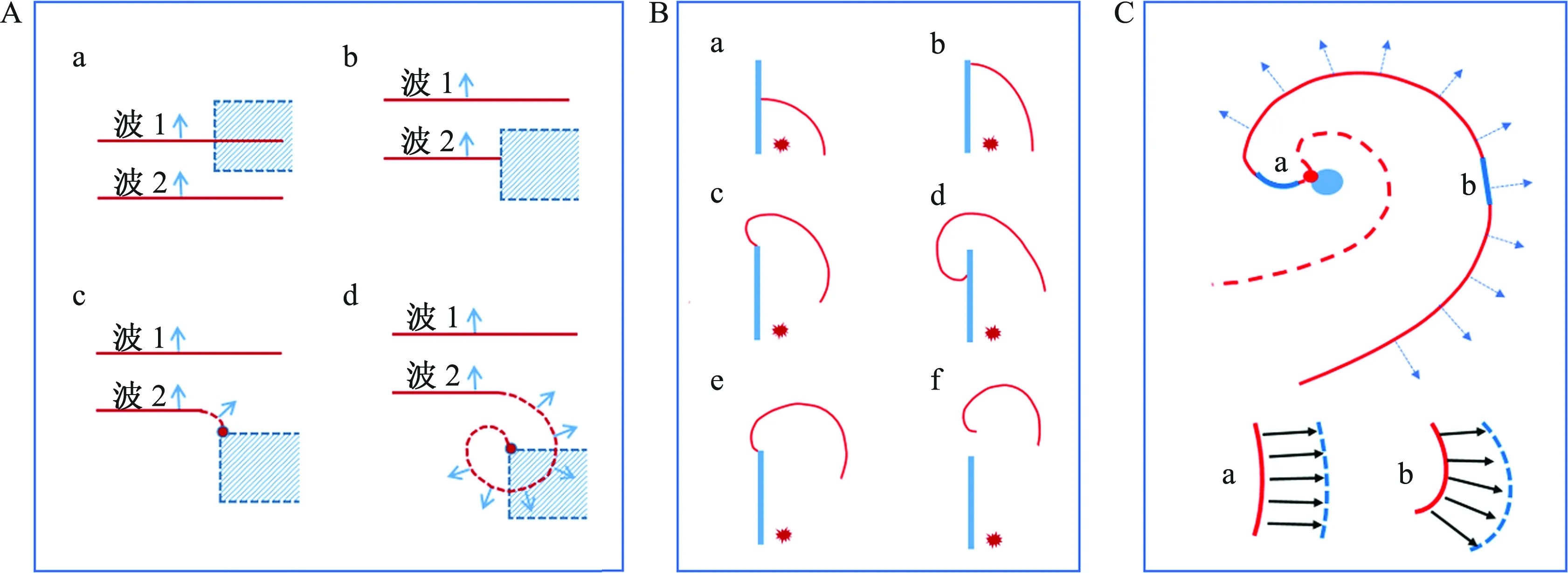
A: 由于异质性产生的螺旋波。(a) 在不应期高度异质的心肌中,一对波前(红色实线)在心肌中扩布,其偶联间期与不应性较大区域(蓝色虚线)的不应期无限接近;(b) 由于该区域的兴奋性未恢复,波2只能沿此区域的边缘扩布,无法侵入该区域;(c) 当波2离开不应性更高的区域时,边缘的波前出现弯曲,随后发生碰撞,形成相位奇点;(d) 不应性更长区域的兴奋性恢复后,波2可侵入该区域并围绕形成中的相位奇点旋转。
此外,从螺旋波的二维形态上看,远离核心的“源”与“汇”具有较高的匹配度,WC较小(图3C中a处的波前)。与之相比,靠近核心的“源”与“汇”匹配度较低,WC较大(图3C中b处的波前)[31]。当波前的“源-汇”失匹配达到极限,“源”不足以激动前方的“汇”,最终导致相位奇点的产生。因此,“水源-蓄水池”失匹配也被认为是螺旋波形成的关键机制[12]。
3 转子的光学标测技术
光学标测技术的原理是基于波长相关的光-组织相互作用,包括光的散射、吸收、反射和荧光效应。光学标测技术主要使用电压敏感的荧光染料作为标记物,利用荧光物质的发光强度反映跨细胞膜的电位变化,并通过光学检测设备进行记录。电压敏感的荧光染料通常是钙螯合剂。心肌细胞被荧光染料标记后,细胞内的钙离子与荧光染料结合,通过光学检测设备可即时检测细胞内钙离子浓度的变化,从而反映心肌细胞的去极化和复极化过程。计算机处理技术可即时分析不同区域心肌组织的去极化和复极化,从而能帮助研究者更直观地感知随时间变化的心肌组织的电活动过程,因此光学标测技术非常适合动态观察转子[32]。
光学标测技术最早于1973年被用于记录神经细胞的动作电位[33]。Salama等[34]于1976年首次运用该技术记录到了心肌细胞的电活动。随后在20世纪90年代,Gray等[14]运用光学标测技术首次在心室颤动模型中记录到螺旋波。1998年,该研究组在绵羊心脏的房颤模型中发现了转子,并指出转子具有时空周期性,其产生基于心肌组织传导的异质性和不应期[15]。随着光学技术的发展,研究者通过联合应用心内膜和心外膜光学标测法,发现绵羊心脏中转子活动在心内外膜面的心肌中具有一致或非一致性特点[19-21],且存在不同的心内外膜激动模式,如多个离心突破激动﹑波裂和短时折返。这提示在整个三维心肌中转子活动的透壁传播与房颤稳定性的增加有关。2017年,Csepe等[35]对人离体心脏进行心内外膜光学标测,指出动作电位在透壁传播过程中存在延迟,在心内膜面标测到的多种转子表现形式可以反映转子的三维结构。在二维的心内膜面上,转子可表现为螺旋状折返、稳定局灶、突破点以及空间上不稳定的突破点。后三种标测结果主要取决于转子的三维结构。因此,转子具有复杂的时空结构,在进行心内膜标测时需要注意各种不同转子的形态表现。
4 转子的临床标测方法
目前,转子的临床标测基本分为两类:全景式标测与局部高精密度标测。后者包括相位相似度标测、离散度标测以及主频标测(图4)。不同标测方法的房颤终止率相差较大(图5)。
4.1 全景式标测
2012年Narayan等[36]首次在CONFIRM研究中证实了转子标测及消融的临床有效性。该研究通过64极网篮状电极记录心内膜单极电位,并利用软件进行相位分析,识别转子活动区域,从而指导消融(图4A)。对101例房颤患者进行转子标测的结果显示,97%的患者存在转子,每例平均有(2.1±1.0)个转子。通过转子消融可使86%的房颤达到术中终止或发作间隔延长。经过平均273 d的随访,82.4%的患者仍然维持窦性心律。但该结果难以被其他中心复制(图5)。一项Meta分析显示,肺静脉隔离联合网篮电极引导的转子消融并不优于单纯的肺静脉隔离[37]。上述研究结果相矛盾,原因在于,篮网电极的间距过大,难以完整覆盖整个心内膜[38]。一项计算机模拟研究发现篮网电极仅有63.1%的电极间距小于识别转子所需的最小分辨率[39],而一些局部高密度标测导管(AFocusⅡ和PentaRay)则具有小于标测所需最小分辨率(11.9 mm)的电极间距,说明这些导管理论上具有更小的标测误差。
此外,另一种全景式非侵入电生理成像技术也被运用到了临床的转子标测[40-43]中。如图4B所示,运用体外心脏三维标测系统(美敦力公司ECVUE System),房颤患者穿戴252电极标测背心,在48 h内接受CT扫描来获取心房解剖结构,并和252个电极的三维空间关系进行匹配[44]。通过分析每例患者积累的体表单极信号图像来确定主动驱动区域和被动传播区域。在这项研究中,通过转子消融达到的房颤终止率为70%,1年的随访成功率高达85%。然而,该系统亦存在一些局限:① 由于该系统基于心外膜远场单极信号标测,心房信号质量的稳定性较差,且难以区分微折返与局灶激动;② 该系统难以区分解剖上重叠区域产生的信号,如冠状窦和房间隔,因而会产生标测误差。所以,尽管该系统是一种高分辨率的全景标测手段,但由于存在上述这些固有缺陷,在房颤转子标测中存在一定的假阳性率。
4.2 局部高精密度标测
2016年Lin等[45]通过AFocus Ⅱ导管对心内膜信号进行了相位分析,并通过计算相似度指数对转子进行标测。该方法通过计算机系统过滤掉采集信号中的干扰信号和远场电位,再根据局部电图在空间和时间上的一致性,计算其相似性指数。随后在相似性指数较高的区域对转子的波前进行模拟(图4C)。该项研究显示平均每例患者有(2.6±0.89)个高相似度区域,房颤即刻终止率为68%,高于行碎裂电位消融组(27%),长期随访成功率达83%。该标测方法的优势在于通过比较局部信号和信号相位变换的相似度,在理论上可更精确地识别转子的波前。
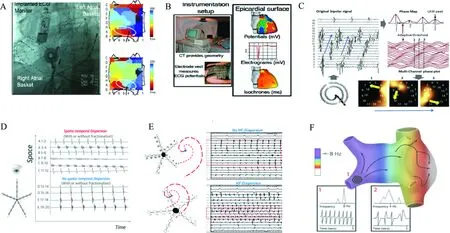
A:利用放置于左右心房的网篮电极进行心内膜全景标测;B:通过体外心脏三维标测系统进行非侵入性全景成像;C:利用AFocus Ⅱ导管获得的双极信号进行相位相似度标测,并对信号进行相位分析,通过计算相似性指数标测转子;D:利用PentaRay导管进行时空离散度标测,识别房颤转子活动区域;E:利用PentaRay导管进行高频和离散度电图指导下的标测,整个心房中转子区域离散电位频率最高,且不含碎裂电位的区域;F:利用主导频率标测对全心房进行高精度标测,识别主导频率较高的局部,并将该处定义为房颤转子
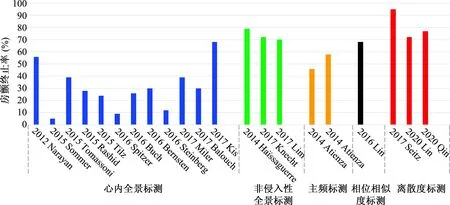
图5 不同标测方法指导下转子消融的房颤终止率
2017年,Seitz等[46]应用PentaRay导管成功识别转子活动区域。这种标测方法的理论基础如下:当PentaRay导管放置于转子中心时,其电极分支可以记录到转子波前的顺序激动,即不同步的双极电位或“离散度电图”;当导管移动至远离转子中心的区域时,电位的离散即消失。然而,这项研究将碎裂电位也纳入离散度分析中,具有或不具有碎裂电位的区域均为消融靶点(图4D)。该方法术中房颤终止率较高,但是需要对大面积的心房离散度区域(15.8%~29%的心房表面积)进行广泛消融,且不隔离肺静脉。部分消融靶点散布在肺静脉前庭周围,并且其造成的医源性房性心动过速不容忽视。我们的系列研究[47-48]显示,高频离散度电图指导的转子消融可使持续性房颤术中终止率达到60%左右(图4E),1年成功率较传统术式提高20%以上。值得注意的是,该方法相较于Seitz等[46]的方法消融面积减少了4.3%~13.3%,提示绝大部分的碎裂电位尤其是连续电位是因转子边缘的破碎而产生的副产物。近年来,基于多电极导管转子标测的研究逐渐增多,例如主频标测(图4F)以及STAR标测方法[49-51],这类方式也是寻找具有局部电位传导顺序的区域进行消融,与离散度标测思路有着异曲同工之处。尽管局部高密度标测无法提供整个心房的全景图像,但可通过采集局部电位的详细信息,将特征性的转子电位从复杂的房颤电活动中甄别出来,其识别敏感性应高于全景标测。
5 小结与展望
对房颤机制的研究逐渐揭示了转子复杂的特性和三维结构,转子在房颤基质的发生和发展过程中扮演了极为重要的角色。然而,现有研究方法的局限性和转子机制的复杂性使得基础和临床研究很难达到相得益彰的效果。在标测方法上,虽然全景标测和局部高密度标测各有优劣,但毋庸置疑的是,转子消融比传统消融方法具有更高的房颤终止率和长期成功率。今后需要开展进一步的理论和技术研究来改善现有标测方法的局限性,并且将基础和临床研究成果转化到房颤患者的治疗之中。
