南瓜中游离叶黄素的制备及抗氧化活性
2020-11-11孟繁玲徐少博王宇亮赵芷萌
孟繁玲 , 张 宇 *, 徐少博 , 赵 宏 , 王宇亮 , 赵芷萌 , 张 曼
(1. 佳木斯大学 黑龙江省新药创制与药效毒理评价重点实验室,黑龙江 佳木斯 154007;2. 佳木斯大学 药学院,黑龙江 佳木斯 154007;3. 黑龙江省第二医院,黑龙江 哈尔滨 150010)
南瓜Cucurbita moschata Duch.是双子叶被子植物门葫芦科南瓜族南瓜属植物,俗称金瓜、倭瓜等[1],我国古代早就有关于南瓜食疗保健作用的记载。 在中医史书《本草纲目》中,李时珍将南瓜与上品药材灵芝放在一起,称其具有“补中益气”之效[2]。南瓜营养丰富,富含粗纤维、维生素、β-胡萝卜素,叶黄素等成分[3],其中叶黄素成分与许多生物活性密切相关。 叶黄素又名“植物黄体素”,是一种天然类胡萝卜素类色素[4]。 大量研究表明,叶黄素在保护视觉、预防老年性黄斑变性、防治动脉硬化、增强免疫力等方面起着重要作用[5-8]。 南瓜中的叶黄素主要以叶黄素酯的形式存在,不易被人体吸收,需要经过皂化处理才能获得人体所能吸收的游离态叶黄素[9-10]。 目前,叶黄素的研究主要集中在以万寿菊为原料提取,且对游离叶黄素的制备和纯化方面报道较少[11-13],限制了叶黄素的开发应用。 本研究以氢氧化钾-甲醇溶液为皂化溶剂, 采用响应面法优化制备游离叶黄素的工艺参数, 并进行进一步的纯化,以期为叶黄素的深入研究和南瓜的综合利用提供参考。
1 材料与方法
1.1 实验设备与材料
KQ-250DE 型数控超声波清洗器: 购自昆山市超声仪器有限公司;RE-2000A 旋转蒸发器:购自上海亚荣生化仪器厂;FA2004 型电子天平:购自上海舜宇恒平科学仪器有限公司;DL-5-B 低速大容量离心机: 购自上海安亭科学仪器厂;LC-5510 型高效液相色谱仪: 购自北京东西分析仪器;Q Exactive质谱仪:购自美国Thermo 公司。
红栗南瓜:干燥后粉碎,过60 目筛,贮存于实验室备用;无水乙醇、乙酸乙酯、正己烷、石油醚:均为分析纯, 天津市科密欧化学试剂有限公司产品;甲醇:色谱纯,天津市科密欧化学试剂有限公司产品;硅胶H:青岛海洋化工有限公司产品;无水硫酸钠:天津市凯通化学试剂有限公司产品;氢氧化钾:天津市凯通化学试剂有限公司产品;叶黄素标准品(纯度 90%)、LOT(F03N8M46350):上海源叶生物科技有限公司产品。
1.2 实验方法
1.2.1 游离叶黄素的制备
1) 南瓜叶黄素酯的提取 准确称取南瓜粗粉60 g,加入乙酸乙酯-无水乙醇(体积比为 2∶1)混合溶剂,超声提取。 提取结束后抽滤,滤液于4 000 r/min下离心10 min,收集上清液,减压浓缩干燥,得叶黄素酯粗品。
2)南瓜叶黄素酯的皂化 参考胡建中的方法[14],用2 mL 正己烷将上述步骤中得到的叶黄素酯复溶,用一定浓度的KOH-甲醇溶液与其混合,比例1∶1,避光皂化。 于皂化结束时向反应体系注入一定体积双蒸水,补充正己烷,萃取,取上层用无水硫酸钠干燥,减压浓缩,挥干溶剂备用。
1.2.2 叶黄素的纯化 采用硅胶柱色谱法对叶黄素进行纯化。 以石油醚为溶剂进行湿法装柱,将适量1.1.2 得到的产品用少量溶剂溶解, 用胶头滴管沿柱壁缓缓加入。 上样完成后,用适量的石油醚和乙酸乙酯混合溶剂进行梯度洗脱, 收集目标组分,减压浓缩,挥干溶剂,得纯化产品。
1.2.3 叶黄素的高效液相色谱和质谱分析
1)高效液相色谱条件 HPLC 分析条件:ODSC18 色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇(体积分数 100%), 流量 0.5 mg/mL, 检测波长450 nm,柱温30 ℃,进样量 10 μL。
2)质谱条件 MS 条件:采集方式为单离子检测扫描(Single ion monitoring,SIM)与平行反应监测扫描(Parallel reaction monitoring,PRM);离子极性为正离子;离子化方式为电喷雾离子化;检测对象叶黄素 m/z=568;毛细管电压 3.0 kV;鞘气压力3×106Pa,辅助气压力 1×106Pa;离子传输管温度320 ℃,加热(蒸发)温度 350 ℃。
1.2.4 叶黄素标准曲线绘制 准确称取叶黄素标准品5.00 mg,用甲醇定容于25 mL 棕色容量瓶中,制备成 0.2 mg/mL 的标准溶液。 分别取 1、2、3、4、5 mL标准溶液用甲醇定容于10 mL 容量瓶中,配制成质量浓度分别为 0.02、0.04、0.06、0.08、0.10 mg/mL 的系列标准溶液,按照HPLC 色谱条件,每个系列质量浓度进样3 次,取平均值,以叶黄素系列标准溶液质量浓度为横坐标, 相应吸收峰面积为纵坐标,绘制叶黄素标准曲线,如图1 所示,得到回归方程y=97.47x+0.15,R2=0.999 8。

图1 叶黄素标准曲线Fig. 1 Lutein standard curve
1.2.5 样品中游离叶黄素的测定 取皂化后产品,溶剂复溶, 按1.2.4 叶黄素标准曲线的测定方法测定峰面积,根据标回归方程求得游离叶黄素质量浓度。 南瓜提取物中游离叶黄素得率按公式(1)计算:

式中:c 为样品溶液的浓度(mol/L);V 为复溶溶剂体积(mL);m 为南瓜粗粉质量(g)。
1.2.6 单因素实验设计 将叶黄素酯提取液减压浓缩干燥,在其他条件不变的情况下,以游离叶黄素得率为指标, 考察质量浓度分别为 5、10、20、30、40 g/dL;皂化温度为 25、35、45、55、65 ℃;皂化时间为 2、5、8、11、14 h 条件下各因素对南瓜中游离叶黄素得率的影响,以确定最优皂化条件。
1.2.7 响应面法实验设计 为优化南瓜中游离叶黄素的制备工艺条件,根据Box-Behnken 试验设计原理,在单因素试验基础上,共设计17 个试验点,12 个分析点,5 个零点以估计误差, 选取皂化液质量浓度A、皂化温度B、皂化时间C 为自变量,以游离叶黄素得率Y 为响应值,设计三因素三水平的优化试验,试验因素与水平设计见表1。
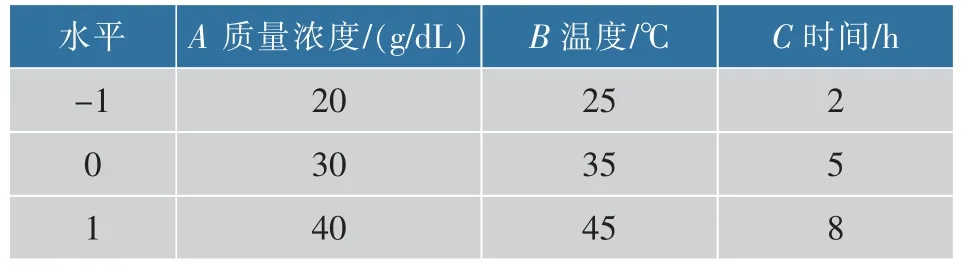
表1 响应面试验因素与水平Table 1 Response surface test factors and levels
1.2.8 游离叶黄素的抗氧化能力测试
1) 南瓜中游离叶黄素清除DPPH·的能力 取不同质量浓度南瓜叶黄素乙醇溶液1 mL 于试管中, 分别加入 2×10-4mol/L DPPH·乙醇溶液 1 mL,摇匀,暗处静置30 min,乙醇为空白对照,517 nm 处测吸光度A,按公式(2)计算南瓜叶黄素对DPPH·的清除率:

式中:Ax为样品溶液的吸光度;Ao为对照溶液的吸光度。
2)南瓜中游离叶黄素清除·OH 的能力 取6 mmol/L FeSO4溶液 1 mL、6 mmol/L 水杨酸乙醇溶液1 mL,依次加入试管中,不同质量浓度南瓜叶黄素乙醇溶液1 mL 充分混匀, 随后加入5 mmol/L H2O2溶液 1 mL 以启动反应, 并于 37 ℃下水浴30 min,测定其510 nm 波长处吸光度A,另设乙醇为空白对照,按公式(3)计算南瓜叶黄素对·OH 的清除率:

式中:Ax为样品溶液的吸光度;Axo为不加H2O2时样品溶液的吸光度;Ao为对照溶液的吸光度。
1.2.9 统计学处理 数据运用 Microsoft Excel、Design Expert 8.0.6、SPSS 13.0 统计软件对实验数据进行统计学分析和显著性分析。 统计描述:计量资料数据用x ± s 表示,P<0.05 表示具有显著性差异,P<0.000 1 表示具有极显著性差异。
2 结果与分析
2.1 样品测定
2.1.1 南瓜叶黄素的色谱测定 根据标准品的保留时间对南瓜中游离叶黄素的色谱峰初步定性,将样品测定色谱图与标准品色谱图进行比较,以确定样品的相应峰位。 按1.2.3 色谱条件测定标准品溶液和样品溶液,色谱图见图2。标准品保留时间与样品保留时间相同,初步确定样品与标准品为同一物质。

图2 样品溶液和标准品溶液高效液相色谱图Fig. 2 High performance liquid chromatogram of sample solution and standard solution
2.1.2 南瓜叶黄素的质谱鉴别 叶黄素标准品和样品的MS 检测结果见图3。 样品溶液中含有与标准品一致的质谱碎片及其特征离子峰度,从而进一步证明南瓜中含有叶黄素。 叶黄素的相对分子质量为568, 一级质谱分析特征离子为m/z 569.4、430,其中m/z 569.4 峰为基峰,m/z 430 峰为碎片峰。

图3 样品溶液和标准品溶液一级质谱图Fig. 3 Sample solution and standard solution primary mass spectrum
为了进一步验证m/z 430 离子峰的来源, 并探明叶黄素的质谱分析裂解规律, 以m/z 569.4 离子峰为母离子,对叶黄素标准品溶液和样品溶液中的叶黄素峰进行了二级质谱分析,样品和标准品的二级质谱图见图4。 样品的二级质谱特征离子与标准品一致,确定m/z 430 峰为m/z 569.4 离子峰的碎片峰,更进一步确定样品与标准品为同一物质。 根据叶黄素一级和二级质谱特征,推断叶黄素可能的质谱裂解方式,见图5。
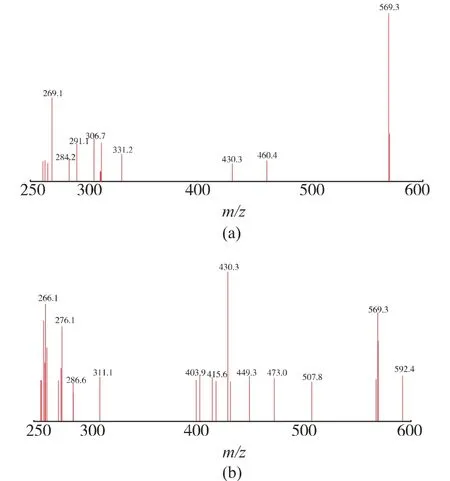
图4 样品溶液和标准品溶液二级质谱图Fig. 4 Sample solution and standard solution secondary mass spectrum
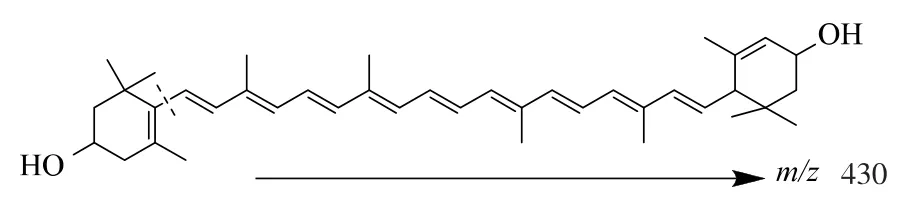
图5 叶黄素裂解规律图Fig. 5 Lutein pyrolysis rule
2.2 单因素实验结果分析
2.2.1 氢氧化钾-甲醇溶液质量浓度对叶黄素酯皂化效果的影响 由于叶黄素在强碱环境下易发生氧化和异构化,易转化为玉米黄素,使游离叶黄素得率降低[15],见图6。 在固定皂化温度 35 ℃、皂化时间5 h 的条件下, 考察KOH-甲醇溶液质量浓度分别为 5、10、20、30、40 g/dL 时对游离叶黄素得率的影响,结果见图 7(a)。 由图 7(a)可知,氢氧化钾-甲醇溶液质量浓度在5~40 g/dL 范围内, 随着氢氧化钾质量浓度的增加, 游离叶黄素得率逐渐升高,高于30%则有下降趋势。 因此选用30 g/dL 的氢氧化钾-甲醇溶液为皂化液。
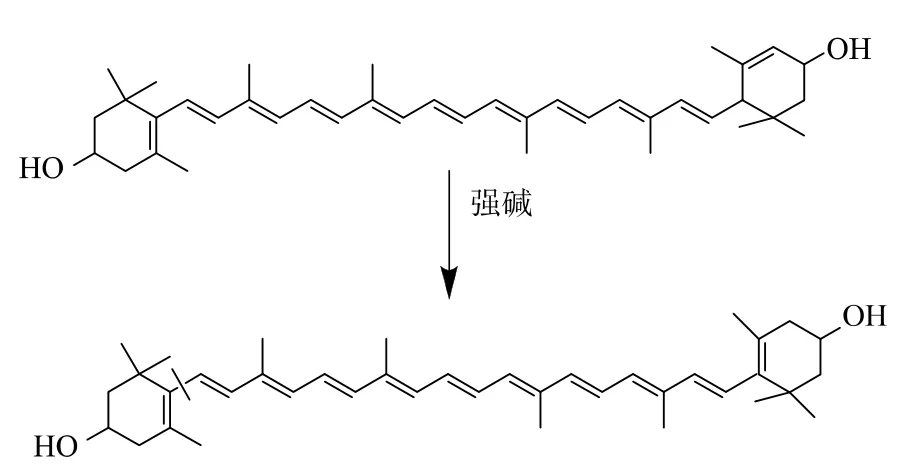
图6 叶黄素转化玉米黄素示意图Fig. 6 Schematic diagram of lutein conversion to zeaxanthin
2.2.2 皂化温度对叶黄素酯皂化效果的影响 在固定KOH-甲醇溶液质量浓度为30 g/dL,皂化时间5 h 的条件下, 考察皂化温度分别为 25、35、45、55、65 ℃时对游离叶黄素得率的影响,结果见图7(b)。由图 7(b)可知,皂化温度在 25~65 ℃范围内,游离叶黄素得率呈先上升后下降的趋势。 由于温度过低不利于叶黄素酯在皂化体系中分散,导致皂化不完全,而温度过高则会导致游离叶黄素的降解和异构化,使游离叶黄素得率下降,因此皂化温度控制在35 ℃为宜。
2.2.3 皂化时间对叶黄素酯皂化效果的影响 在固定KOH-甲醇溶液质量浓度为30%、皂化温度35℃的条件下, 考察皂化时间分别为 2、5、8、11、14 h时对游离叶黄素得率的影响,结果见图7(c)。 由图7(c)可知,皂化时间在 2~14 h 范围内,当皂化时间小于5 h 时,随着皂化时间的延长,游离叶黄素得率呈逐渐增大的趋势。当皂化时间超过5 h 时,游离叶黄素得率逐渐下降。 可能由于5 h 时几乎所有的叶黄素均以游离状态存在,延长皂化时间只能使叶黄素在碱性条件下发生氧化和异构化,游离叶黄素得率反而减少。 因此,选择皂化时间为5 h。

图7 单因素试验结果Fig. 7 Single factor test results
2.3 响应面优化叶黄素酯皂化条件
2.3.1 叶黄素酯皂化条件的工艺优化 在单因素试验结果的基础上,采用Box-Behnken 中心组合实验设计原理对南瓜叶黄素酯皂化条件进行优化,选择皂化液质量浓度A、皂化温度B、皂化时间C 为自变量,以叶黄素得率Y 为响应值,设计三因素三水平的优化试验, 采用Design Expert 8.0.6 软件对数据进行分析,结果见表2。
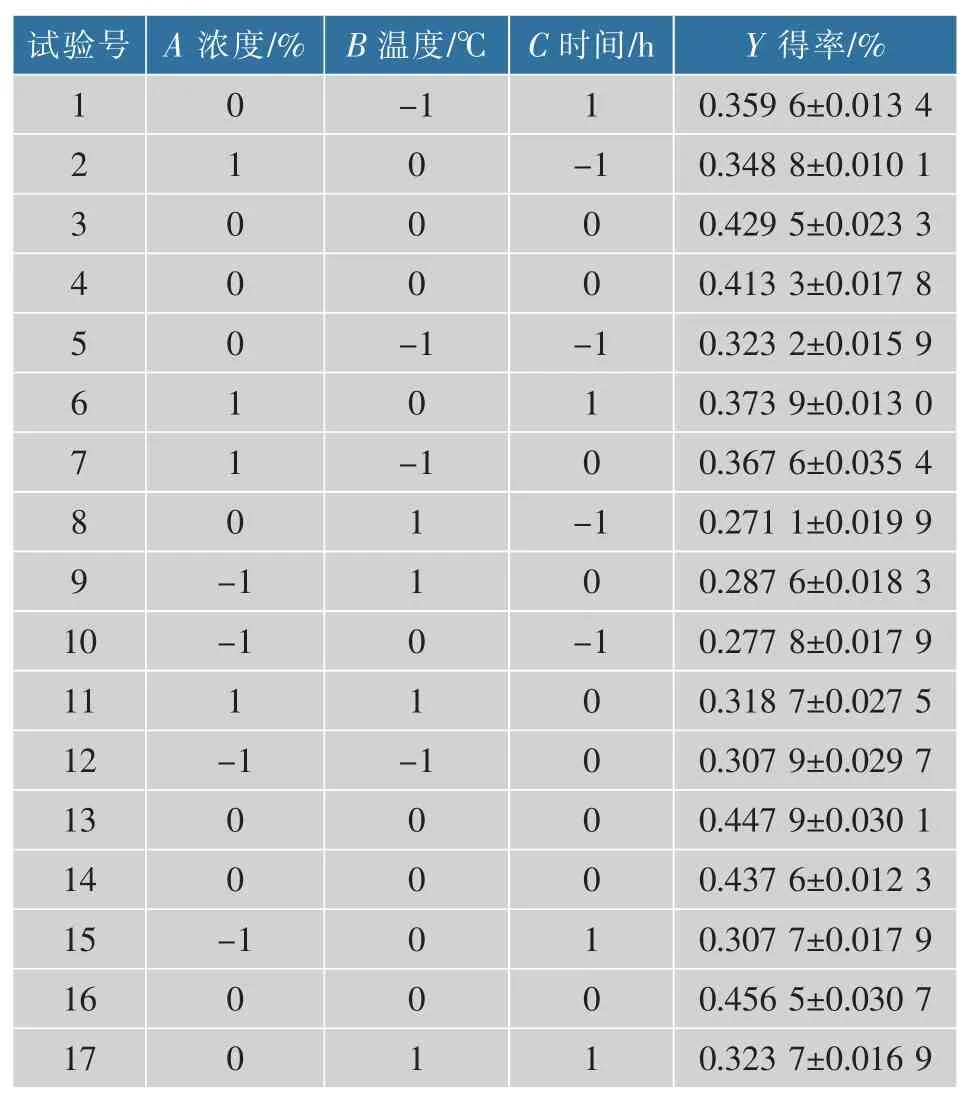
表2 响应面优化实验设计及结果Table 2 Response surface optimization experiment design and results
通过回归分析得到游离叶黄素得率与皂化液质量浓度A、皂化温度B、皂化时间C 的回归方程为Y=0.44+0.029A-0.020B+0.018C-7.150×10-3AB-1.200×10-3AC+4.050×10-3BC-0.054A2-0.062B2-0.055C2
回归方程方差分析结果见表3。 可知该模型P<0.000 1,极显著;失拟项 P 值为 0.676 6,不显著。 这说明得到的多项回归方程模型能准确反映皂化液质量浓度、 温度和时间对南瓜叶黄素酯皂化的影响;模型决定系数R2=0.974 0,调整决定系数R2Adj=0.940 6, 表明本方程可以解释94%以上的数据,该模型拟合度较好,误差较小,该模型可用于分析与预测南瓜中游离叶黄素的制备工艺试验。
通过表3 回归方程系数显著性检验,一次项皂化液质量浓度 A、温度B 以及平方项 A2、B2和 C2游离叶黄素得率有极显著影响,一次项中时间C 可显著影响游离叶黄素得率,二次项中皂化液质量浓度与温度AB,皂化液质量浓度与时间AC 和温度与时间BC 对游离叶黄素得率影响不显著。 从F 值可以看出,在所选的各因素水平范围内,皂化液质量浓度对叶黄素得率的影响最大, 温度的影响次之,时间的影响最小,即 A>B>C。
2.3.2 响应面图分析 响应面图是由特定的响应值对应自变量构成的三维曲线图[16],为了更直观地反映出各自变量对响应值的影响。 本研究根据回归方程绘制出各影响因素对南瓜叶黄素得率的响应面图见图8。 根据响应曲面的倾斜度和等高线密集程度,可确定两两因素对响应值的影响程度,倾斜度越高,等高线越密集,说明两者交互作用越显著[17]。 由图 8 可知,因素 A、B、C 的曲面倾斜程度皆较高,等高线较紧密,说明因素A、B、C 对响应值影响极显著;因素A 和因素B、因素A 和因素C、因素B 和因素C 的响应面的曲面较平缓,其交互作用对游离叶黄素得率的影响不显著,与方差分析结果一致。 对回归方程一阶求导,在游离叶黄素得率得最大值时,其皂化液质量浓度32.71 g/dL、温度33.31 ℃、时间5.46 h, 此时南瓜提取物中游离叶黄素得率为0.443 9%。

表3 回归方程显著性检验Table 3 Regression equation significance test

图8 交互作用对南瓜叶黄素酯皂化效果的影响Fig. 8 Effect of interaction on the saponification effect of pumpkin lutein ester
2.3.3 验证试验 为检验方法预测的结果,用实验中得到的最佳工艺条件重复试验。 为便于实际操作,将试验条件确定为,皂化液质量浓度33 g/dL,温度33 ℃,时间5.5 h,修正后的条件制备游离叶黄素3 次,得率分别为 0.412 7%、0.436 5%、0.403 3%,平均得率为0.4175%,与理论值较为吻合,表明优选工艺效果较为理想。
2.4 游离叶黄素的纯化
通过课题组前期预试验比较,最终确定以硅胶为固定相, 石油醚-乙酸乙酯为流动相对游离叶黄素进行柱色谱纯化。 先用石油醚-乙酸乙酯(3∶1)对杂质进行分离洗脱,再用石油醚-乙酸乙酯(3∶2)将目标产物洗脱下来。 减压浓缩得游离叶黄素产品,纯度达91.39%,结果见表4。 游离叶黄素HPLC 色谱图见图2(a),与叶黄素标准品出峰时间一致。 结果表明,利用硅胶柱色谱纯化可以快速将目标叶黄素分离纯化。

表4 游离叶黄素纯化结果Table 4 Free lutein purification results
2.5 南瓜叶黄素的抗氧化活性
2.5.1 南瓜中游离叶黄素对DPPH·清除作用 南瓜叶黄素对DPPH·清除效果随着游离叶黄素质量浓度的提高而逐渐增强,在一定质量浓度范围内呈量效关系,结果见图9。南瓜叶黄素质量浓度与其对DPPH·清除效果线性回归分析方程为y=-3.57x2+37.41x-13.8, 相关系数 R2=0.986 9, 半抑制浓度IC50=0.021 4 mg/mL,拟合程度良好,说明南瓜叶黄素对DPPH·具有明显的清除作用。
2.5.2 南瓜中游离叶黄素对·OH 清除作用 南瓜叶黄素对·OH 清除效果随着游离叶黄素质量浓度的提高而逐渐增强,在一定质量浓度范围内呈量效关系,结果见图9。 南瓜叶黄素质量浓度与其对·OH清除效果线性回归方程为y=-2x2+23.8x-11.8,相关系数R2=0.975 2, 半抑制质量浓度IC50=0.038 3 mg/mL,拟合程度良好,说明南瓜叶黄素对·OH 具有明显的清除作用。

图9 南瓜叶黄素对DPPH·和·OH 的清除作用Fig. 9 Scavenging effects of pumpkin lutein on DPPH·and·OH
3 结语
采用Box-Behnken 中心组合实验原理对南瓜中游离叶黄素皂化工艺参数进行响应曲面优化,得到最佳工艺条件为:皂化液质量浓度33 g/dL,温度33 ℃,时间5.5 h,此时南瓜提取物中游离叶黄素得率为0.417 5%。 在硅胶柱色谱纯化后,游离叶黄素的纯度可提高到91.39%。 目前,工业生产叶黄素主要是通过在万寿菊花亚临界低温浸出获得,其设备复杂、 原料昂贵。 本研究得到的优化工艺高效、可靠、成本低,可为南瓜叶黄素的进一步商业生产提供技术参考。
作者采用紫外分光光度法考察了南瓜叶黄素对DPPH·和·OH 自由基清除能力,这是两种被广泛认可的抗氧化活性评价方法,具有易操作、准确度高等特点。 南瓜叶黄素清除DPPH·、·OH 的半抑制质量浓度IC50分别为 0.021 4 mg/mL 和 0.038 3 mg/mL,结果显示南瓜叶黄素具有较好的抗氧化活性。 科学研究表明,炎症、癌症、衰老等大量疾病大都与过量自由基的产生有关联,而抗氧化剂抵消自由基对人体细胞的氧化攻击,这也是已知叶黄素其具有保护视觉、预防老年性黄斑变性等功效的物质基础。 本实验结果证明, 南瓜叶黄素是良好的天然抗氧化剂,具有广阔的药品、食品等产业开发的前景,为其抗氧化活性相关研究提供了科学依据。
