异丙酚抑制血管紧张素Ⅱ诱导的大鼠心肌成纤维细胞增殖的机制
2020-11-11李继峰
李继峰
(鹤壁市人民医院麻醉科,河南 鹤壁 458030)
心肌成纤维细胞(cardiac fibroblasts,CF)占心肌组织细胞中的60~70%,对维持心脏正常的生理功能方面起着重要的作用[1-3]。 心肌纤维化是多种心血管疾病的病理表现,如心力衰竭、冠心病、高血压等,是导致心室重塑的主要因素[4,5]。 当心肌受到各种致病因素刺激后,会导致胶原合成增加并沉积,并最终发生心肌纤维化[6]。心肌胶原纤维主要包括Ⅰ型、Ⅲ型胶原蛋白,当心肌成纤维细胞增殖时,会伴有胶原蛋白的过度沉积,这是导致心肌纤维化的主要原因[7]。 研究证实,血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)是可导致心肌纤维化的主要因素,并会引起心肌成纤维细胞的增殖及胶原沉积,从而导致心肌纤维化[8]。 异丙酚是临床常用的麻醉诱导药物,并证实其具有抑制心肌收缩力、清除氧自由基以及保护心脏缺血等作用[9,10]。 但是,异丙酚对 AngⅡ诱导的心肌成纤维细胞增殖的影响及作用机制,目前还不清楚。 因此,本研究通过采用Ang Ⅱ建立诱导新生大鼠CFb 纤维化模型,探讨异丙酚抑制血管紧张素Ⅱ诱导的大鼠心肌成纤维细胞增殖的机制,为异丙酚应用于冠心病心室重构、心肌纤维化的预防及治疗提供理论依据。
1 材料与方法
1.1 实验材料与试剂 实验材料: 选取新生1~3d的Wistar 大鼠,取其心肌成纤维细胞进行原代培养及分离纯化,并保存与本实验室。 DMEM 培养基、胰蛋白酶和胎牛血清购自于美国Gibco 公司;二甲基亚砜(DMSO)和噻唑蓝(MTT)购自于美国Sigma公司;Ⅰ、Ⅲ型胶原的ELISA 检测试剂盒购自于欣博盛生物科技有限公司;BCA 蛋白浓度测定试剂盒及ECL 发光试剂盒购自碧云天生物科技有限公司;TGF-β1 抗体、ERK1/2 抗体、cPKCα 抗体和 βactin 抗体均购自abcom 公司; 其余为国产分析纯试剂。
1.2 实验方法
1.2.1 心肌成纤维细胞的原代培养及鉴定 选取新生1~3 d 的Wistar 大鼠,提取其心肌成纤维细胞并进行分离纯化。 Wistar 大鼠水合氯醛麻醉后处死,随后75%乙醇浸泡消毒,与超净台取心脏,无菌PB S 冲洗。 随后在大皿中取部分心肌,将取出的心肌于中皿中剪碎并转移至5ml 灭菌EP 管中, 加入4ml 的胰蛋白酶:I 型胶原酶比例为2:1 的混合液。水浴锅中37 度消化10 分钟, 随后静置2 分钟,随后提取上清液,再向其中加入等量的含血清DMEM培养基中和混合酶液的消化,900r/min 离心10min,重复操作3 次。 随后向各离心管中加入1ml 含血清的DMEM 培养基,轻轻吹打数次,转移到培养瓶中,在培养箱中放置2h 后,换液贴壁的细胞即为心肌成纤维细胞。 继续培养3~4 代用于实验。
心肌成纤维细胞Vimentin 免疫荧光染色。 ⑴玻片准备:75%酒精浸泡盖玻片约24 小时,随后将盖玻片与酒精灯上烘烤转移至无菌六孔板中。 ⑵细胞铺板:取对数生长期的成纤维细胞,胰酶消化后离心计数, 后将细胞以8*10^5 密度铺至上述六孔板中。 随后十字法将细胞摇匀。 ⑶固定:待细胞长至70%汇合率时,弃掉六孔板上清液,并用PBS冲洗2~3 遍。 随后加入4%多聚甲醛室温固定15分钟。⑷打孔:弃掉多聚甲醛。随后加入0.5%Triton 1ml, 摇床室温孵育 15 分钟。 ⑸封闭: 弃掉 0.5%Triton,PBS 冲洗三遍,随后没孔加入 1%BSA,室温孵育 2 小时。 ⑹一抗孵育:用 BSA 按 1:1000 比例配制Vimentin,β-actin 混合抗体。随后每个盖玻片加100 微混合抗体。4 度过夜孵育。⑺二抗孵育:用BSA 按1:1000 比例配制相应种属来源的混合抗体。室温避光孵育2h。⑻封片:载玻片滴甘油,随后将载玻片倒扣在载玻片上,凡士林周围涂抹密封,室温避光自然风干后,荧光显微镜拍照。
1.2.2 MTT 法测定不同浓度的异丙酚对各组细胞增殖抑制率 分别选取含有1×10-6mol/L Ang Ⅱ的异丙酚(0、25、50、100 和 200μmol/L)作用于心肌成纤维细胞24h。 采用MTT 法测定不同浓度的异丙酚对各组细胞的增殖抑制率。 取1×105/mL 处于对数生长期的心肌成纤维细胞,接种于96 孔板。在37 ℃下的CO2培养箱中培养24 h 后,使用不同浓度的异丙酚(含有1×10-6mol/L Ang Ⅱ)继续培养24h。培养结束后,每孔加入 20μL 的 MTT 溶液继续培养4h。取出96 孔板,吸弃培养液,每孔加入150 μL 的 DMSO 反应 10min。 使用酶标仪在 570nm 处测定吸光度值。细胞增殖抑制率(%)=(1-试验组平均 OD 值/对照组平均 OD 值)×100%。
1.2.3 流式细胞仪检测各组细胞周期变化 根据MTT 实验结果,选取异丙酚作用于心肌成纤维细胞的最佳抑制浓度。 将细胞分为3 组: 正常对照(Control)组、Ang Ⅱ 组和异丙酚(Propofol)处理组。取1×105/mL 处于对数生长期的心肌成纤维细胞,接种于6 孔板。 在 37 ℃下的 CO2培养箱中培养24h。 Ang Ⅱ组:含 1×10-6mol/L Ang Ⅱ的 DMEM 培养基培养细胞 24h。 异丙酚组:使用 100μmol/L 的异丙酚(含有 1×10-6mol/L Ang Ⅱ)培养细胞 24h。 将上述各组细胞进行消化离心, 加入10μl PI 充分混匀,室温避光孵育10min 后,经流式细胞仪测定各组细胞的周期变化。
1.2.4 ELISA 法测定各组细胞中Ⅰ、Ⅲ型胶原含量细胞培养如1.2.3 中所述,当培养结束后,将各组细胞进行匀浆后离心, 吸取上清液待测。 采用ELISA 试剂盒法测定各组细胞中炎症因子 Ⅰ、Ⅲ型胶原含量, 操作步骤严格按照试剂盒说明书进行。
1.2.5 蛋白免疫印迹(Western Blot)法 细胞分组及培养方法如1.2.3 中所述,将各组细胞分别收集到新的1.5mL EP 管中,加入一定体积的蛋白裂解液对组织进行充分研磨,于冰上裂解30min 后,在4℃下、12000×g 离心 10min, 吸取上清液, 并使用BCA 蛋白浓度试剂盒对其进行蛋白定量。选取5%的浓缩胶和10%的分离胶,取20μl 蛋白样品进行上样,电泳结束后,将蛋白转移至PVDF 膜上。使用10%的脱脂乳粉溶液进行封闭2h 后,一抗(1: 1000)4℃孵育过夜。使用TBST 洗膜三次,每次15min,二抗(1:4000)室温孵育 2h,用 TBST 洗膜三次。 使用化学发光法对蛋白进行显色。
由于TGF-β1 属于分泌性蛋白,细胞按上述铺板后, 本实验采用TCA 法对培养基中蛋白进行浓缩。 ⑴向蛋白质样品中加入等体积的20%TCA(三氯乙酸)。⑵在冰上孵育30 分钟。⑶在4 度离心机中离心15 分钟,2000rpm/min。 ⑷小心取出所有上清液。 ⑸加入~300μl 冷丙酮,4 度离心 5 分钟。2000rpm/min。⑹去除上清液和干燥颗粒。⑺将样品重悬于所需的缓冲液中。
1.2.6 免疫细胞化学法 细胞分组及培养方法如1.2.3 中所述,将培养在6 孔板中的细胞爬片取出,弃去培养液。 经PBS 洗涤后,使用4%多聚甲醛进行固定。并使用山羊血清进行封闭,采用p ERK1/2一抗工作液室温孵育3h。孵育结束后,采用二抗工作液室温孵育15min。显色后,经苏木素复染,脱水,透明,封片。 在荧光显微镜下观察并分析。 同时胶原蛋白及cPKCα 免疫组化参考此方法。
1.3 统计学处理 本研究采用SPSS20.0 统计软件(美国 IBM 公司);计量资料采用“均数±标准差”(±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验;计数资料采用百分率(%)表示,组间比较采用 χ2分析;P<0.05 代表差异有统计学意义。
2 结果
2.1 心肌成纤维细胞的鉴定

图1 心肌成纤维细胞Vimentin 免疫荧光鉴定
如图1 所示,心肌成纤维细胞免疫荧光显示。大鼠心肌组织提取的成纤维细胞阳性率达95%,符合后续试验应用条件。
2.2 MTT 法测定不同浓度的异丙酚对各组细胞增殖抑制率 我们通过运用100uM 、200 uM、500uM、1mM 浓度的异丙醇, 测不同浓度对成纤维细胞的影响。 通过实验我们可以发现100 uM 为本实验最佳浓度, 其他浓度不可避免了引起了成纤维细胞的药物毒性。 随后再次浓度下,如图B.所示,实验表明异丙醇逆转了AngⅡ对于成纤维细胞的增殖性效应。 见图2A.。
2.2 流式细胞仪检测各组细胞周期变化 与正常对照组相比,Ang Ⅱ组细胞G0/G1 期细胞百分率降低 (P<0.01),S 期和 G2/M 期细胞百分率升高 (P<0.01);而异丙酚处理组细胞的G0/G1期细胞百分率高于 Ang Ⅱ组 (P<0.01),S 期和 G2/M 期细胞百分率低于 Ang Ⅱ组(P<0.01),说明异丙酚处理后可阻滞心肌成纤维细胞的细胞周期。 见图3。

图2 CCK8 筛选异丙酚药物剂量以及应用异丙酚对Ang 诱导后的增殖性效应
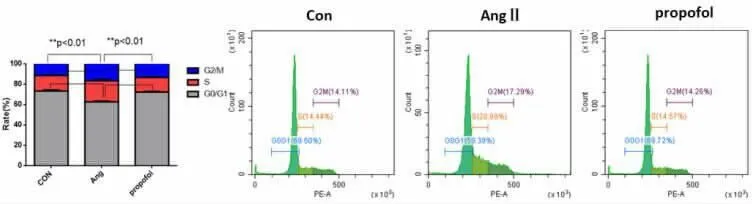
图3 各组细胞周期变化
表1 流式细胞仪检测各组细胞周期变化(±s)

表1 流式细胞仪检测各组细胞周期变化(±s)
注:与 Control 组相比,**P<0.01,与 Ang Ⅱ组相比,##P<0.01
组别 G0/G1 Control 组Ang Ⅱ组异丙酚组S G2/M 71.74±2.19 62.44±2.69**72.18±2.37##15.73±1.13 21.87±1.26**14.24±0.89##14.79±2.69 18.85±1.13**15.14±0.97##
2.3 ELISA 法测定各组细胞中Ⅰ、 Ⅲ型胶原含量与正常对照组相比,Ang Ⅱ 组大鼠的心肌成纤维细胞Ⅰ、Ⅲ型胶原含量增加(P<0.01);而异丙酚处理组大鼠的心肌成纤维细胞 Ⅰ、Ⅲ型胶原含量低于 Ang Ⅱ组(P<0.01),说明异丙酚处理后会缓解Ang Ⅱ诱导心肌成纤维细胞的心肌胶原沉积。同时图4 免疫组化显示异丙酚逆转了Ang Ⅱ诱导心肌成纤维细胞的心肌胶原沉积。 见表2。
2.4 Western Blot 法测定各组细胞中TGF-β1 的蛋白表达量 与正常对照组相比,Ang Ⅱ组大鼠心肌成纤维细胞中 TGF-β1 的蛋白表达量升高 (P<0.01), 而异丙酚处理组大鼠心肌成纤维细胞中TGF-β1 的蛋白表达量低于 Ang Ⅱ 组 (P<0.01),说明异丙酚的处理可抑制大鼠心肌成纤维细胞中TGF-β1 的蛋白表达,缓解了成纤维细胞纤维化的程度。 见图5、表3。
表2 ELISA 法测定各组细胞中Ⅰ、Ⅲ型胶原含量(±s)
注:与 Control 组相比,**P<0.01,与 Ang Ⅱ组相比,##P<0.01
组别 Ⅰ型胶原(ng/mL)Control 组Ang Ⅱ组异丙酚组12.18±0.05 37.74±0.11**23.32±0.07##Ⅲ型胶原(ng/mL)14.15±0.03 49.57±0.09**27.23±0.03##

图5 Western Blot 法测定各组细胞中TGF-β1 的蛋白表达量
表3 Western Blot 法测定各组细胞中TGF-β1 的蛋白表达量(±s)

表3 Western Blot 法测定各组细胞中TGF-β1 的蛋白表达量(±s)
注:与 Control 组相比,**P<0.01,与 Ang Ⅱ组相比,##P<0.01
组别 TGF-β1/β-actin Control 组Ang Ⅱ组异丙酚组0.18±0.06 1.24±0.12**0.52±0.11##
2.5 免疫细胞化学法测定各组细胞中ERK1/2 蛋白表达 与正常对照组相比,Ang Ⅱ组大鼠心肌成纤维细胞中 ERK1/2 的阳性表达增加(P<0.01);而异丙酚处理组大鼠心肌成纤维细胞中ERK1/2 的阳性表达低于Ang Ⅱ 组, 这与Western Blot 实验相一致。 说明异丙酚抑制大鼠心肌成纤维细胞的增殖与下调ERK1/2 的表达相关。 见图6、图7、表4。
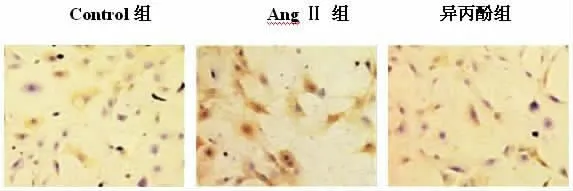
图6 免疫细胞化学法测定各组细胞中ERK1/2 蛋白表达
2.6 免疫细胞化学法测定各组细胞中cPKCα 蛋白表达 与正常对照组相比,Ang Ⅱ组大鼠心肌成纤维细胞中 cPKCα 的阳性表达增加(P<0.01);而异丙酚处理组大鼠心肌成纤维细胞中cPKCα 的阳性表达低于Ang Ⅱ 组, 这与Western Blot 实验相一致。 说明异丙酚抑制大鼠心肌成纤维细胞的增殖与下调 cPKCα 的表达相关。 见图8、图9、表5。
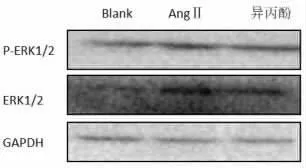
图7 Western Blot 测定各组细胞中ERK1/2 及P-ERK1/2 蛋白表达
表4 免疫细胞化学法测定各组细胞中ERK1/2 蛋白表达(±s)

表4 免疫细胞化学法测定各组细胞中ERK1/2 蛋白表达(±s)
注:与 Control 组相比,**P<0.01,与 Ang Ⅱ 组相比,##P<0.01
组别 灰度值Control 组Ang Ⅱ组异丙酚组112.16±7.03 135.76±8.14**119.34±7.46##

图8 免疫细胞化学法测定各组细胞中cPKCα 蛋白表达
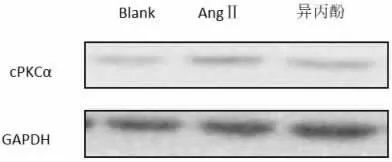
图9 Western Blot 测定各组细胞中cPKCα 蛋白表达
表5 免疫细胞化学法测定各组细胞中cPKCα 蛋白表达(±s)

表5 免疫细胞化学法测定各组细胞中cPKCα 蛋白表达(±s)
注:与 Control 组相比,**P<0.01,与 Ang Ⅱ 组相比,##P<0.01
组别 灰度值Control 组Ang Ⅱ组异丙酚组104.13±6.64 147.62±7.14**123.52±6.37##
3 讨论
心脏主要由成纤维细胞、内皮细胞、心肌细胞和平滑肌细胞组成, 其中大部分是成纤维细胞[11]。心肌成纤维细胞的过度增殖以及胶原沉积是导致心肌纤维化的主要原因[12]。 研究发现,血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)是促心肌纤维化的主要因子,可将心肌纤维细胞诱导为纤维化模型[13]。 异丙酚是常用的麻醉诱导药物,因其对心脏的保护作用而广泛受到关注[14]。 在本研究中,通过AngⅡ诱导心肌成纤维细胞,研究异丙酚抑制血管紧张素Ⅱ诱导的大鼠心肌成纤维细胞增殖的机制。 本研究发现,不同浓度的异丙酚对Ang Ⅱ诱导的大鼠心肌成纤维细胞的增殖均具有一定的抑制作用, 并且100μmol/L 的异丙酚的抑制效果最明显, 因此,后续实验选取100μmol/L 的异丙酚作用于Ang Ⅱ诱导的大鼠心肌成纤维细胞。 同时,本研究还发现,Ang Ⅱ组的细胞G0/G1 期细胞百分率降低,S 期和G2/M 期细胞百分率升高,说明Ang Ⅱ可以促进心肌成纤维细胞的增殖;而异丙酚处理组细胞的G0/G1 期细胞百分率高于 Ang Ⅱ组,S 期和 G2/M 期细胞百分率低于Ang Ⅱ组,说明异丙酚处理后可阻滞心肌成纤维细胞的细胞周期,抑制Ang Ⅱ诱导的心肌成纤维细胞的增殖。
Ang Ⅱ不仅可以促进心肌成纤维细胞的增殖,还可促进其分泌Ⅰ型和Ⅲ型胶原纤维,从而导致心肌纤维化[15]。 因此,心肌成纤维细胞中胶原沉积是导致心肌纤维化的主要因素之一[16]。在本研究中发现,Ang Ⅱ组大鼠的心肌成纤维细胞Ⅰ、Ⅲ 型胶原含量均增加,说明Ang Ⅱ导致了心肌成纤维细胞中的胶原沉积,与文献报道的结果相一致。 而异丙酚处理组大鼠的心肌成纤维细胞Ⅰ、Ⅲ型胶原含量均低于Ang Ⅱ组, 说明异丙酚处理后会缓解AngⅡ诱导心肌成纤维细胞的心肌胶原沉积。
TGF-β1 是促进细胞纤维化的生长转化因子,研究发现AngⅡ 可通过激活心肌成纤维细胞MAPK 蛋白, 从而增加 TGF-β1 的表达量, 因此,TGF-β1 的过度表达是心肌纤维化的重要标志之一[17,18]。本研究发现,Ang Ⅱ组大鼠心肌成纤维细胞中TGF-β1 的蛋白表达量升高,说明Ang Ⅱ使心肌成纤维细胞中的TGF-β1 过度表达。而异丙酚处理组大鼠心肌成纤维细胞中TGF-β1 的蛋白表达量低于Ang Ⅱ组, 说明异丙酚的处理可抑制大鼠心肌成纤维细胞中TGF-β1 的蛋白表达,缓解了成纤维细胞纤维化的程度。
当Ang Ⅱ作用于心肌成纤维细胞后,会活化细胞中甘油二酯结合激活蛋白激酶C(PKC)和细胞外信号调节蛋白激酶(ERK1/2),从而加速蛋白和生长因子的合成与分泌,促进心肌成纤维细胞的增殖和纤维化[19-21]。 在本研究中发现,Ang Ⅱ 组大鼠心肌成纤维细胞中ERK1/2 和cPKCα 的阳性表达均增加, 说明Ang Ⅱ 通过激活 ERK1/2 和cPKCα蛋白,促进心肌纤维细胞的增殖;而异丙酚处理组大鼠心肌成纤维细胞中ERK1/2 和cPKCα 的阳性表达均低于Ang Ⅱ组,说明异丙酚抑制大鼠心肌成纤维细胞的增殖与下调ERK1/2 和cPKCα 的表达相关。
综上所述,异丙酚能够抑制Ang Ⅱ诱导的大鼠心肌成纤维细胞的增殖和Ⅰ、 Ⅲ型胶原含量的增加,推测其可能的作用机制与其降低细胞中TGF-β1 的蛋白表达及抑制 ERK1/2、cPKCα 通路有关。
