3 株W135 群脑膜炎奈瑟菌多位点序列分子分型分析
2020-11-11李曲文黄梦颖谢方钦林震宇徐海滨翁顺太
李曲文,黄梦颖,谢方钦,林震宇,徐海滨,翁顺太
(福建省疾病预防控制中心;福建省人兽共患病研究重点实验室;福建医科大学公共卫生学院专业教学实习基地,福建 福州350000)
随着A+C 群流脑疫苗的普及, 流脑的发病率呈逐年下降趋势,但流脑病例菌群呈一定程度多样性变迁。 由于菌株在疫苗的选择性压力情况下,可使人群中存在脑膜炎奈瑟菌血清群和毒力发生一定的遗传变迁,一旦发生血清群的转换,则又有可能引起新的流脑大流行[1]。 多位点序列分型(multilocus sequence typing,MLST) 通过测定多个管家基因的核苷酸序列,反应细菌基因水平的遗传学衍变[2]。 通过ST 分型可分析菌株进化关系以及在判断分离株是否属高致病性克隆系等方面,可弥补传统方法分型的不足。本中通过MLST 分析我省分离的 3 例W135 菌株的 ST 型别, 以期为我省 W135流脑防控做一定的参考。
1 材料与方法
1.1 菌株来源 福建省2006-2019 年我科实验室分离的W135 群流脑病例菌株3 株。 生化鉴定情况: 梅里埃API NH 鉴定编码为 5002, 鉴定率为99.9% Neisseria meningitidis; 梅里埃VITEK 2 NH卡鉴定编码均为3634400000,鉴定率为98% Neisseria meningitidis。血清凝集实验为:3 株均与W135群凝集,而与其他血清群不凝集;常规PCR 检测结果均为:CrgA 基因阳性,Orf-2(A)基因阴性,SiaD(B)基因阴性,SiaD(C)基因阴性,SiaD(W135)基因阳性。
1.2 主要仪器和试剂 Taq DNA 聚合酶、dNTP 购自大连宝生物工程有限公司,琼脂糖为BioAsia 分装品。 Gel Doc XR+凝胶成像系统,Basic 电泳仪,PCR 扩增仪为ABI 公司。 引物序列由福州铂尚有限公司合成,见表1、表2。
1.3 方法
1.3.1 样本DNA 制备 脑膜炎奈瑟菌接种到血平板,37°C,5% CO2,24h 培养;刮取纯的菌苔用于提取基因组DNA。

表1 PCR 扩增引物

表2 PCR 测序引物
1.3.2 PCR 反应条件 50.0μl 体系(纯水 25.7μl,10x PCR 缓冲液 5.0μl,上游引物 5.0μl10μM 储存浓度,1μM 终浓度,下游引物 5.0μl10μM 储存浓度,1μM终浓度,dNTP 混合液 8.0μl,Taq 聚合酶 0.3μl 1.5个单位,DNA 模板 1μl 50ng 左右)PCR 扩增条件:95°C,2min,(95°C,1min;Tm,1min;72°C,2min) ×30 cycels,72°C,5min(备注 Tm 根据不同因素设置)。
1.3.3 PCR 产物的检测及产物测序 PCR 产物编号送福州铂尚公司测序(双向)。
1.3.4 序列比对分析 样本序列与MLST 网站数据库中已有序列进行比对。获得ST 型。7 个位点均获得序列号后,可以获取菌株的ST 型别号和序列群编号。 然后经BN 软件聚类分析。
2 结果
2.1 7 个管家基因扩增的电泳图

图1 Nm7 个管家基因扩增结果
2.1 MLST 结果 通过对流脑的7 个管家基因进行扩增后进行DNA 测序,序列经 PubMLST 比对后,得出3 株W135 群脑膜炎奈瑟菌有两株为ST11型,一株属于ST4821 型。
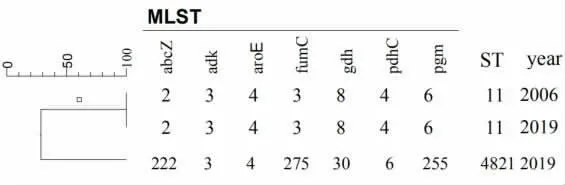
图2 MLST 结果
3 讨论
脑膜炎奈瑟菌根据荚膜多糖的结构特征分为A、B、C、H、I、K、L、W135、X、Y、Z、29E 等 12 个血清群,其中,A、B、C、W135、Y、X 群是目前主要流行的致病菌群。 脑膜炎奈瑟菌具有高度的遗传多样性和高频基因重组的特征,且易出现自发突变和与外源性基因的整合重组,因而克隆群具有呈现多样性特征。 MLST 是一种通过分析一般测定 6~10 个管家基因,内部400~600 bp 核心片段的核酸序列测定的细菌分型方法,根据发现时间的顺序赋予每个位点的核苷酸序列一个等位基因编号,组成等位基因谱即序列型(sequencetype,ST)。 1998 年由 Maiden等首次运用于脑膜炎奈瑟菌的分型,MLST 可分析菌株的谱系关系,对发现常规的表型方法不能分型以及新出现的变异,具有明显优势。 同时MLST 分型可用于国际实验室间比对、溯源以及分子流行病学、遗传进化等,从而准确地研究菌株遗传进化关系,以确定种属[3]。
自2006 年福建省报道了我国首例W135 群之后在广东、广西、江苏、安徽等省(自治区)也相继出现了W135 型脑膜炎奈瑟菌病例[4-6]。 我省在2019年又出现了W135 流脑病例,为了探讨分析菌株之间的遗传相关性,我们对3 株W135 菌株进行MLS T 分型,其中两株为 ST-11,一株为 ST-4821。 目前,全球流脑病例主要由7 个高致病性Nm 序列群的菌株引起, 分别是 ST1 序列群、ST5 序列群、ST8序列群、ST11 序列群、ST32 序列群、ST4144 序列群以及 ST4821 序列群[7,8]。 2005 年以前,中国 W135群 Nm 均属于 ST174;2006 年,ST11 和 ST4821 出现;2008 年,ST174 消失,ST11 成为优势克隆群;与ST4821 相比,ST11 与病人关系更紧密。 ST11 全球主要的高致病克隆系之一,该型曾在非洲引起大规模的暴发[9],我省 2 例 W135 也属于 ST11,提示我省病例菌株也属于高致病性克隆系。 同时我省W135菌株也有一株属于ST4821,ST-4821 在我国曾于2003 年出现 ST-4821 型的 C 群流行,2015 年也出现了ST4821 的B 群的流行,朱兵清等学者发现ST 4821 的B 群与C 群具有相同的遗传背景,可能是由于存在荚膜转换[10-14]。 我省分离到的ST4821 的W135 群是我省首次分离到的ST 型别,也提示了我省存在W135 的遗传多态性。
随着流脑疫苗的接种,菌群不断出现变迁,了解菌株之间的变异遗传进化关系,对于防控流脑的爆发具有重要的指导意义[15,16]。 MLST 方法能为判断流脑流行趋势提供一定的分子流行病学依据。我省存在W135 群遗传分子分型多态性,应引起我省的重视以防范W135 流脑暴发和流行的风险。
