细菌VIII 型分泌系统的研究进展
2020-11-10王奕婷段强德朱国强
王奕婷 ,张 东 ,许 姝 ,段强德 *,朱国强 *
(1. 扬州大学兽医学院,江苏 扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3. 教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
细菌为了促进生物被膜(Biofilm,BF)的形成、提高对宿主细胞的黏附和定植能力,进化出了许多简洁的机制,用来加工、组装和分泌相应的功能性蛋白[1]。目前已经在细菌中发现了9 种分泌系统,包括:I 型分泌系统(Type I secretion system,TISS)由3种蛋白(内膜ABC 转运蛋白、周质膜融合蛋白和外膜孔蛋白)组成跨细胞双层膜的复合物,使分泌的蛋白一次性穿过内外膜分泌到胞外[2];II 型分泌系统(T2SS),与V 型分泌系统(T5SS)的蛋白均依赖内膜上的Sec 转位酶进入细胞周质,再利用β 折叠桶实现跨外膜分泌[3];III 型分泌系统(T3SS)较复杂,效应蛋白利用针状复合体以注射的方式注入宿主细胞内[4];IV 型分泌系统(T4SS)依赖接触效应分子分泌到宿主细胞中[5];VI 型分泌系统(T6SS)被称为噬菌体样结构,蛋白首先穿过细菌自身的细胞膜,再将分泌物质注射到宿主细胞内[6];VII 型分泌系统(T7SS)仅存在革兰氏阳性菌中,分泌的毒力相关蛋白主要是ESAT-6/WXG100 蛋白家族[7];Ⅸ型分泌系统(T9SS)是在一些拟杆菌门细菌中新发现的蛋白分泌系统,也称为PorSS(Porsecretion system,PorSS)[8]。
研究发现,肠杆菌科和其他菌属的胞外卷曲菌毛Curli,是一种能促进细胞黏附、定植、侵袭、释放毒力等功能的淀粉样蛋白[9]。与其他菌毛形成不同,Curli的生物合成需要特定组装机制,因此它的分泌机制代表了一个蛋白形成、分泌和组装的独特系统,这个系统被称为成核沉淀途径或VIII 型分泌系统(T8SS)[10]。本文就T8SS 的结构、分泌途径以及其与病原菌致病相关性的最新研究进展进行综述。
1 Curli 的生物起源
肠杆菌科中许多细菌都能表达Curli,其中在大肠杆菌E. coli和沙门氏菌最为常见[11]。Curli最初是在牛乳腺炎病例中分离的E.coli上发现的[12],随后Collin⁃son 和同事在肠炎沙门氏菌中鉴定了Tafi(沙门氏菌细聚集菌毛)[13],因Tafi和Curli高度同源,于是统称为Curli。虽然是从E. coli感染病例中分离出来的,但后经研究表明,Curli广泛存在于40 多个细菌属中。
早期人们通过电子显微镜观察发现,Curli缠绕在细菌周围的基质中。随后证明Curli存在于细胞外基质(Extracellular matrix,ECM)里,是ECM 众多纤维蛋白的一种[14]。ECM 的功能极为丰富,不仅可以发挥连接、支持、保水、抗压等基本生命活动功能,还能促进细胞增殖、分化、黏附。ECM 作为细菌与宿主细胞黏附的介质,介导Curli与细胞的结合,有利于Curli对宿主细胞行使黏附侵袭、定植、释放毒力和引发宿主免疫的功能[15]。
生物物理学、生物化学结合图像分析等研究表明,Curli是一种淀粉样蛋白[16]。和其他淀粉样蛋白一样,Curli能被刚果红(Congo red,CR)染成红色、与染料硫磺素-T 反应发出荧光。Curli有较高的稳定性,能抵抗各种物理和化学刺激,抵抗蛋白酶消化和1%的十二烷基硫酸钠作用,只有在90%的甲酸中才能解聚,为细菌在体内的定植奠定了基础。
2 T8SS 的结构及分泌途径
2.1 结构组成Curli是由csgBAC 操纵子编码,分别编码csgA、csgB 和csgC 3 种蛋白,其中csgA 和cs⁃gB 是Curli的主要结构组成部分,csgC 是周质蛋白[17]。csgDEFG 操纵子编码的csgE 和csgF 是分泌-装配中不可缺少的辅助因子,csgD 是csgBAC 操纵子的转录激活因子,csgG 是一种脂质蛋白,在外膜周质形成分泌通道。Curli的分泌需要借助以上7 种csg亚基,它们分别在蛋白从胞内到胞外的分泌中发挥不同的作用。
2.1.1 csgA csgA 又称为“curlin”,是Curli的主要结构组成部分[18]。它在细胞表面与csgB 蛋白相互作用,聚集成高度不溶的淀粉样菌毛。csgA 至少可分为3 个结构域,分别是N 末端Sec 依赖性信号序列(前22 个氨基酸)、载客结构域以及被预测是Curli核心的C 末端结构域。N 末端的前22 个氨基酸是维持csgA 的分泌和稳定性,并引导csgA 通过csgG 蛋白通道。csgA 具有5 个重复单元R1~R5,R2~R4 包含的保守Asp 和Gly 残基,调节csgA 以非聚合形式向外膜分泌[19]。
2.1.2 csgB csgB 与csgA 同源性可达30%~40%,是Curli的次要组成成分。它位于细菌表面,作为csgA单体的成核剂,介导Curli聚合[20]。csgA 缺失时,cs⁃gB 能够在细菌表面自组装成短聚合物;在csgB 突变体中,csgA 不能正确组装成Curli,但能以可溶性蛋白形式分泌到细胞培养基中,证明纤维组装不是分泌的先决条件;而当两种天然蛋白都表达时,csgB通过蛋白质-蛋白质相互作用对csgA 进行构象改变,促进Curli的产生。研究发现可溶性csgA 通过接触表达csgB 成核剂(并且不表达csgA)的细胞,会重新聚合成Curli[21]。使用纯化的csgA 和csgB 进行的体外聚合实验进一步表明,这些蛋白质之间的物理接触可促进它们有效的聚合[22]。
2.1.3 csgC csgC(图1 绿色图形标记)是一种周质蛋白,可以阻止周质中淀粉样中间体的形成,避免淀粉样中间体产生细胞毒性[23]。目前关于csgC 的抑制中间体形成机制还不明晰,研究者推测是csgC 的β-链(β4-β5 边缘)发挥作用,上面带正电荷的保守片段介导csgA 和csgC 之间的静电相互作用,从而驱动抑制作用。
2.1.4 csgD csgD 是csgDEFG 操纵子中的一个正向调节转录因子,它能正向调节csgBAC 操纵子的表达[24]。csgD 自 身 的 表 达 受 两 个sigma 因 子(rpoS 和rpoD)、小调控RNA、多种DNA 结合蛋白和几种通过c-di-GMP 作用的蛋白调节。与野生菌株不同的是,csgD 突变株无论何种温度都表达Curli,而野生株受温度影响较大(<30 ℃)。最近研究显示,csgD也能影响Curli操纵子之外基因的转录,包括与促进生物膜产生、糖异生代谢和肽导入相关的基因[25]。
2.1.5 csgE csgE 的缺失会导致Curli失去与CR 指示剂的结合能力,生成白色菌落,并且几乎检测不到csgA、csgB、csgF 和csgG 分泌蛋白[26]。研究发现在体外csgG/csgE 复合物处于可逆的平衡,表明csgE可能处于周质状态与csgG 结合形式二者之间循环,当csgG 过表达时,可以恢复csgE 突变体的CR 结合能力,能检测到Curli[27]。
2.1.6 csgF csgF 可以协调亚基的分泌和聚合。cs⁃gF 以csgG 依赖性方式定位于细胞外表面(图1 红色图形),csgF 对于Curli亚基的分泌不是必要的,但对于Curli的形成是必不可少的,在csgF 突变体中,csgB 不再与细胞表面相连,并且不能发挥其成核功能[28],这与csgF 的3 个独立结构域有关:N-末端非结构化区域、21 残基α-螺旋和由4 条链组成的C-末端反向β-折叠。
2.1.7 csgG csgG 的主要作用是负责Curli亚基在外膜上的转运,是csgA、csgB、csgF 分泌到外膜必须的。研究发现csgG 表达增加了外膜通透性,允许抗生素进入细胞,证实了csgG 的孔状结构(图1 蓝色图形标记)[29]。在没有csgG 时,csgA 和csgB 不稳定且不会发生Curli 组装,CR 平板上突变体菌株呈现白色。目前至少有两种模型可以解释为什么在没有csgG 存在下,csgA 和csgB 不稳定。一种是csgG 可以作为伴侣蛋白,在周质中稳定csgA 和csgB,直到他们分泌到细胞表面;另一种是csgG 通过将csgA 和csgB 运送到细胞表面,避免周质蛋白酶的影响。综上表明,csgG 的功能为稳定csgA 和csgB 并促进Curli的组装。
2.1.8 csgH 在α-变形菌中还发现了一个额外的基因,csgH。它与其它Curli基因的序列同源性很低,与csgH 最相似的是csgC[30]。有研究发现,来自沼泽红假单胞菌的重组csgH 能以csgC 类似方式抑制csgA的过早聚合,抑制淀粉样蛋白FapC(编码淀粉样蛋白的主要亚基)形成,且csgH 比csgC 更有效[31]。
2.2 分泌途径 细菌经革兰氏染色可分为两大类,其中革兰氏阳性菌的结构相对简单,只有一层胞浆膜即内膜,胞浆膜外部是一层厚厚的肽聚糖成分的细胞壁,因此蛋白的分泌只需要穿过细胞质膜和肽聚糖层。而革兰氏阴性菌具有内膜、外膜两层膜,中间是一层薄的肽聚糖层和周质,蛋白的分泌需要通过两个脂质双层,这就使其分泌系统更加复杂多样,分泌过程包括蛋白的内膜运输、胞质转运和外膜运输。Curli分泌同样需要经过内膜的加工、周质的运输以及外膜的加工(图1)。与导致退行性疾病(如阿尔茨海默病、帕金森综合征等)的淀粉样蛋白错误折叠不同,Curli的折叠是有目的、有序的正确折叠[32]。如图1 所示,Curli由操纵子csg(curli sub⁃unit genes)编码和转录,csg 分为csgBAC 和csgDEFG两类操纵子,沿两个转录方向进行,前者包括cs⁃gA、csgB 和csgC 亚基,后者包括csgD、csgE、csgF和csgG 亚基。各个亚基首先通过内膜上的SecYEG转运子穿过内膜(IM)进入周质后,周质内的csgC 和csgE 可以抑制csgA 过早聚合形成中间体,直到转运到外膜的csgG 通道。该通道蛋白与csgE 相结合,协同促进csgA、csgB 及csgF 的通过。进入细胞表面后,csgB 以csgF 依赖性的方式(图1 中绿色和红色)向csgA 提供蛋白模板,采用交叉β 链聚合构象将可溶性csgA“成核”为卷曲纤维并延伸[33]。
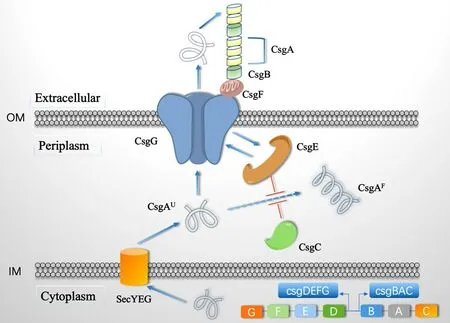
图1 Curli 分泌模型(根据文章[12, 53]汇总整理)
3 Curli 基因表达的调控
Curli基因的表达调控受到诸多因素影响,除了在低盐浓度、营养条件充足以及微含氧环境中可以产生大量csgD,促进Curli表达以外[34]。Curli有复杂的基因表达调控网络,由csgD、Rpos、3 个双组份系统(OmpR/EnvZ、Rcs 和CpxA/R)组成。
蛋白csgD 是调控中枢,一些调控因子通过调控csgD 来控制粘附和生物膜的形成。csgD 正向调节cs⁃gBAC 的启动子,是csgBAC 启动子活化所必需的,而csgBAC 正是Curli表达的主要调控子,其在生物膜的形成中发挥重要作用[35]。
RpoS,稳定期δ 因子,直接或间接的参与了Curli基因的表达的调控。Curli基因的表达主要集中在稳定期并依赖于RpoS 因子,Crl 调控因子与RpoS相互作用,促进RpoS 与csgBAC 启动子区域结合,因此Crl 是大部分肠杆菌Curli基因表达所需要的[36]。除此之外,RpoS 也可以通过MlrA 蛋白的表达来调控Curli基因,MIrA 蛋白正向调控转录因子cs⁃gD,参与Curli的表达[37]。
在OmpR/EnvZ,CpxA/R 和Rcs 3 个双组份系统中,OmpR/EnvZ 对Curli基因的表达调控起主要作用[38]。OmpR/EnvZ 调控外膜蛋白OmpF 和OmpC 的浓度,EnvZ 是激酶感受器,其将信号传递给OmpR,OmpR 进而正向调控csgD 的表达,上调Curli基因的表达量。CpxA/r 双组份系统只有在细胞壁感受到压力或者周质蛋白发生错误折叠时被激活,导致周质分子伴侣和蛋白酶表达上调,错误折叠的周质蛋白被CpxA/r 识别,蛋白酶将其迅速降解[39],避免周质中间体的产生,对细胞造成毒性作用。与Cpx 相似,Rcs 和Cpx 途径都是负向调控Curli操纵子表达,Rcs 途径负责感应膜的压力,特别是外膜压力,负向调控csgD 的表达[40]。
集成宿主因子(IHF)和组蛋白类似蛋白(HN-S)两个全组织调控蛋白,也参与了Curli基因的表达。在沙门菌中敲除IHF基因会减少csgD 的转录并且影响到Curli的表达[41]。HN-S 作用比较复杂,在不同种属的细菌中发挥不同的作用。在沙门菌中敲除HN-S基因会减少csgD 的转录,表明HN-S 可正向调控Curli基因的表达。在E. coliK-12 菌中HNS基因突变会增加csgA 的转录,表明HNS 负性影响Curli表达[42]。进一步证实了Curli基因表达调控的复杂性。正是在这种严密的调控网络下进行的表达,才保证了Curli亚基在时间和空间上的高度协调。
4 Curli 在细菌致病机制中的作用
Curli的表达可以促进病原菌附着、侵入细胞膜并逃避宿主免疫反应,从而引起败血症、感染性休克、脓毒症、全身炎症反应综合征(Systemic inflam⁃matory response syndrome,SIRS)及自身免疫病等疾病[43]。近年来多种疾病被发现均与Curli的表达有关。Curli的致病作用,主要体现在以下几个方面。
4.1 促进BF 形成 许多感染常常与细菌形成BF 有关,Curli能促进细菌BF 的形成[44]。Curli相互连接,把临近的细菌聚集成群落,逐渐发育成BF。BF 一旦形成,即可使Curli对消毒剂、杀菌剂的抵抗力增强;同时,导致细菌对抗生素及机体免疫敏感性降低, 用抗生素难以彻底清除,使病程延长。Curli形成BF 的能力似乎与表达系统的调节功能密切相关,例如Rcs 途径能感知外膜的压力,负向调控cs⁃gD 的表达,减少BF 的形成[45]。有趣的是,Curli只在BF 形成的最初阶段起重要作用,然后随着Cpx 和Rcs 途径在BF 形成期间其变得活跃而被关闭。
4.2 促进细菌的黏附和侵袭Curli是一些病原菌重要的毒力因子,能促进病原菌对机体的黏附和定植。与不产生Curli的E. coliO157 H7 相比,产生Curli的E. coli侵袭HEp-2 细胞的能力更强[46]。在尿路感染中,Curli可促进EPEC 与上皮细胞的粘附,使菌体对抗菌肽的抵抗力加强,增加促炎细胞因子IL-8 的释放,促进疾病的发展[47]。Curli介导的黏附侵袭机制是通过与宿主的相应成分(纤维连接蛋白、纤溶酶原、层粘连蛋白和人接触时相蛋白、主要组织相容性复合体等)结合,介导细菌粘附并进入宿主细胞,增强在宿主细胞内的传播。例如,Curli同时结合纤溶酶原和纤溶酶原激活物,纤溶酶原被激活为纤溶酶,导致组织的降解,细菌就会对细胞造成更深层次的侵入[48];与接触相蛋白(激肽原、纤维蛋白原等)结合,释放促炎性激肽和缓激肽,激活接触相系统,大大增加了细菌在全身扩散方面的优势[49]。
4.3 逃避补体系统 补体是人和脊椎动物血清与组织液中一类蛋白质,经活化后具有调理吞噬、免疫调节和清除免疫复合物等多种生物学效应。Curli可以抑制补体经典途径而逃避补体介导的杀伤作用。最近的研究发现,在含有补体的人血清中,Curli的产生增强了E. coli在体内和体外的存活[50]。进一步研究表明,Curli可以与补体成分C1q 结合,激活经典补体途径,提供对经典补体途径的抗性来保护E. coli免受补体介导的杀伤[51]。这一发现,为Curli的致病机制研究提供了有力的依据。
4.4Curli与相关疾病
4.4.1 炎症反应 在Curli所致的疾病中,真正由菌体所致的损害很小,主要与细菌导致的高水平炎症因子有关。TNF-a、IL-6、IL-8 等炎症因子水平的升高是败血症、感染性休克、脓毒症及SIRS 患者诊断的一项重要指标[52]。如图2 所示,Curli被Toll 样受体(Toll-Like receptors,TLRS)(蓝色图形标记)识别,激活机体先天性免疫系统,促进TNF-a、IL-6、IL-8 等细胞因子的表达,使局部组织细胞出现变性、坏死,引发组织细胞的损坏,导致严重疾病的发生。研究发现,与不表达csgA 蛋白的细菌相比,表达csgA 蛋白的细菌能诱导巨噬细胞产生更高水平的细胞因子,表明csgA 在细胞因子诱导中起一定作用[53]。
4.4.2 感染性休克 感染性休克病人的一个重要病因是一氧化氮(Nitric oxide,NO)引起的低血压。表达Curli的细菌可以激活NO/2 型一氧化氮激酶(Type 2Nitric oxide synthase,NOS2)系统,产生大量的NO[54]。少量的NO 能抵抗病原菌的侵入,过量则会作用于机体各个器官、系统,导致血管平滑肌舒张、血压下降、心动过速和体温降低,诱发休克的发生。

图2 Curli 致病机理模式图(根据文章[25]汇总整理)
4.4.3 自身免疫病 在BF 中存在一种DNA(环境DNA,eDNA)可以与Curli结合,导致自身免疫性疾病发生。能抵抗DNase 处理的eDNA 与Curli结合形成复合物,被树突状细胞(DC)识别和吞噬,诱导细胞炎症因子(IL-6,IL-12)和抗核抗体的产生(免疫球蛋白G 亚类2a 和2b)[54]。抗核抗体是一组对细胞核内的DNA、RNA、蛋白或这些物质的分子复合物产生的自身抗体,它的存在可导致自身免疫性疾病,如红斑狼疮等。
综上,Curli致病机制可能是一个重要的研究方向,可以针对其作用机理采取有效方案,控制相关临床疾病的发生。
5 Curli 的研究方向与展望
BF 是病原侵入宿主的保护膜,Curli又是BF 重要组成部分,因此控制Curli组装是防止BF 形成和进一步损害机体的有力策略之一。此外,Curli具有与疾病相关的淀粉样蛋白相似的生化特性,它也是设计和开发通用淀粉样蛋白抑制剂的合适模型。对于T8SS,目前还有一些假说没有得到证实,比如Curli亚基在通过外膜通道蛋白时所需的能量如何提供;csgC 抑制淀粉样中间体形成的确切机制;csgG与csgE 相互作用的位点和运输CsgA 的工作机制等。T8SS 作为Curli淀粉样蛋白分泌不可或缺的系统,它的深入研究为揭示淀粉样蛋白发生过程,以及疾病诊断、疫苗开发和新药研制提供更完善的理论依据。
