载副猪嗜血杆菌PLGA Omp16 蛋白微球的制备及其免疫效果的初步研究
2020-11-10郑新添林成鸿马露露李晓华黄翠琴
郑新添,林成鸿,马露露,李晓华,黄翠琴*
(1.龙岩学院生命科学学院,福建 龙岩 364000;2.福建省生猪疫病防控工程研究中心,福建 龙岩 364000)
副猪嗜血杆菌(Haemophilus parasuis,H.parasuis)是一种条件性病原菌,存在于健康猪群上呼吸道,其血清型比较复杂,已鉴定的至少包含15 个血清型,尚有15%~20%未能鉴定,国内猪场主要流行血清4 型和5 型。H. parasuis在应激、免疫力低下等条件下,可导致猪感染,引起猪格拉氏病。该病常见于4 周龄~8 周龄猪,发病率约10%~20%,以纤维性多发性浆膜炎、关节炎和脑膜炎为主要病理特征。抗生素在一定程度上能控制H. parasuis感染,但由于耐药性和药物残留导致的食品安全风险,极大限制了抗生素的防控效果,因而疫苗免疫仍然是不可或缺的手段[1]。目前临床使用的H. parasuis疫苗主要为灭活疫苗,但其保护效果特别是对不同血清型的交叉保护不理想。为提高免疫效果,研究者从抗原和免疫佐剂等方面进行了探索。近年来以H. parasuis外膜蛋白如Omp2、Omp5 和D15 等为抗原的疫苗被证实具有较好的免疫效果,成为近期研究的热点[2]。由于亚单位疫苗的抗原性相对较弱,常需要添加佐剂。亚单位疫苗的常规佐剂有铝佐剂和弗氏佐剂等。然而,传统的含油类佐剂会产生免疫副反应,如肉芽肿、溃疡、发热等[3]。
生物可降解材料,如聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、海藻酸、壳聚糖等,制备的微球载体作为蛋白抗原投递系统受到国内外学者关注[4]。微球载体不仅能保护抗原在体内免受不适境破坏,还具有缓释抗原,刺激机体产生体液免疫和细胞免疫反应等作用,已成为一种理想的抗原佐剂[4]。此外,微球疫苗还可以节约抗原,减少接种次数从而减轻疼痛等,备受研究者关注。PLGA 是经美国FDA 认证可降解和具有良好生物相容性的材料。PLGA 微球具有保护药物、抗原等免受环境破坏,可以控制药物和抗原缓释,降低药物毒性和刺激性等优点,已广泛应用于药物和疫苗的研发领域[5]。
为提高H. parasuis疫苗的免疫效果,本研究以H. parasuis外膜蛋白Omp16 为芯材,以PLGA 为壁材制备了H. parasuis微球疫苗;对微球的生物学特性进行测定,并以小鼠为模型评估微球疫苗的免疫效果,以期为开发H. parasuis新型亚单位疫苗奠定实验基础。
1 材料与方法
1.1 主要实验材料H. parasuisLY02 株(血清5 型)及其外膜蛋白Omp16[6]均由福建省生猪疫病防控工程研究中心保存;KM 小鼠购自闽侯县吴氏实验动物贸易有限公司。聚乳酸聚羟基乙酸(PLGA,LA/GA 摩尔比为50 50,分子量15 ku~24 ku,黏度为0.18~0.25)购自济南岱罡生物工程有限公司,聚乙烯醇(PVA)、胎牛血清、透析袋(截留分子质量为25 ku)均购自生工生物工程(上海)股份有限公司;BCA 试剂盒购自上海碧云天生物技术有限公司;HRP 标记羊抗鼠IgG(IgG-HRP)购自博奥森生物技术有限公司。
1.2 微球制备 采用W/O/W 复乳-溶剂挥发法制备PLGA 微球。将0.33 g PLGA 溶解于10 mL 二氯甲烷中,将1 mgH. parasuisOmp16 蛋白溶解于1 mL PBS(pH 7.4, 10 mmol/L),800 r/min 搅拌5 min 形成初乳。向初乳溶液中加入50 mL 含2%(wt%)的PVA 水溶液,800 r/min 搅拌5 min,得到W/O/W 复乳溶液。再将复乳溶液倒入100 mL 0.3% PVA 水溶液中,室温下1 000 r/min 搅拌3 h,蒸干二氯甲烷。2 500 r/min 离心10 min,收集微球,再用超纯水离心洗涤3 次,将微球制成一定浓度悬液,冷冻干燥72 h,收集微球冻干粉,置于4 ℃保存备用。
1.3 微球形态观察和粒径测定 取少量微球分散于蒸馏水中,取一滴涂布于载玻片,置光学显微镜观察。将微球分散于去离子水中,取1 mL 悬浮液置于Microtrac S3500 仪样品池中,进行粒径分布测定。
1.4 微球的包封率和载药量的测定 参照Borges 等方法[7],测定微球的包封率和载药量。先采用BCA试剂盒测定包封前溶液的蛋白量,包被结束后,取1.0 mL 微球悬液,12 000 r/min 离心15 min,再次使用BCA 试剂盒测定上清中的蛋白量,根据以下公式1 和公式2 分别计算微球的包封率和载药率:
公式1 包封率=(包封前蛋白量-上清液中的蛋白量)/包封前蛋白量×100%。
公式2 载药率=(加入蛋白的总质量-上清液中蛋白质量)/干燥微球的质量×100%。
1.5 微球的体外释放试验 采用透析释药法测定微球的体外释放特性。称取微球100 mg,置于透析袋中,样品中加入10.0 mL 释放缓冲液(100 mmol/L so⁃dium phosphate,9.1 mmol/L NaCl,0.01 wt% Tween 80,0.02 wt% NaN3,pH 7.4),用棉绳扎紧封口,放入15 mL 离心管中,于空气浴恒温振荡器(37 ℃,110 r/min)中进行体外释放试验。按照预定的时间间隔(0.5 d、1 d、2 d、6 d、12 d、18 d、24 d、30 d、36 d和42 d)取出离心管,8 000 r/min,离心5 min,取
1.0 mL 释放介质于已经编号的小样品管中,待测。取样完后继续补加1.0 mL 新鲜的释放缓冲液,放入空气浴恒温振荡器中继续释放。取出的释放液中的抗原含量用BCA 法作定量检测,计算累积释放量(按照公式3 计算)。以释放时间为横坐标,累积释放率(按照公式4 计算)为纵坐标,绘制微球在释放介质中抗原的释放曲线。
公式3:Q=Cn×Vt+Vs∑Cn-1
Q:抗原累积释放量(μg),Cn:t 时刻取出释放液的浓度(μg/mL),
Vt:释放介质体积(mL), Vs:每次取出释放介质体积(mL)。
公式4:累积释放率=Qt/Qa×100%
Qt为t 时刻累积释放量,Qa为微球载抗原蛋白总量,即Qa=微球质量×微球载药率
1.6 小鼠免疫试验 将40 只健康KM 小鼠随机分成4 组,分别免疫PLGA 微球疫苗、PLGA 空载微球(即制备过程中不添加抗原蛋白)、H. parasuis灭活疫苗[8]和生理盐水。小鼠通过皮下注射接种,14 d 后加强免疫1 次,免疫剂量和免疫途径同首次免疫(表1)。分别在接种前、首次免疫后二周(14 d.p.i)和再次免疫后二周(28 d.p.i)采集小鼠眼眶后静脉丛血液,分离血清,采用ELISA 法测定血清抗H. parasuisIgG 抗体滴度[9]。将血清作1 80 稀释后,按100 μL/孔加入H. parasuis抗体ELISA 检测反应板(预包被H. parasuisOmp16 蛋白抗原1 μg/mL),置37 ℃孵育40 min。洗板3 次后,加入1 10 000 稀释的HRP 标记羊抗鼠IgG,100 μL/孔,置37 ℃孵育30 min。洗板3 次,加入底物TMB,100 μL/孔,37 ℃避光显色10 min。加终止液2 mol/L H2SO4,50 μL/孔,混匀。终止反应后10 min 内在酶标仪上测定OD450nm值。
1.7 小鼠攻毒试验 再次免疫后15 d(首免后29 d)后进行攻毒试验,每只小鼠腹腔接种4.0 × 109cfu(2 × LD50)H. parasuisLY02 株。记录攻毒后小鼠的临床症状,发病和死亡情况,共观察7 d,未死亡的小鼠迫杀,取剖检小鼠的肺、肝和脾组织进行H. parasuis的PCR 检测[10]。
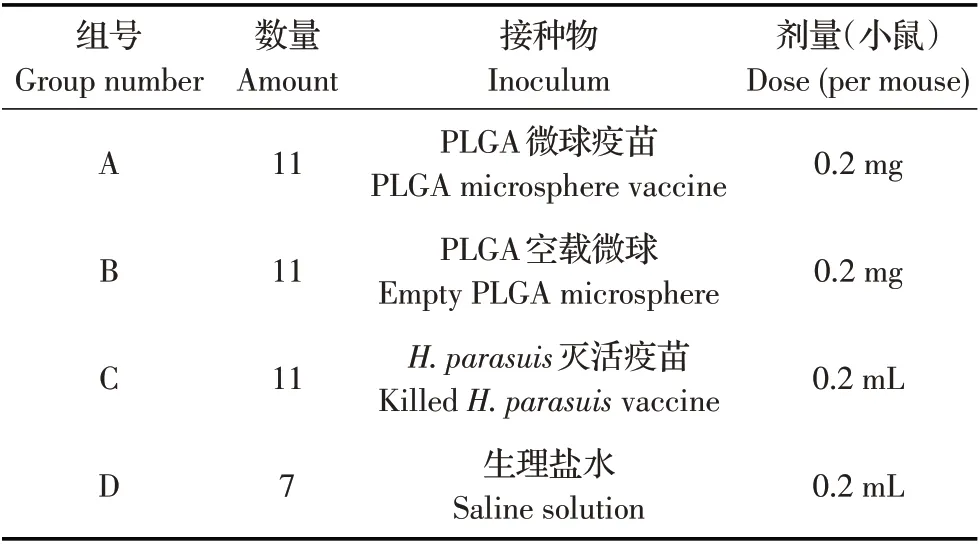
表1 动物分组及免疫剂量Table 1 Animal grouping and immune dose
2 结 果
2.1 微球的形态、粒径分布及微球的包封率和载药率 通过复乳溶剂挥发法制备了PLGA 微球,在光学显微镜下观察显示,制备的PLGA 微球呈球性,表面圆整,分散良好(图1)。激光粒径测定分析显示,微球粒径分布较窄(图2),平均粒径为5.2 μm。表明制备的微球具有典型的PLGA 微球特征、良好的分散性和较为均一的粒径分布。为评估微球包封效率,通过BCA 法测定了制备前Omp16 蛋白总量及包封后溶液上清蛋白含量,根据公式1 和公式2 计算得出,在本次制备条件下微球的包封率和载药率分别为70.5%和5.78%。

图1 微球的形态学观察(40×)Fig. 1 Microspheres observed under an optical microscope
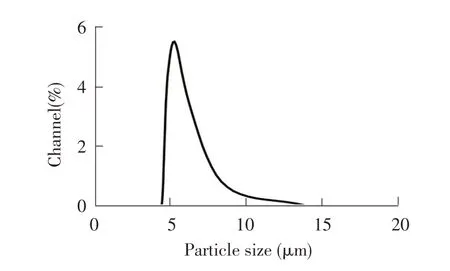
图2 微球的粒径分布图Fig. 2 Particle size distribution of microspheres
2.2 微球体外释放试验结果 为评估微球的缓释效果,采用透析释药法测定微球的释放特性。结果显示,包被于微球的抗原蛋白Omp16 在12 h 内释放20%,而第2 d 开始,释放速率下降,至42 d 累积释放率达到95.3%(图3)。表明微球在体外PBS 溶液中缓释效果较好。
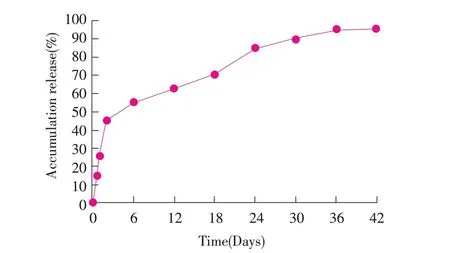
图3 微球的体外释放曲线Fig. 3 In vitro release profile of encapsulated Omp16 from PLGA microspheres
2.3 小鼠免疫试验结果 为评估微球疫苗的免疫效果,以小鼠为模型进行了免疫接种试验,即小鼠分别接种H. parasuis微球疫苗、空载微球和H. parasuis灭活疫苗,空白对照组接种生理盐水。以相同剂量接种两次,中间间隔14 d。ELISA 检测抗体结果显示,疫苗组(A 组和C 组)均产生H. parasuis抗体,而对照组(B 组和D 组)则未检测到H. parasuis抗体。微球疫苗组小鼠在首次免疫后二周(14 d.p.i)抗体水平显著低于灭活疫苗组(p<0.05),然而在加强免疫后二周即首次免疫后28 d(28 d.p.i),微球疫苗组小鼠抗体水平极显著高于灭活苗组(p<0.01)(图4)。结果表明,PLGA 微球显著促进了Omp16 抗原刺激小鼠产生体液免疫应答水平。
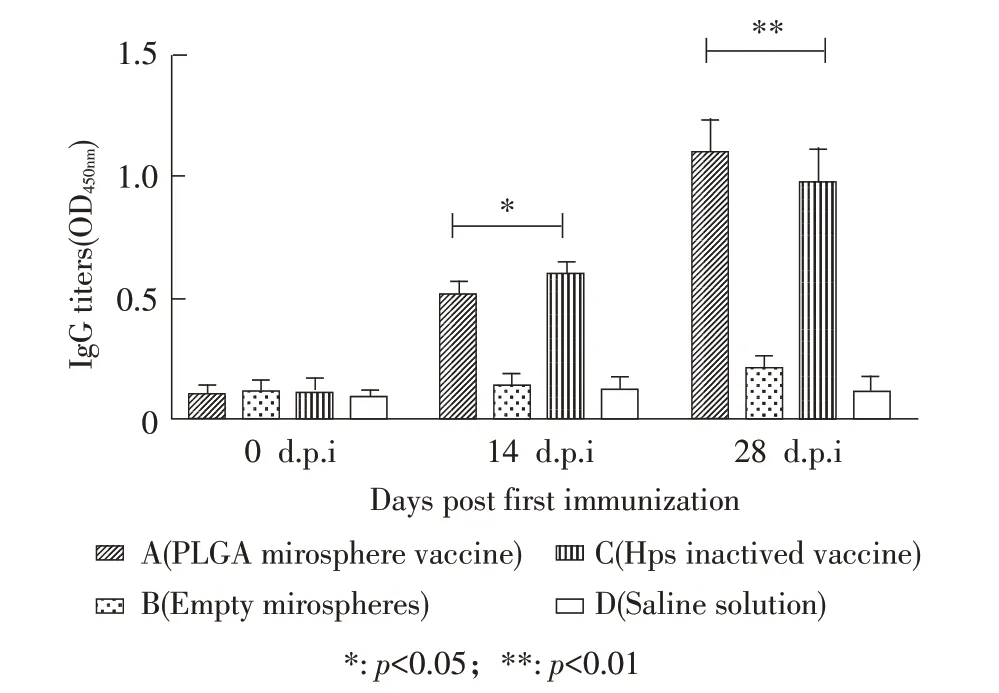
图4 各组小鼠抗副猪嗜血杆菌IgG 抗体水平的检测结果Fig. 4 IgG levels of mice after immunization
2.4 小鼠攻毒试验结果 最后一次免疫15 d 后,各组小鼠以腹腔注射方式攻毒2 LD50的血清5 型H. parasuisLY02 株,结果显示,空白微球组和生理盐水对照组小鼠主要表现为精神沉郁,食欲下降,被毛粗乱,体温升高(39.6 ℃~40.5 ℃),在攻毒24 h内这两组所有小鼠均死亡,经PCR 检测在死亡小鼠脾脏和肺等组织检出H. parasuis。而微球疫苗组小鼠在攻毒后,食欲下降,部分小鼠体温升高至
39.5 ℃~40.0 ℃后恢复正常;灭活疫苗组小鼠主要表现为精神沉郁,部分小鼠体温升高至39.5 ℃~40.0 ℃,食欲下降及被毛粗乱。在观察期内(攻毒后7 d),微球疫苗组对小鼠的保护率为81.8%(9/11),显著高于灭活疫苗组的保护率63.6%(7/11)(p<0.05)。上述结果表明,微球疫苗显著提高了小鼠的攻毒保护率。
3 讨 论
微球的制备方法包括相分离法、喷雾干燥法、复乳溶剂挥发法和超临界流体激素等,其中复乳法的设备要求简单,操作较为简便,制备条件相对温和,可较大限度避免抗原在制备过程中遭受破坏,是目前最常用的方法之一。基于此,本研究选用复乳溶剂挥发法制备PLGA 微球。
微球的粒径大小影响微球疫苗诱导的免疫类型。研究报道表明,小于10 μm 的微球能被吞噬细胞和树突细胞识别和吞噬,从而刺激机体的免疫反应[11]。微球不仅能刺激体液免疫反应,也能刺激细胞免疫反应,微米级微球偏向于激活体液免疫,而纳米级微球有利于激活细胞免疫[12]。本研究制备的PLGA 微球粒径约5.2 μm,诱导了强烈的体液免疫反应,这也与其粒径有关。
微球的粒径分布与其制备参数密切相关。表面活性剂的种类和浓度、PLGA 浓度、油水相体积比及混合速度等均可影响微球粒径。本研究制备的微球粒径分布,获得了一个相对较窄的峰,说明其粒径相对比较均一。然而,机械搅拌乳化法尽管设备简单,但是采用该方法制备的微球粒径均一性较差,通过膜乳化法可以获得粒径均一性较好的微球。
抗原的包封率和载药率是影响微球疫苗免疫效果的主要因素之一。本研究制备的微球疫苗包封率为70.5%,载药率为5.78%。影响微球包封率和载药率的因素包括抗原浓度、粒径大小和制备工艺参数(如搅拌速度、体系温度和搅拌时间)等。由此,若进一步优化微球制备工艺,将进一步提高微球疫苗的包封率和载药率,从而可进行单次接种免疫,节约抗原用量,节省成本。
为了评估微球疫苗的缓释效果,进行了微球的体外抗原释放试验。结果显示,微球疫苗释放动力曲线符合双相动力模型,在开始12 h 抗原释放速率较快,随后释放速度下降,最终微球释放时间持续42 d,累计释放95.3%,说明微球具有良好的缓释效果,这与微球疫苗免疫后小鼠获得更高滴度的抗体水平相吻合。与灭活疫苗组相比,微球疫苗组小鼠在免疫后14 d 抗体水平低于灭活疫苗疫苗组,而在免疫后28 d 则显著高于灭活疫苗组,其原因是微球疫苗抗原是逐渐释放的,在早期抗原浓度低于灭活疫苗抗原,因此在免疫后14 d 抗体水平低于灭活疫苗组;而随着微球疫苗释放的抗原浓度逐渐增加,抗体水平也持续增加,在28 d.p.i 抗体水平显著高于灭活疫苗组。
脉冲式释放药物或抗原是微球疫苗的特征之一。PLGA 微球释放抗原可对机体免疫系统持续刺激,从而为其产生长久坚固免疫力提供可能。由于微球呈非均一性降解,抗原从微球释放的曲线通常是二相或三相[13]。第一阶段通常是抗原突释,即释放速度快,主要原因是吸附于微球表面的抗原释放或/和抗原从微球空隙及制备过程中微球的崩解。PLGA 自身的物理性质如乳酸/羟基乙酸的比例、相对分子质量、微球表面形态、粒径大小、环境温度等因素直接影响到PLGA 的降解速率,从而影响微球内药物的释放性能[14]。由于微球性质的差异(如壁材、芯材成分及制备方法不同),微球疫苗的缓释时间可从数天、数星期甚至一个月以上不等[15]。
体液免疫是猪抵抗副猪嗜血杆菌的主要感染机制,本研究显示PLGA 微球投递载体显著提高了IgG抗体水平,免疫小鼠获得了较高的保护率。此外,微球疫苗还可能诱导了小鼠细胞免疫应答,与体液免疫共同抵抗H. parasuisLY02 株的感染。总之,本研究初步制备了包封H. parasuis外膜蛋白Omp16 的PLGA 微球,并证实微球佐剂能提高抗原的免疫效果,为PLGA 微球成为H. parasuis亚单位疫苗候选佐剂提供了有力佐证。
