锁骨下动脉闭塞复杂型病变腔内治疗的研究
2020-11-10刘亚军王迪赵卫东王智伟米娜周天宝张建张伏生
刘亚军 王迪 赵卫东 王智伟 米娜 周天宝 张建 张伏生
锁骨下动脉近端完全闭塞病变(chronic total occlusion,CTO)一旦出现显著且失代偿的临床症状则对脑供血或肢体供血危害极大,相关症状主要包括椎-基底动脉供血不足、上肢远端缺血表现、冠状动脉搭桥术应用胸廓内动脉搭桥后出现心绞痛症状或下肢缺血行腋动脉-股动脉转流术的患者出现下肢缺血[1,2]。经皮穿刺血管内成形术(percutaneous transluminal angioplasty,PTA)已经作为安全、有效的方式来治疗锁骨下动脉狭窄病变。然而到目前为止,主要针对复杂、特殊类型的此类病变相关的治疗策略和管理方案的研究却很少。在本研究中,针对188例锁骨下动脉近端完全性闭塞患者的治疗,主要总结了治疗闭塞型病变的临床经验和结果,分析并讨论锁骨下动脉CTO病变治疗策略,主要内容为病变特点决定不同操作方式、提高手术治疗成功率的途径、右侧病变脑保护等外科治疗过程中的一系列问题。
1 资料与方法
1.1 一般资料 回顾秦皇岛市第一医院心血管外科和首都医科大学宣武医院血管外科2012年10月至2019年12月收治的188例锁骨下动脉近端完全性闭塞的住院患者行腔内介入治疗资料。纳入标准:锁骨下动脉近端100%完全性闭塞患者(按动脉内膜切除试验法确定血管狭窄程度。狭窄率=[(狭窄远端直径-最小残余直径)/狭窄远端直径]×100%。 狭窄率1%~49%为轻度狭窄,50%~69%为中度狭窄,70%~99%为重度狭窄,100%为完全闭塞),拟行乳内动脉搭桥术可无症状,其余患者均经神经内科及血管外科专科医师诊断,且明确临床症状为锁骨下动脉闭塞而引发。 排除标准:排除未达到100%闭塞程度的患者,排除病因为多发性大动脉炎发病患者,排除双侧锁骨下动脉同时完全闭塞病例。本组188例情况:病因为动脉硬化184例(97.9%),外伤或局部压迫牵拉原因4例。其中男135例,女53例;年龄42~83岁,平均年龄(65.6±12.1)岁。病程范围1~39个月,平均病程(10.5±4.3)个月。 左侧锁骨下动脉闭塞病变148例(79.7%),右侧病变40例(21.3%)。5例(2.6%)冠状动脉-锁骨下动脉窃血综合征,6例(3.2%)拟应用左乳内动脉行左前降支冠状动脉搭桥术。
1.2 治疗
1.2.1 介入治疗均局部麻醉下进行,动脉穿刺入路首选为股动脉,经8F鞘送入导引导管,导丝及导管配合在主动脉弓部进行选择,如果导丝股动脉路径再通失败,则穿刺患侧肱动脉,逆行操作再通,也可同时采取股动脉及肱动脉双向结合再通方式。 若再通闭塞段成功后一般考虑贯穿导丝达到牵张作用,这样操作的优点为提供更稳固的支架释放保证,若扩张后出现动脉破裂可从一端快速放置球囊或覆膜支架控制出血,具体方式为导丝直接选入股动脉鞘或用抓捕器使导丝捕获后贯穿上、下通路。应用双入路协作操作的优点在于上、下途径做路径图造影可更完整、准确显影局部轮廓,帮助术者判断寻找到近端支撑部。球囊扩张满意后我们首选股动脉入路释放支架。对于右锁骨下动脉闭塞复杂病变,再通操作前根据风险评估可应用颈动脉保护伞。成功支架后造影观测再狭窄情况,若>20%,予以实施球囊后扩。患者至少术前3 d开始服用阿司匹林(100 mg,德国拜耳医药公司)100 mg/d,及氯吡格雷(75 mg赛诺菲圣德堡民生制药有限公司)75 mg/日联合抗血小板药物,或术前日服用负荷量阿司匹林300 mg及氯吡格雷300 mg,术后联合抗血小板药物6个月,无禁忌证情况下阿司匹林100 mg/d长期服用。患者出院后3个月、半年、1年时进行门诊随访复查,此后每年门诊随访1次。随访内容对再发临床症状、双侧肱动脉血压测量,影像学资料采用超声彩色多普勒或锁骨下动脉CTA,必要时DSA检查。如果发现出现再狭窄,且狭窄程度>50%,且症状复发或新发需重新诊断后考虑再次介入治疗或开放手术治疗。
1.2.2 造影机设备应用数字化血管造影机(德国西门子公司/美国GE公司),对比造影剂为碘海醇(100 ml扬子江药业)或碘克沙醇(威视派克100 ml GE爱尔兰医疗)。动脉鞘(5-8F日本Terumo公司);超滑、交换导丝(日本Terumo公司),造影导管(Cordis公司),外周球囊导管(美国美敦力公司/因泰克公司),自彭式支架(美国美敦力公司/因泰克公司/巴德公司),球扩式外周支架 (因泰克公司),颈动脉保护伞(Filterwire EZ美国波士顿公司/SpiderFX英国eV3),PTFE人工血管 (美国Gore 公司/美国Adwards公司)。
1.3 观察指标 临床成功定义为腔内支架成功放置后造影残余狭窄<30%,手术成功后无吻合口狭窄及血管堵塞,未发生脑梗死或死亡,症状显著缓解;再狭窄定义为如果症状重新出现,且影像学证实支架管腔明显狭窄闭塞或吻合口或人造血管腔明显狭窄或堵塞;治疗失败定义为未能再通闭塞部位、围术期出现手术相关明显并发症或患者死亡;随访通畅定义为为随访期间支架或管腔持续为血流通畅,无盗血及缺血相关症状。
2 结果
2.1 治疗结果 133例成功再通后行闭塞段支架植入治疗,总体成功率为70.75%(133/188),其中113例为左侧闭塞病变,左侧成功率为76.36%(113/148);40例为右侧闭塞病变,成功率为50.0%(20/40),共使用裸支架149枚,其中18例应用2枚支架治疗。股动脉通路再通53例,联合通路80例。共55例未能回到真腔再通而终止治疗,其中35例后转行旁路手术治疗,12例保守治疗,8例出院后失访。
2.2 并发症 围手术期无死亡病例,10例(5.3%)发生手术相关并发症,因穿刺部位动脉血栓手术取栓1例,穿刺部血肿3例,球囊扩张后夹层或出血,行覆膜支架2例,局部小夹层加放1枚裸支架1例,发生神经系统脑缺血并发症均为右侧病变未应用颈动脉保护伞3例。
2.3 随访 患者出院后随访3~75个月,平均(40.2±8.5)个月,其中165例(87.8%)随访已超过6个月,共有8例失访,11例随访资料记录收集不全,12例(6.38%)随访过程中非原发病相关因素死亡。成功治疗病例术后12个月的通畅率是98.2%,24个月是93.9%,3年为91.2%,5年为83.8%。
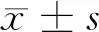
2.4 CTO病变长度与腔内治疗成功率比较 闭塞段>3 cm治疗成功率明显降低(χ2=21.27,P<0.05)。见表1、2。
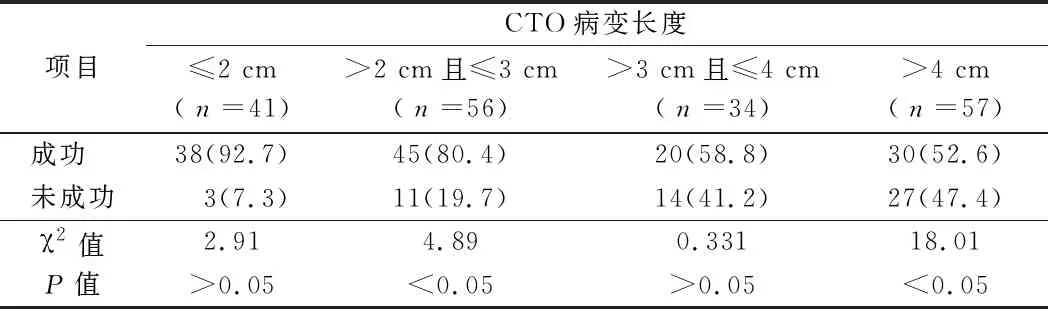
表1 CTO病变长度与腔内治疗成功情况 n=188,例(%)

表2 CTO>3 cm病变与腔内治疗成功率比较 n=188,例(%)
2.5 CTO病变形态不同与腔内治疗成功率比较 闭塞病变形态不同提示闭塞硬化程度不一样,影响治疗成功率(χ2=11.01,P<0.05)。见表3。
表3 CTO病变形态与腔内治疗成功率比较 n=188,例(%)
2.6 右侧CTO病变腔内治疗比较 应用颈动脉保护伞与未应用保护伞的结果差异有统计学意义(χ2=9.33,P<0.05)。见表4。

表4 右侧应用保护伞的结果比较 n=40,例(%)
3 讨论
锁骨下动脉硬化闭塞病变在早期的流行病学检出率偏低,然而,随着医学检查技术的不断进步,当患者椎动脉出现逆向血流或患侧肢体远端血流严重障碍时,可出现相关缺血症状[3]。此外随着冠状动脉搭桥术的不断开展,如果是锁骨下动脉近端闭塞发生在曾应用胸廓内动脉作为移植材料实施了左前降支冠状动脉旁路移植术的患者,一旦出现胸廓内桥血管动脉逆向血流,即冠状动脉-锁骨下动脉窃血时患者就可能会出现心肌缺血表现,严重者危及生命[4,5]。
腔内微创治疗锁骨下动脉病变安全、有效,对于患者来说易于耐受,创伤微小,特别是针对合并严重疾病耐受力差的高龄患者。但是,我们针对100%完全闭塞的复杂病变的研究结果得到的再通成功率(70.7%)低于以狭窄病变和手术旁路,之前对于类型病变的腔内治疗相关报道成功率为25%~94%[6],然而Martinez等[7]报道取得了极好的成功率,绝大多数技术成功均能获得临床成功。我们随访的通畅率结果与其他非完全闭塞病变的研究[6,7]基本相当。我们分析是这些结果的差异可能缘于闭塞段长度、病变形成时间,病变位置和形态及邻近椎动脉情况的不同。近端锁骨下动脉闭塞病变越长,腔内治疗成功率越低,且以3 cm为界限最明显(χ2=21.27,P<0.05)。此外,病变形态不同提示闭塞硬化程度不一样,治疗成功率有差异(χ2=11.01,P<0.05)。其中闭塞头端呈锐角的“嵌插状”类型再通率最高,可达89.1%。而起始部不清的再通率最低。对于DSA所显示的闭塞段头端呈“嵌插状”或“尖头状”的病变,常提示闭塞时间较短,内部未完全钙化坚硬,闭塞段长度多在2 cm左右,且导引导管能稳定停留并指引导丝头部方向,可用导丝的头端可以钻入潜在缝隙旋转前进,若且为长度3 cm 以内病变则不用钻入内膜下多即可获得闭塞段的穿通,此种情况股动脉单入路时常可实施。也有研究报道描述了残端呈“尖头”样病变开通率较高[8]。反复操作亦容易发生导丝穿通或撕裂动脉内膜。此类多应用动脉内膜下再通(subintimal recanalization,SIR)技术[9],导丝在内膜下腔通过较短的闭塞段后在达到椎动脉起始部水平之前重返动脉真腔是SIR成功的关键步骤,所以长段病变多临近或累计椎动脉,此种条件下可能因担心损伤椎动脉而放弃反复试行,因此会降低成功率。而对于在锁骨下动脉起始部闭塞病变,因为导引导管不能稳定停留在近端动脉部,就算导丝头端部分进入,因为支撑不稳定,导丝很容易弹回主动脉处,而右侧如此操作很可能损伤右侧颈总动脉,尤其是逆行操作或球囊扩张都可诱发颈动脉栓塞,导致操作最终失败或神经系统严重并发症。
在完全闭塞或者更复杂右侧锁骨下动脉闭塞性病变的治疗中很容易遇到常规的股动脉入路导丝无法通过病变部位血管或者球囊和支架定位及通过困难的麻烦[10]。复杂病变情况下往往通过加用患侧肱动脉入路,为了克服两种容易造成失败的情况,可采用股动脉和上肢动脉双向穿刺入路,推荐实施贯穿导丝的方法,我们的结果是成功病例中80例(60.2%)应用联合入路,DSA时双导管取顺、逆行同时造影或显示路径图,可以更准确、清晰地显示闭塞部位和判断导丝前行方向,必要时用微导丝选择也显得尤为重要。以防强行开通造成动脉破裂或主动脉弓夹层等严重高危并发症。而且还能在放置支架时更清晰地显示椎动脉开口部位,准确定位支架更好地保护患者椎动脉血供,采用微导丝时由于锁骨下动脉远端血管压力较低,即使导丝在穿出血管外,一般也不会引起严重并发症。我们在病例的治疗中,如果经上肢逆行再通成功,将导丝选入股动脉鞘或用抓捕器取出,使导丝贯通上、下通路鞘管,支架绝大多数从股动脉端送入。锁骨下动脉官腔相对较粗,应用的球囊及支架直径往往较大,甚至有时达到直径10 mm,而球囊扩张支架一般需要7F输送,在球囊扩张或支架植入过程中,若始终从肱动脉输送则可能发生肱动脉损伤,穿刺置鞘处并发症也会增加。而股动脉入路很粗的导引导管置入。当遇到牛角弓时候,导丝导管很难做到稳定支撑,操作往往十分困难,即便通过病变在支架进入预定释放位置的过程中有时存在困难。如果建立了我们上述的贯穿牵张导丝,就会提供更强的支撑力,还可以拉伸复杂动脉弓角度。而且,双向入路加牵张导丝的建立还可以快速处理血管破裂的相关并发症。一旦发现锁骨下动脉在球囊扩张后破裂则可以立即从导丝的另一端送入压迫球囊或覆膜支架,第一时间封堵破裂动脉,抢救生命[11]。
由于颈动脉为顺向血流,当逆行再通闭塞部,板块碎屑很可能进入邻近的颈动脉内[6,7]。右锁骨下动脉病变不同于左侧,其解剖和治疗有其特殊之处,在腔内治疗更需注意与之相邻的颈总动脉近端。然而多数动脉狭窄闭塞的右锁骨下动脉病变位置绝大多数是接近共同主干的右锁骨下动脉和右颈总动脉分叉处。我们研究中的右侧病变至右颈总动脉开口只有(1.06±0.49)cm,所以在右侧病变植入支架时存在影响右颈总动脉开口的危险。在手术实施过程中,就会因担心因为支架压迫右颈总动脉开口而更向远端释放支架,随之右锁骨下病变覆盖不足的情况就会时常发生。在我们的研究中,21例缺少颈动脉保护措施的情况下出现了3例脑栓塞或缺血发作。而应用颈动脉保护伞18例成功治疗且无脑缺血相关并发症,差异有统计学意义(χ2=9.33,P<0.05)。我们认为相比支架的放置过程,导丝、导管的反复戳插和球囊的反复预扩被认为是导致板块碎屑脱落的更直接原因,因此我们此时多选择球扩支架减低过多扩张的风险。在我们的研究中,18例高危患者应用了右颈动脉保护伞,开通成功率高于未用保护伞病例(13.6% VS 0),可能跟保护伞应用后,操作者可更放心的实施开通或小球囊预扩张有关。18例均检查保护伞内7例发现了不同程度碎屑物,其中1例在手术过程中即可看到较大脱落钙化内膜。Felipe等[12]研究成功实施左、右锁骨下及无名动脉病变时均实施了颈动脉及椎动脉保护。但是椎动脉保护伞的使用证据不足。本组患者均存在锁骨下动脉窃血,开通及成形支架过程中椎动脉均为逆向血流,说明出现椎-基底动脉系栓塞的几率很低,并不需要放置椎动脉保护伞。上述证据表明,采用颈动脉实施脑保护装置结合腔内支架治疗右锁骨下动脉闭塞病变是安全可行的方法,随访其远期效果经证实也是令人满意的。但支架成形后应尽量减少再刺激,尤其尽量避免后扩,最大限度降低椎-基底动脉系统栓塞的可能。但是,就算实施预期开通几率高的病变也不可单纯追求必须取得成功而反复、过度机械操作尝试开通,增加手术风险,必要时应该选择手术治疗方法。
综上所述,通过不断积累经验,手术技术和材料使用熟练掌握,明确干预适应证,支架治疗可作为治疗锁骨下动脉完全性闭塞病变的良好方案。尤其是对于闭塞较短、位置及形态较好的病变应首选腔内治疗,而长段及严重钙化的起始部病变,腔内或旁路的选择要根据患者情况综合考虑,在处理右侧闭塞病变应用颈动脉保护伞预防脑栓塞更安全。
