肝硬化患者应用质子泵抑制剂前后细菌DNA和内毒素的变化及意义
2020-11-10郭晓会王建华冯志杰任海霞刘晓东郭永泽
郭晓会 王建华 冯志杰 任海霞 刘晓东 郭永泽
肝硬化是世界范围内日益严重的公共卫生问题,与逐渐升高的发病率和死亡率密切相关,各种因素长期或反复损伤肝实质导致肝硬化是慢性肝病的主要并发症[1,2]。据统计,2010年,肝硬化占全球总死亡率的2%,目前全球估计有8.44亿人患有慢性肝病,每年有200万人死于慢性肝病,全球慢性肝病患病率为4.5%~9%,每年约有633 000例演变为肝硬化[3,4]。肝硬化主要表现为门静脉高压及肝功能障碍,当肝硬化患者处于失代偿期时将会面临一系列并发症,包括自发性腹膜炎、肝性脑病、上消化道大出血、肝肾综合征、肝肺综合征等,严重影响患者的生活和生存质量[5,6]。因此,了解肝硬化相关细菌免疫表型表现和病理生理机制,可能会降低肝硬化患者的感染易感性,更好的做好风险分层,并评估新方法的治疗疗效。质子泵抑制剂(PPIs)被广泛应用于肝硬化患者,并作为预防上消化道出血的主要治疗措施。短期使用PPIs可增加机体感染风险,为此,我们通过测定细菌数量和内毒素水平的变化,探讨肝硬化患者短期使用PPIs的安全性及临床意义。
1 资料与方法
1.1 一般资料 收集2018年1月至2019年3月在我院消化内科治疗的肝硬化患者107例,其中男55例,女52例;年龄41~83岁,平均年龄(71.45±5.20)岁。肝硬化的诊断基于组织学、临床症状、实验室试验和影像学检查,采用Child-Pugh分级标准对肝硬化患者进行分级,其中A级28例、B级57例、C级22例,患者均无冠心病、慢性阻塞性肺气肿、严重肝肾功能不全、使用免疫抑制剂、存在其他消化道感染及恶性肿瘤病史,同时选取体检部健康体检者60例为对照组。
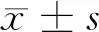
1.2 方法 肝硬化患者均给予奥美拉唑40 mg/次,静脉输注,2次/d,治疗4周,测定治疗前后细菌DNA水平及内毒素水平。患者均于治疗前和治疗后晨起空腹状态下抽取外周静脉血5 ml,以12 000 r/min离心5 min,分离血清,采用荧光免疫法检测血浆中内毒素水平,PCR测序方法检测肝硬化腹水患者细菌DNA。
2 结果
2.1 肝硬化患者和对照组血浆中内毒素水平比较 根据肝硬化严重程度,将肝硬化患者分为Child-Pugh A级(28例)、B级(57例)、C级(22例),Child-Pugh A、B、C级患者血浆内毒素水平分别为(47.91±10.12)pg/ml、(55.08±11.45)pg/ml、(61.04±9.51)pg/ml,明显高于对照组(40.81±8.97)pg/ml,差异均有统计学意义(P<0.05),且随着患者病情的加重,内毒素表达水平明显增高。见表1。
2.2 血浆中内毒素表达水平与腹水的关系 根据有无腹水将107例肝硬化患者分为有腹水组和无腹水组,其中有腹水组69例(Child B级和C级),无腹水组38例,有腹水组患者血浆中内毒素水平为(57.12±9.34)pg/ml,无腹水组血浆中内毒素水平为(48.95±11.28)pg/ml,差异有统计学意义(P<0.05)。见表2。
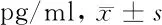
表1 2组血浆中内毒素水平比较
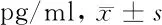
表2 血浆中内毒素表达水平与腹水的关系
2.3 血浆中内毒素表达水平与肝硬化严重程度关联性 Spearman相关性分析显示,肝硬化严重程度和内毒素之间呈很强线性相关(r=0.73,P=0.02),Child-Pugh分级越高,内毒素表达水平越高,血浆中内毒素表达水平在一定范围内可反映肝硬化严重程度。见图1。
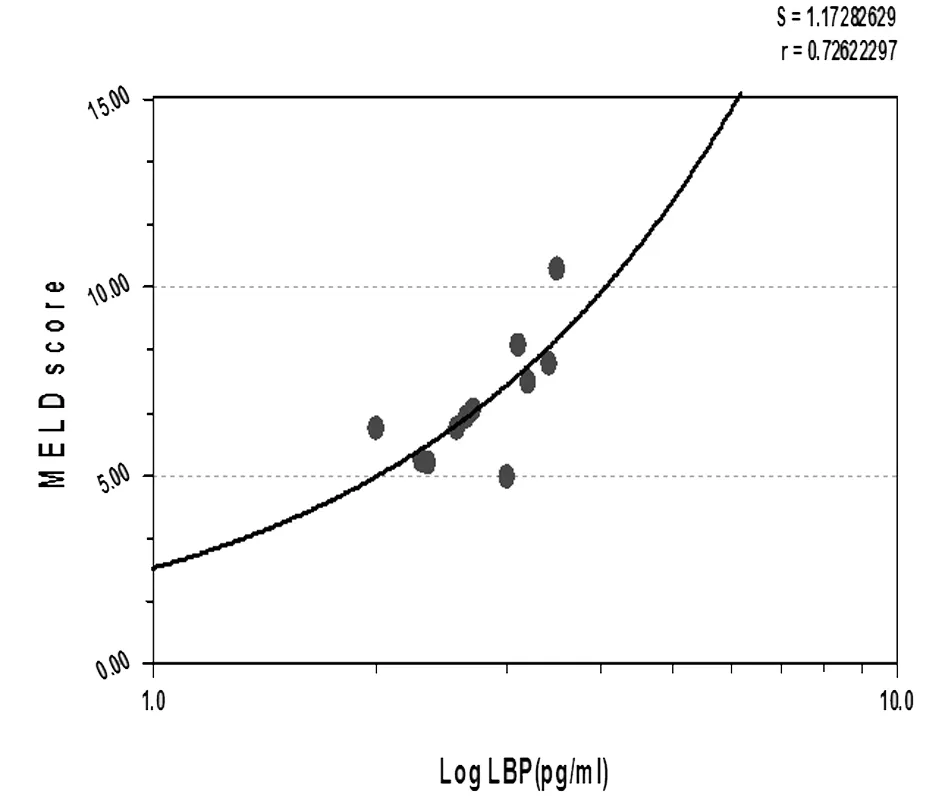
图1 血浆中内毒素表达水平与肝硬化严重程度关联性
2.4 PPIs治疗前后腹水患者细菌DNA表达水平 对肝硬化腹水患者进行细菌培养,结果均为阴性,其中35例患者腹水中检测到细菌DNA[(9.66±1.24)IgCFU/g],质子泵抑制剂治疗后,细菌DNA表达水平[(10.04±1.06)IgCFU/g],差异无统计学意义(P>0.05)。见表4。

表4 PPIs治疗前后腹水患者细菌DNA表达水平
2.5 PPIs治疗前后血浆中内毒素表达水平 107例肝硬化患者血浆中内毒素表达水平治疗前(52.56±8.91)pg/ml与治疗后(53.46±9.71)pg/ml比较,差异无统计学意义(P>0.05)。见表5。
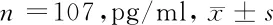
表5 PPIs治疗前后血浆中内毒素表达水平
3 讨论
肝硬化是损害全球健康的一个主要原因,2010年造成3 100万残疾调整生命年(DALYs),占全球DALYs的1.2%,约100万人死亡,占当年全球死亡总数的2%[7]。肝硬化作为一种常见的消化系统疾病,由于其发病率高、病死率高,极易癌变等特点,受到越来越多的医学研究者关注。研究表明,肝硬化是一种与硬化相关的免疫功能障碍综合征所引起的免疫功能紊乱,其可导致小肠蠕动减慢,肠道细菌过度生长和肠壁通透性增加,从而引起细菌转位、肠道相关感染增多[8]。相反,细菌感染常影响机体血流动力学和凝血功能障碍,是导致肝功能衰竭、肝硬化相关并发症、肝硬化死亡的主要原因之一[9]。质子泵抑制剂(PPIs)在抑制胃酸分泌方面非常有效,并被广泛用于产酸过多引起的疾病。临床工作中,我们常需使用PPIs预防肝硬化患者食管胃底静脉曲张、门脉高血压性胃病可能产生的消化道出血等风险。有研究表明PPIs在肝硬化中的应用,可降低肝硬化患者的酸分泌、降低幽门螺杆菌感染、减少消化性溃疡及上消化道出血、再出血风险[10],肝脏是PPIs的代谢的主要场所,长期使用PPIs可加重对肝脏损伤,并能引起肠道菌群失调、肠道细菌移位,增加自发性腹膜炎的发生,加大肝硬化死亡率及病死率,因此我们探讨肝硬化患者使用质子泵抑制剂的安全性。
内毒素是体内一种较强的缩血管物质,其与受体结合后调节机体局部和全身血流变化,对于维持内环境稳定起重要作用[11]。内毒素受体广泛分布于呼吸、心血管、脑血管、消化、内分泌等系统,与许多疾病的发生发展关系密切。同时,内毒素也是革兰阴性细菌的细胞壁成分,当细菌死亡和裂解时,内毒素被释放出来。内毒素是一种脂多糖,主要来源于肠道菌群,包括多糖成分负责其抗原性,脂质成分负责其毒性,随着细菌成分不断进入周围环境,大量的内毒素暴露[12],因此,内毒素可作为反应机体炎性程度的标记物之一。肝硬化时由于肠道黏膜通透性增加,肠道菌群失调或移位,细菌过度生长,肠道屏障功能减退,使得内毒素的产生和吸收均明显增加,同时,由于肝硬化时肝脏库弗细胞、星状细胞、肝窦内皮细胞受损、门体静脉分流,导致肝脏清除内毒素的能力下降,肝脏是阻止肠道细菌释放内毒素进入体循环的重要屏障,而一旦肝脏功能受损,内毒素进入体内引起组织损伤,因此,肝硬化患者在一定程度上会出现内源性内毒素血症。研究报道,肝硬化有72%~79%患者会并发内毒素血症,是引起肝硬化并发感染甚至多脏器功能损害的主要原因[11]。内毒素可直接诱导库弗细胞释放多种细胞因子和炎性介质,参与肝脏多种疾病的病理生理过程,并在肝硬化腹水的形成中其至关重要作用。有研究表明,肝硬化患者血浆中内毒素表达水平显著升高,有腹水患者升高更明显,且血浆中内毒素表达水平与肝功能状态及门静脉压力成正比,内毒素水平越高,肝硬化患者越容易发生自发性腹膜炎[13]。本研究结果发现Child-Pugh A级、B级、C级肝硬化患者血浆中内毒素水平与健康体检者比较,显著增高,差异有统计学意义(P<0.05),且随着Child-Pugh A级、B级、C级患者肝功能减退,内毒素水平越来越高,提示随着肝脏肝功能严重性,内毒素表达水平也逐渐增高,差异有统计学意义(P<0.05),说明血浆中内毒素表达水平与肝硬化患者肝功能损伤程度有关,入院后检测血浆中内毒素水平对了解肝硬化患者一般情况及评估病情有非常重要的意义。
晚期肝硬化患者易发生各种危险并发症,包括食管胃底静脉曲张、腹水、肝性脑病(HE)、门静脉高压症引起的肾脏和心脏紊乱、高动态循环及其血流动力学和代谢紊乱,在肝硬化的各种危险并发症中,腹水与肝硬化患者生存期有关,持续恶化的腹水患者生活质量较差。门静脉高压和内脏动脉血管扩张与内脏源性内毒素血症密切相关,是肝硬化腹水发生的主要原因[14]。肝硬化晚期,内脏血管舒张引起明显的动脉充盈,引起肾素血管紧张素醛固酮系统(RAAS)、交感神经系统(SNS)和AVP的最大活化,肝硬化腹水患者的自然结果是肾脏灌注减少、钠和水潴留以及稀释性低钠血症。肠源性全身感染和局部感染对肝硬化患者临床过程影响的不断演变,也是肝硬化腹水形成的一种重要因素。研究表明,内毒素升高可引起肝星状细胞收缩,导致肝血窦变小,肝血流减少甚至完全停止,进而肝脏微循环功能障碍,肝内阻力增加,同时,内毒素升高可引起肝脏血管收缩增加门脉血管阻力,参与机体高动力循环而使腹水进一步加重,此外,内毒素可诱导肝脏细胞释放多种细胞因子和炎性介质,如:TNF、NO、自由基等,其中TNF和NO可使血管和胃肠道平滑肌处于松弛状态,造成胃肠道淤血,缺血缺氧,蠕动减慢,功能减低,促进肝硬化并发症的发生发展。本研究中,我们根据有无腹水将107例肝硬化患者分为腹水组和无腹水组,检测血浆中内毒素表达水平,结果发现腹水组患者内毒素表达水平较无腹水组患者明显升高,差异有统计学意义(P<0.05),且发现,内毒素水平与肝脏严重程度之间呈线性相关,内毒素水平越高,肝脏损伤越重,提示内毒素表达水平可作为预测肝脏疾病严重程度的标记物。
肝硬化是由许多因素引起的弥漫性肝损害,肝硬化往往伴随着严重的并发症和自发性细菌性腹膜炎(SBP),SBP在终末期肝硬化患者中的发生率约为10%~30%。肝硬化发生后,机体免疫功能严重下降,尤其是机体白细胞(WBC)和巨噬细胞的吞噬作用降低,破坏了肝内质网内皮系统的稳定性[15]。随着时间的延长,可引起上消化道出血、肝性脑病、肝肾综合征等并发症。SBP是肝硬化患者死亡的主要原因之一。肝硬化患者由于肝网状内皮系统吞噬细胞活性低下,补体产生减少,以及细菌通过门静脉分流进入总循环,因此其发生细菌感染的风险较高。最常见的是自发性细菌性腹膜炎(SBP)、尿路感染、呼吸道感染(肺炎)、软组织感染和菌血症。肝硬化患者细菌感染的敏感性增加,由于网状内皮细胞系统吞噬功能受损和肝内血流量增多,导致肝脏对细菌的清除作用并不充分,尿路感染、SBP、呼吸道感染和败血症是该种情况下最常见的细菌感染。SBP可能是一种危及患者生命的并发症,潜在肝功能障碍和肾损害的严重程度,如肝肾综合征(HRS),与肝硬化患者预后不良相关。一项607例肝硬化患者的研究中,作者观察到PPIs与自发性细菌性腹膜炎(SBP)、死亡率和其他感染之间均无相关性,而肝硬化的严重程度,可能使感染等相关并发症发生率增高[7]。一项多中心前瞻性研究,表明长期使用PPIs与SBP的高发生率相关[15]。正常情况下,成人肠道菌群相对稳定,只有在患病或服药时才会出现紊乱。肝硬化的原因有很多,肝硬化患者患有不同程度的肠道菌群失衡,表现为显著减少的双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌科和显著增加的肠球菌。这种失衡在肝硬化患者尤为突出,所以提出了肠-肝轴的概念,为阐明肠道菌群变化(主要是细菌数量和比例的变化及细菌定位的变化)提供依据,并与肝硬化的发生发展密切相关。本研究中,我们通过对69例肝硬化腹水患者进行细菌培养,结果均为阴性,其中有35例患者腹水细菌DNA为阳性,经过4周常规奥美拉唑治疗后,再次检测腹水患者细菌DNA,较治疗前未见明显变化,提示短期内使用PPIs对肝硬化患者肠道菌群、细菌移位无明显影响,短期内使用PPIs是安全的,因此,早期治疗肠道菌群失调是否为肝硬化腹水的治疗提供了更好的解决方案还有待进一步研究。
肝硬化患者内镜检查时常会出现门脉高压性胃病、食管胃底静脉曲张、消化性溃疡、反流性食管炎等,部分患者经常合并冠心病、高血压需要长期口服阿司匹林、氯比格雷等抗凝药物,因此,需要使用PPIs治疗缓解临床症状[16],且PPIs能促进肝细胞再生,清除自由基、羟基,保护细胞膜,抑制炎性因子,减少细胞凋亡及细胞脂质氧化,起到抗炎、抗氧化、抗纤维化等作用,另外,还可增加前列腺素合成,增加肝脏血流,改善肝脏微循环,改善肝脏缺血缺氧,有效逆转肝硬化发生发展。根除幽门螺杆菌并不能避免肝硬化患者消化性溃疡的复发,但多数溃疡复发都与幽门螺杆菌感染有关,因此,奥美拉唑的维持治疗是非常必要的,与幽门螺杆菌的感染与否无关。然而,使用PPIs可引起胃酸减少、胃肠运动减弱、嗜中性粒细胞功能降低、粒细胞减少、单核细胞氧化应激损伤、肠道旁细胞渗透性增加,免疫功能受损[17],因此,与感染有一定关联性。长期使用PPIs可引起小肠细菌过度生长已在动物和人类的研究中得到证实[18],长期使用PPIs亦可增加肺炎、艰难梭菌结肠炎、肝性脑病的风险,是一个较高的独立危险因素。本研究结果发现治疗前后内毒素表达水平无明显变化,提示短期内使用PPIs对机体炎性因子浓度水平无明显影响,对细菌转位和机体感染无影响。
综上所述,本研究探讨内毒素表达水平与肝硬化严重程度之间的关系,内毒素水平越高,肝硬化患者肝脏损伤程度越重,腹水程度越重,可作为肝硬化患者预后预测指标之一,短期内使用PPIs对肝硬化患者的细胞因子浓度和细菌数量没有影响,表明短期使用PPIs是安全的。然而,研究中我们发现有部分患者的DNA呈阳性反应,可能增加隐源性感染的几率,通过早期调节肝硬化患者的肠道菌群,是否会降低肝硬化合并腹水或自发性腹膜炎患者的临床病死率,内毒素是否可作为一种无创监测指标,还需要我们进行更多的研究、更长的随访时间,以确认长期使用PPIs对晚期肝病患者的安全性。
