水牛miRNA-155重组腺病毒载体的构建及生物信息学分析
2020-11-06沈朋雷王露露陈维丽冯万有卢嘉卡陆凤花石德顺
吴 飞,沈朋雷,王露露,陈维丽,冯万有,俸 云,卢嘉卡,陆凤花,石德顺
(广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
卵母细胞体外成熟技术是将卵巢卵泡中的未成熟卵子取出,放在模拟体内卵泡环境的培养液中进行体外培养,使卵母细胞达到成熟阶段并具有受精能力的技术。近些年来,卵母细胞体外成熟过程中的调控机制被大量研究,该技术与体外受精技术相结合在动物繁殖领域中得到了广泛的应用,并且卵母细胞体外成熟技术也被纳入人类辅助生殖战略[1]。在卵泡中,卵丘-卵母细胞复合体(COCs)之间的结构对卵母细胞发育极为重要[2]。卵丘细胞参与雌配子发育、减数分裂以及体外受精等过程。但是,卵丘细胞在卵母细胞的成熟和受精过程中发挥的具体作用机制仍有待进一步研究。在体外成熟过程中,与猫卵母细胞结合不紧密的卵丘细胞并不能提高卵母细胞的成熟率[3]。兔卵丘细胞的脱落将导致卵母细胞成熟率下降[4]。牛卵丘细胞会分泌雌二醇和孕酮,进而参与体外成熟过程[5],在成熟前,牛COCs中卵丘细胞的清除会降低卵母细胞成熟和胚胎发育到囊胚阶段的速度[6]。卵丘细胞中的基因表达调控着卵母细胞减数分裂的恢复,同时卵母细胞中的分泌因子也会影响卵丘细胞的扩张。鉴于卵丘细胞和卵母细胞来自于同一微环境,且卵丘细胞对卵母细胞的成熟及后续胚胎发育都极为重要,因此很多学者通过研究卵丘细胞的基因表达来筛选可能预测胚胎发育潜能的分子标记[7]。
MicroRNAs (miRNAs)是近年来发现的一类调控RNA,是一种长度约为22个核苷酸的短非编码RNA,miRNAs通过与靶基因的序列互补配对来降解或抑制mRNA翻译,调控靶基因的表达和翻译[8-9]。Dicer1是miRNA生物发生过程中的一个重要核糖核酸酶,其敲除动物模型的建立使得miRNA在卵巢功能中的作用得以阐明。Dicer1基因敲除(KO)导致小鼠早期胚胎致死,表明Dicer1以及miRNA在胚胎发育中发挥了重要作用[10]。目前已经有30多种miRNA KO的小鼠模型,这其中有11个miRNA被证实在卵巢功能上有重要作用。然而,并不是所有的KO模型都表现出生殖表型的改变[11]。miR-200b或miR-429缺失的小鼠没有生殖缺陷,但是当这2种miRNA都被缺失时,会导致小鼠不育[12]。沈朋雷等[13]研究发现相对于水牛GV期卵丘细胞而言,miRNA-155在MⅡ期卵丘细胞中显著上调,预示着miRNA-155有可能在卵母细胞体外成熟过程中发挥重要作用。而关于miRNA-155在卵丘细胞中所起的作用机制,以及miRNA-155是否会通过作用于卵丘细胞进而影响卵母细胞的发育却未见报道。
腺病毒载体是目前较为常用的一种载体,其增殖速度快,且基因组信息完全清楚,易于操作,宿主范围广,病毒基因组不会整合到宿主DNA中,安全性高。因此,本试验通过构建miRNA-155重组腺病毒载体,并在卵丘细胞上过表达,为进一步研究水牛卵母细胞体外成熟过程中miRNA-155在卵丘细胞中发挥的作用奠定基础。
1 材料与方法
1.1 材料及主要试剂水牛卵巢取自南宁市屠宰场,装入37℃生理盐水的保温瓶中,4 h内送回实验室。用75%酒精清洗30~60 s,37℃生理盐水清洗2遍,选取直径2~6 mm卵泡抽取卵泡液,在体视显微镜下检出COCs,体外成熟24 h后,收MⅡ期卵丘细胞培养备用。
细胞培养基(DMEM)、青霉素、链霉素及Trizol(Invirtrogen公司);HEK-293细胞、HEK-293T细胞、pDC316-mCMV-EGFP、pBHGloxdelE13cre均由本实验室保存;限制性内切酶Hind Ⅲ(TaKaRa公司);大肠杆菌DH5α感受态细胞(全式金公司);去内毒质粒提取试剂盒Endo-Free Plasmid Mini Kit 和胶回收试剂盒E.Z.N.A Gel Extraction Kit(OMEGA公司);细胞转染试剂ViaFectTM(Promega公司);同源重组试剂盒ClonExpress Ultra One Step Cloning Kit,反转录试剂盒HiScript Ⅲ 1st Strand cDNA Synthesis Kit,实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)试剂盒,ChamQ Universal SYBR qPCR Master Mix(诺唯赞公司)。
1.2 水牛miRNA-155的克隆及腺病毒载体的构建在miRBase中检索牛pre-miRNA-155序列,并从NCBI中获取pre-miRNA-155上游200 bp碱基,下游150 bp碱基的初级转录本pri-miRNA-155序列,设计pri-miR-155目的片段扩增引物(表1),由上海生工生物有限公司合成。以水牛卵巢基因组为模板,扩增pri-miR-155序列琼脂糖凝胶电泳后,胶回收获得目的产物。使用限制性内切酶Hind Ⅲ将目的产物和pDC316-mCMV-EGFP分别酶切,胶回收,利用同源重组的方法将目的产物和线性化载体连接,转化、酶切、测序。
1.3 生物信息学分析利用DNAStar软件中的MegAlign程序将测序结果与牛序列进行比对。利用MEGA 7.0软件构建系统进化树。利用TargetScan进行靶基因预测,DAVID获取靶基因ID,KOBAS 3.0对靶基因ID进行KEGG和GO分析,RStudio进行KEGG和GO富集分析作图。
1.4 腺病毒的包装与扩增pBHGloxdelE13cre分别和DC316-mCMV-EGFP-pri-miR-155、pDC316-mCMV-EGFP以2∶1混匀,质粒与转染试剂ViaFectTM混合在optim-MEM中,室温孵育30 min。而后加入到汇合度约70%的HEK-293细胞中,37℃,5% CO2培养箱培养。6 h后更换为DMEM培养基。连续培养10 d,每天加入0.5 mL培养基。在显微镜下观察细胞空斑病变,荧光显微镜观察EGFP的表达情况。用细胞刮将细胞刮起,4℃,800 r/min 离心10 min,弃上清,剩余悬液进行重悬。在液氮和37℃水中反复冻融3次,4℃,1 200 r/min 离心10 min,用0.45 μm过滤器过滤后取上清。对包装好的腺病毒颗粒进行3次病毒扩增,获得高浓度Ad-miR-155和Ad-EGFP腺病毒颗粒。
1.5 腺病毒滴度检测将HEK-293T细胞接种到96孔板中,每孔接种1×104~1×105个细胞,37℃,5% CO2培养箱培养24 h;10倍倍比稀释病毒原液后,依次将其加入96孔板中,37℃,5% CO2培养箱培养48 h,根据感染细胞中绿色荧光细胞的阳性数计算病毒滴度。
1.6 实时荧光定量分别使用MOI=200的Ad-EGFP和Ad-miR-155感染水牛卵丘细胞,37℃,5% CO2培养箱培养48 h。提取RNA,使用诺唯赞反转录试剂盒合成cDNA,RT-qPCR检测miR-155、Wee1、CD44、TRPS1的表达情况。miR-155反转录特异性引物、内参U6基因及相关定量引物如表1所示。

表1 引物信息
2 结果
2.1 pDC316-mCMV-EGFP-pri-miR-155载体构建以卵巢基因组为模板,利用RT-PCR技术扩增pri-miR-155序列,序列长度为413 bp,并将此序列克隆至pDC316-mCMV-EGFP上,获得重组质粒pDC316-mCMV-EGFP-pri-miR-155。限制性内切酶Hind Ⅲ酶切重组质粒,凝胶电泳检测。结果如图1A所示,与预期片段大小相符,测序结果和pri-miR-155序列基本吻合(图1B)。

图1 载体构建结果 A.M.DL15000 DNA Marker;1.Hind Ⅲ 单酶切产物;B.pri-miR-155测序比对结果
2.2 物种间pre-miR-155基因同源性比较本试验中水牛pre-miR-155基因与其他14个物种同源性分析结果显示,其中水牛pre-miR-155基因与黄牛和马的同源性最高,达到100%,与狼、家兔、原鸡、树鼩、猕猴的同源性达到95%以上,与黑猩猩、褐家鼠、小家鼠、倭黑猩猩、人的同源性也达到90%以上,而与斑马鱼和爪蟾的同源性最低,分别为58.7%和71.4%;表明水牛pre-miR-155基因在进化过程中保守性较强。
2.3 pre-miR-155基因的系统进化分析使用MEGA 7.0软件对15个物种的miR-155基因进行系统进化树分析,结果显示,水牛pre-miR-155基因与哺乳动物猕猴、马、黄牛、狼、家兔在同一分支上,亲缘关系最为接近,与原鸡在相近的分支上,亲缘关系较近,与倭黑猩猩、人、黑猩猩、褐家鼠、小家鼠、树鼩亲缘性较差,形成一个较远分支,与斑马鱼和爪蟾亲缘性最差,分别形成很远的分支(图2)。

图2 不同物种间pre-miRNA-155基因的进化树
2.4 miRNA-155预测靶基因GO富集分析通过对miRNA-155的预测靶基因进行分子组分(图3)、生物过程(图4)及细胞组分(图5)方面富集分析,可以发现其预测靶基因主要富集在细胞分化、细胞发育、细胞凋亡、胚胎发育、蛋白磷酸化、组蛋白甲基化等多个生物学过程中。作用部位主要是在细胞核内,主要通过与RNA聚合酶Ⅱ核心启动子近端区序列特异性结合发挥作用。
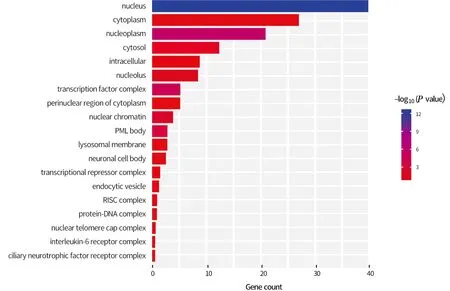
图5 miR-155预测靶基因在细胞组分(CC)层面富集结果

图4 miR-155预测靶基因在生物过程(BP)层面富集结果(前20个)
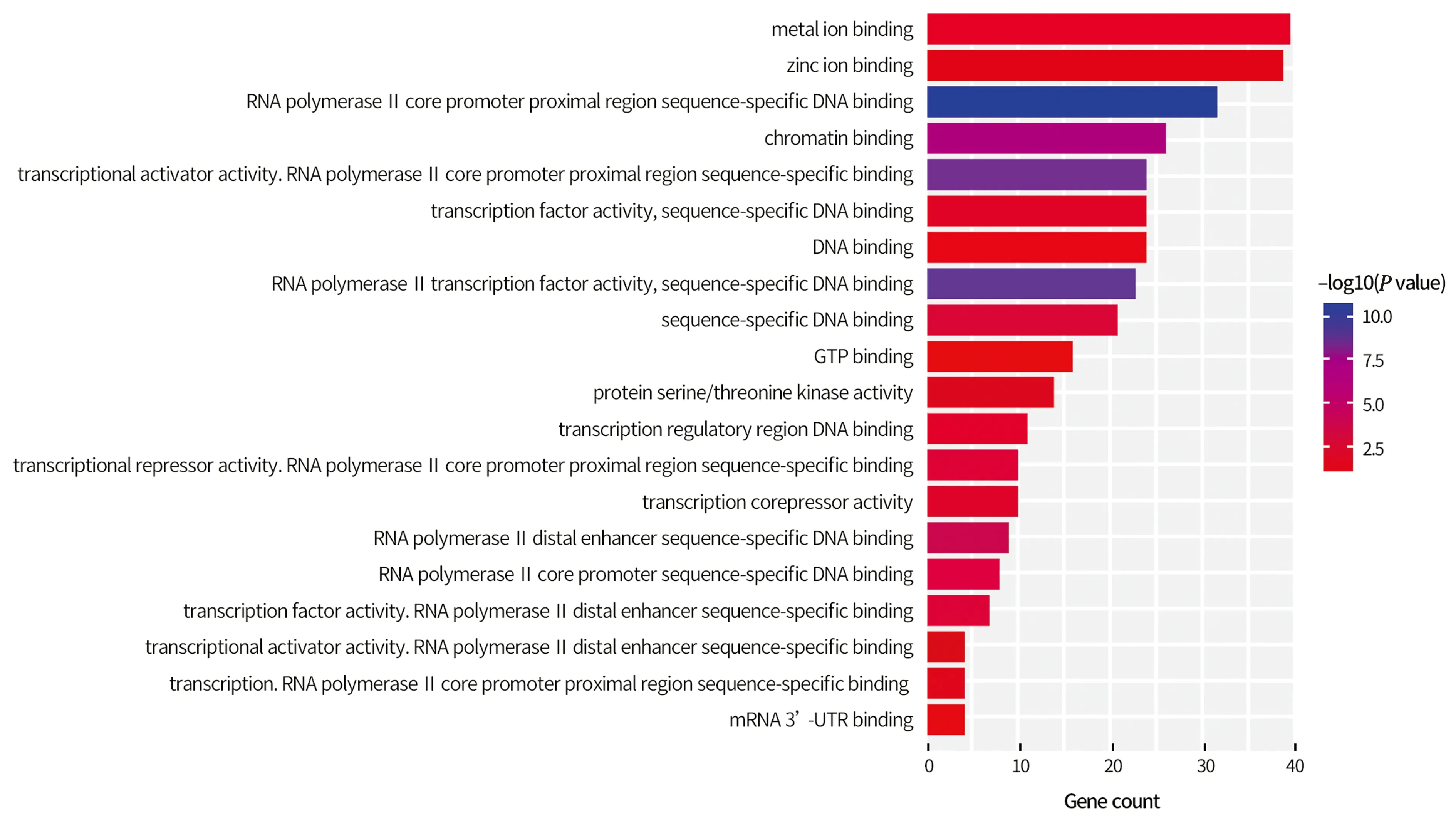
图3 miR-155预测靶基因在分子组分(MF)层面富集结果
2.5 miRNA-155预测靶基因KEGG富集分析通过Target Scan预测得到miRNA-155的靶基因共498个,从DAVID中调取靶基因ID,KOBAS 3.0对靶基因ID进行KEGG分析得到208条相关信号通路,选取前20条信号通路通过RStudio进行作图(图6),发现这些靶基因主要参与MAPK信号通路、PI3K-AKT信号通路、mTOR信号通路、cAMP信号通路、T细胞和B细胞受体信号通路、癌细胞和干细胞信号通路等,这些信号通路主要集中在对细胞的周期、增殖、凋亡、物质代谢等的调控。

图6 miRNA-155预测靶基因KEGG富集散点图
2.6 重组腺病毒Ad-miR-155包装及滴度测定pBHGloxdelE13cre和pDC316-mCMV-EGFP-miR-155共转染HEK-293细胞后,3 d在荧光显微镜下观察到绿色荧光蛋白的表达,5 d绿色荧光蛋白表达显著增强,10 d细胞从皿底脱落,90%以上的细胞有绿色荧光蛋白的表达(图7)。包装好的重组腺病毒Ad-miR-155经过3轮扩增和浓缩之后,梯度稀释法测得病毒滴度为1×1010GFU/mL。
2.7 RT-qPCR检测Ad-miR-155和Ad-EGFP感染水牛卵丘细胞48 h后,倒置荧光显微镜下观察到卵丘细胞有绿色荧光蛋白的表达(图8)。RT-qPCR检测发现,Ad-miR-155感染的水牛卵丘细胞中的miR-155的表达量显著高于Ad-EGFP组(P<0.01),过表达miR-155后Wee1、CD44、Trps1均显著下调(图9,P<0.01)。
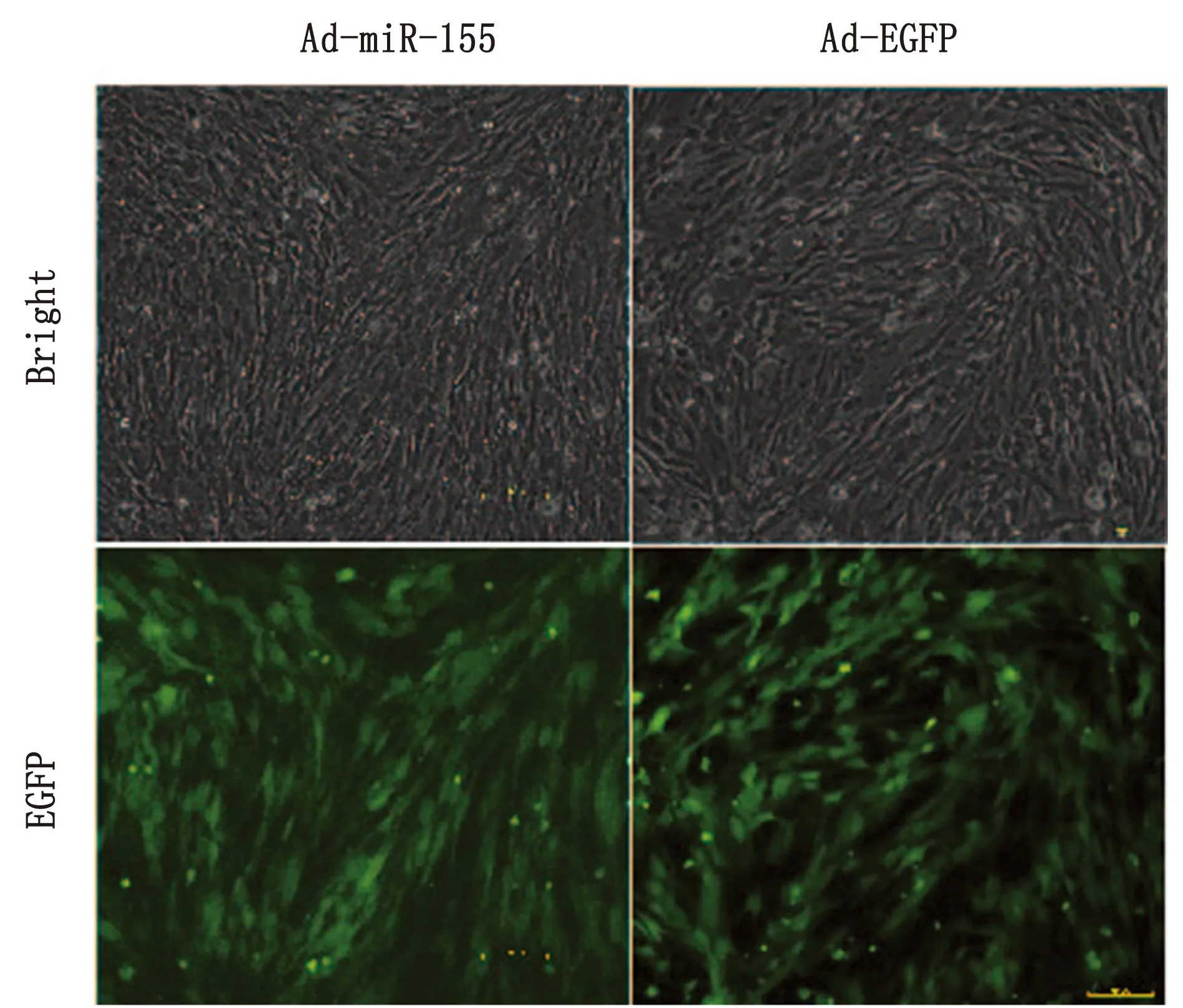
图8 Ad-miR-155 和Ad-EGFP感染水牛卵丘细胞荧光检测结果

图9 Ad-miR-155 和Ad-EGFP组miR-155及部分靶基因的表达水平 **.P<0.01
3 讨论
KROL等[14]预测miRNA调控哺乳动物至少30%的基因表达。miRNA与特定靶mRNA的3′ UTR 相结合,通过转录后基因调控对细胞产生生物学影响[15]。miRNA-155参与细胞增殖、分化和凋亡,并且在维持体内平衡和免疫系统的功能中起着关键作用[16]。研究表明,信号转导和转录激活因子3 (STAT3)与miR-155的启动子结合,下调miR-155的表达[17]。也有报道称miR-155能够通过STAT3信号通路调控Panc-1和Capan-2胰腺癌细胞的转移和侵袭,以及Hep-2细胞在肝癌中的增殖和侵袭[18-19]。下调miR-155的表达能够显著降低胃癌细胞中VEGF、MMP2和MMP9的表达,以及增加SOCS1的表达,从而抑制胃癌细胞的侵袭转移[20]。miRNA-155通过与内皮型-氧化氮合酶(eNOS) mRNA的3′ UTR结合抑制eNOS表达[21],eNOS缺乏不仅会影响排卵,还会影响卵母细胞减数分裂的成熟。eNOS敲除的小鼠会导致其卵巢缺陷,eNOS来源的一氧化氮(NO)是卵母细胞减数分裂成熟的调节剂[22]。牛发情周期的3,7 d,miR-155在次级卵泡和优势卵泡中均有差异表达,预示着在卵丘细胞中成熟的miR-155参与调控卵泡的发育[23]。
AdMax包装系统是通过Cre/loxP获得重组病毒,将携带目的基因的腺病毒穿梭质粒与携带腺病毒大部分基因组的骨架质粒共转染HEK-293细胞,利用Cre/loxP系统的作用进行重组,获取重组腺病毒。与典型同源重组法(双质粒共转染)、Ad-Easy法、Ad5/F35MaxTM包装系统相比,AdMax包装系统存在操作方便简单、获取的病毒滴度较高、重组效率较高且可高效表达目的基因等多种优势。本试验使用AdMax包装系统成功获得Ad-miR-155重组腺病毒,感染水牛卵丘细胞后发现miR-155表达量显著上调。过表达miR-155基因并检测部分预测靶基因,发现Wee1、CD44、TRPS1显著下调,Wee1蛋白激酶产物是成熟促进因子(MPF)的负调节者[24],Wee1包含Wee1A和Wee1B两种亚型,它可以通过使Cdc2蛋白的Tyr-15位点发生磷酸化进而抑制MPF的激活,而Cdc25可拮抗Wee1的作用以维持MPF活性,二者共同作用使MPF部分失活,这也是卵母细胞MⅠ/MⅡ转化所必需的[25-26]。在哺乳动物体内,体积小于正常细胞体积的80%的细胞不可以发生有丝分裂,细胞中MPF不能被激活,其主要原因是Wee1抑制了Cdc2的表达,导致Cdc2的量不足[27]。此外,Wee1蛋白激酶在DNA损伤检查点作用过程中也发挥着关键作用,在芽殖酵母中,需要RAD9基因产物来延迟有丝分裂的进展,以应对DNA损伤。比较DNA损伤造成的有丝分裂延迟和DNA合成抑制引起的延迟,发现DNA损伤造成的有丝分裂延迟需要Wee1蛋白激酶,而DNA合成抑制引起的有丝分裂延迟并不依赖Wee1蛋白激酶[28]。CD44是一种分布于细胞表面的糖蛋白分子,参与细胞与细胞、细胞与基质间的相互作用。透明质酸与其受体CD44结合会抑制细胞凋亡[29],增强肿瘤细胞活力和转移[30],刺激淋巴细胞[31]。有研究表明,CD44可能影响生育能力和卵母细胞的质量[32]。此外在猪卵母细胞成熟过程中,卵丘细胞上CD44的表达与卵丘的扩张存在相关性[33]。TRPS1是一种蛋白编码基因,TRPS1基因的突变或缺失导致为鼻-指(趾)综合征,该基因编码一种具有9个锌指结构域的新型转录因子,其中包括1个单GATA型DNA结合结构域,TRPS1不仅在软骨、关节和毛囊中表达,在小鼠胚胎发育过程中也在肺、肠、肾等其他组织中有表达,TRPS1基因被破坏的小鼠导致其软骨发育不良,其特征是软骨细胞增殖减少和生长板细胞凋亡减少[34]。敲除TRPS1小鼠研究发现TRPS1通过直接与STAT3基因启动子区域的GATA位点结合,通过调节cyclin D1和Bcl-2的表达来调控软骨细胞的增殖和凋亡[35]。这些均表明miR-155在调控细胞分化、增殖、凋亡等生物过程中起关键作用。
本试验成功构建了可以感染水牛卵丘细胞的miRNA-155重组腺病毒载体,过表达miRNA-155基因后,显著下调了Wee1、CD44、TRPS1基因表达量。生物信息学分析发现miR-155主要通过参与MAPK、PI3K-AKT和mTOR等信号通路。本试验为后续探究其在卵丘细胞中的功能提供了理论依据。
