迟缓爱德华菌外膜蛋白FadL原核表达及免疫原性
2020-11-06杜万年马亚娟王笑丹吴同垒史秋梅张志强
王 苗,杜万年,葛 成,刘 晨,马亚娟,王笑丹,吴同垒,史秋梅,张志强
(河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004)
细菌外膜蛋白是革兰阴性菌外膜蛋白成分的总称,是革兰阴性菌重要的屏障结构,其成员蛋白复杂,种类众多,涉及细菌多种生理学功能[1-2]。前期有研究表明细菌外膜蛋白具有优良的免疫原性,其作为免疫原应用能够对特定病原菌感染产生较好的免疫保护效果[3-4]。但外膜蛋白成分复杂,提取工艺较为繁琐,作为商品化疫苗使用还难以实现,从众多外膜蛋白中筛选出具有免疫效力的一种或数种蛋白加以应用是解决这一问题的有效途径。
FadL,又被称为OMP1,是位于革兰阴性细菌外膜表面的门控通道,其主要参与特异性摄取外源性长链脂肪酸,尤其是棕榈酸和油酸,对细菌脂肪酸的生成和耐受至关重要[5]。有研究发现细菌FadL的表达水平直接影响其外膜的完整性,对于细菌的代谢和生存具有重要意义[6]。KROL等[7]研究发现,FadL蛋白参与大肠杆菌AHL信号分子的转运,与大肠杆菌密集感应信号传递密切相关,揭示其具有重要的生物学功能。除此之外,在沙门菌的一项研究中证实,FadL分子具有较强的免疫原性,其作为免疫原免疫小鼠,对沙门菌感染的免疫保护率可达70%[8],揭示了其作为疫苗应用的广泛前景。
迟缓爱德华菌(Edwardsiellatarda,E.tarda)是重要的水产病原且能够感染人,可造成食品卫生安全问题[9],目前已成为水产养殖业的重要顽疾。为设计针对迟缓爱德华菌感染的高效疫苗,本试验拟以该菌的FadL蛋白作为研究对象,通过大肠杆菌系统对该蛋白进行高效表达,利用动物模型评估重组蛋白的免疫原性和疫苗潜力,为迟缓爱德华菌疫苗开发提供参考。
1 材料与方法
1.1 试验材料迟缓爱德华菌ET-CL强毒株分离自秦皇岛某养殖场患病大菱鲆,由河北科技师范学院动物传染病研究室分离、鉴定和保存。6~8 周龄清洁级昆明小鼠,购自中国医学科学院实验动物研究所,试验前在动物隔离器自由采食1周,以适应环境。试验用斑马鱼40尾购自昌黎碣石花鸟鱼市场,体长3~5 cm,试验前于试验环境养殖2周,以适应环境。
限制性内切酶、Taq DNA 聚合酶及T4DNA连接酶均购自TaKaRa(大连)公司;弗氏佐剂购自Sigma公司;His标签抗体、HRP标记山羊抗小鼠IgG二抗、异丙基-β-D-硫代半乳糖苷(IPTG)及蛋白纯化试剂盒购自北京康维世纪生物科技有限公司。
1.2 迟缓爱德华菌fadL基因序列分析根据GenBank登录的迟缓爱德华菌ET-1菌株基因组序列(CP001135.1)设计扩增fadL基因引物。引物P1:5′- ATGCGCCAGAAAAAAATGTTTACTC -3′;引物P2:5′- TTAGAACGCGTAGTTCAGGTTGG-3′。
利用细菌基因组提取试剂盒提取ET-CL菌株基因组,利用P1/P2引物以提取的基因组为模板PCR扩增fadL基因。将fadL基因片段克隆到pMD18-T载体上构建重组载体,送生工生物(上海)有限公司进行序列测定。对FadL蛋白在爱德华菌属成员以及其他肠杆菌科细菌间氨基酸同源性进行分析。
1.3 重组表达载体的构建利用SignalP 3.0软件对FadL蛋白序列进行分析,显示该蛋白含有25个氨基酸残基的信号肽,可能对蛋白表达产生影响,在设计引物时予以切除。表达引物设计如下,P3:5′-CCCAAGCTTGCGCGGGCTTTCAGCTCAATG-AATT-3′,带有Hind Ⅲ酶切位点;P4:5′- CCGCTCGAGTAGTTCAGGTTGGCGCCGTAC-AG -3′,带有XhoⅠ酶切位点。
利用P3/P4引物于重组T载体中扩增出fadL基因,克隆到原核表达载体,构建pET-28α-fadL重组载体,并对重组载体进行PCR、双酶切以及测序验证。
1.4 重组蛋白rFadL原核表达及验证参照文献[10]方法将重组载体转化表达菌株BL21,对重组菌进行诱导培养。利用SDS-PAGE分析目的蛋白判断重组蛋白表达情况,进一步利用Western blot方法加以确认,所用一抗为标签抗体His-MAb(1∶1 000)、二抗为辣根过氧化物酶标记山羊抗小鼠IgG(H+L)抗体(1∶5 000)。
1.5 rFadL的可溶性分析及纯化对rFadL重组表达菌株进行大体积诱导培养,收集菌体,超声破碎,分离上清和沉淀成分,分别制备蛋白样品,利用SDS-PAGE分析重组蛋白在上清和沉淀中的含量,判定蛋白可溶性,以便纯化。rFadL蛋白部分可溶,因此本试验利用康维世纪公司生产的蛋白纯化试剂盒对该蛋白进行纯化,纯化蛋白测定浓度后,分装,-70℃保存。
1.6 重组蛋白rFadL的免疫原性测定参照文献[11-12]方法,将10只健康昆明小鼠随机分成2组,每组5只。以纯化的rFadL蛋白为免疫原免疫小鼠。首免以50 μg弗氏完全佐剂乳化的rFadL皮下注射免疫,间隔2周后二免,30 d加强免疫;二免和三免蛋白用弗氏不完全佐剂免疫。对照组小鼠同样时间点进行3次免疫,注射等体积乳化的 PBS。
建立用于小鼠血清抗体水平测定的间接ELISA方法,最终确定抗原rFadL包被质量浓度为250 μg/L,待检血清稀释倍数为1∶200,37℃孵育1 h;二抗为1∶5 000倍稀释的HRP标记山羊抗小鼠IgG,37℃孵育 30 min;以阴性血清D450 nmx±3s作为阴性、阳性判定标准。在小鼠免疫前后不同时间点眶下窦采血,分离血清,利用间接ELISA检测小鼠血清中特异性抗体水平,绘制抗体水平曲线。
1.7 rFadL对斑马鱼的免疫保护效果测定参照文献[13]方法,将40尾试验用斑马鱼饲养1周以适应环境。将斑马鱼随机分成2组,20尾/组。对试验组斑马鱼肌肉注射50 μg 提纯的rFadL蛋白,间隔14 d同剂量二免;对照组同时间点注射等体积PBS。28 d后分别以迟缓爱德华菌强毒株ET-CL腹腔注射感染斑马鱼,剂量为2 LD50(2×106CFU),连续观察7 d,记录发病和死亡情况,计算相对存活率。
2 结果
2.1fadL基因克隆与序列分析利用PCR方法从迟缓爱德华菌ET-CL菌株中克隆fadL基因,结果显示,在约1 300 bp处扩增出特异性条带,与预期大小(1 317 bp)一致(图1);将扩增出的片段构建到pMD18-T载体上,由生工生物(上海)有限公司测序,测序结果与fadL基因一致,表明成功获得fadL基因片段。进一步对FadL蛋白进行氨基酸同源性分析,结果显示,FadL蛋白在爱德华菌属成员细菌间高度保守,与大肠杆菌、沙门菌、沙雷菌等其他种属细菌也具有较高的同源性(图2)。

图1 PCR扩增迟缓爱德华菌fadL基因 M.DL2000 DNA Marker;1. fadL 基因;2.阴性对照
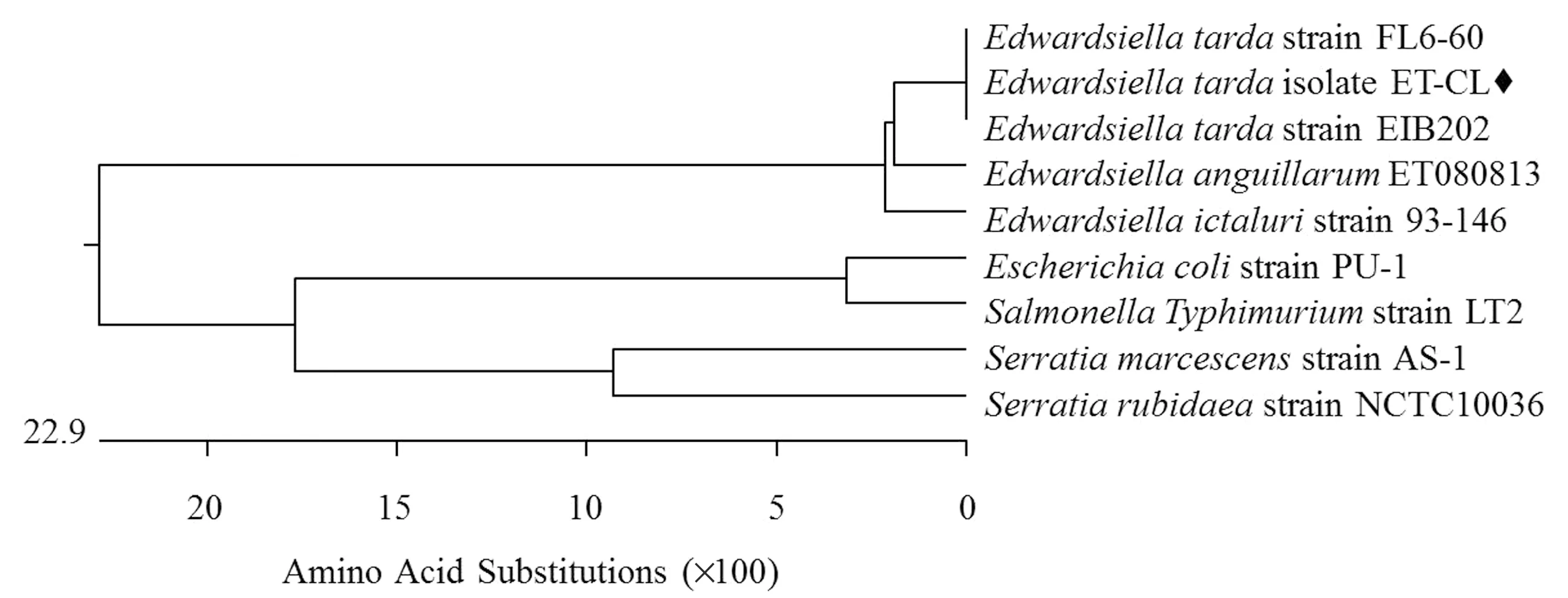
图2 不同菌株fadL基因同源性分析
2.2 重组蛋白rFadL的表达验证将fadL基因构建到表达载体pET-28α上,转化BL21构建重组表达菌株。对重组表达菌株进行诱导培养,利用SDS-PAGE分析蛋白表达情况。结果显示(图3),在45 000 表达出特异性条带,利用Bandscan软件分析rFadL蛋白表达量占细菌总蛋白量的63.7%左右。以His-MAb为一抗、 HRP-IgG为二抗进行Western blot分析,同样于45 000处显现出特异性条带(图4),上述结果表明重组蛋白rFadL成功表达。

图3 SDS-PAGE分析rFadL在大肠杆菌中的表达 M.蛋白Marker;1.pET-28α-fadL/BL21;2.pET-28α/BL21
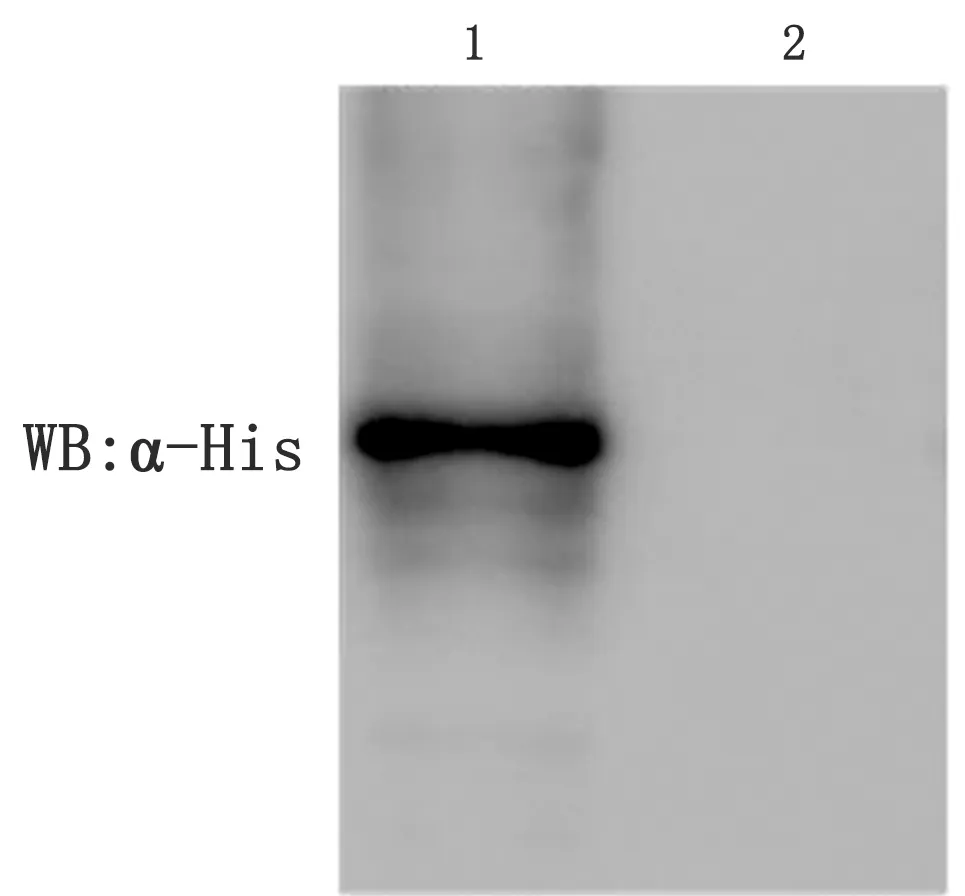
图4 Western blot鉴定rFadL在大肠杆菌中的表达 1.pET-28α-fadL/BL21;2.pET-28α/BL21
2.3 rFadL蛋白的可溶性分析及纯化将重组表达菌株表达产物进行可溶性分析,SDS-PAGE结果显示(图5),rFadL在上清和沉淀中均有表达,为部分可溶表达。利用试剂盒对细菌裂解上清进行纯化,得到纯化的重组蛋白 (图6) ,测定蛋白质量浓度为0.24 g/L。
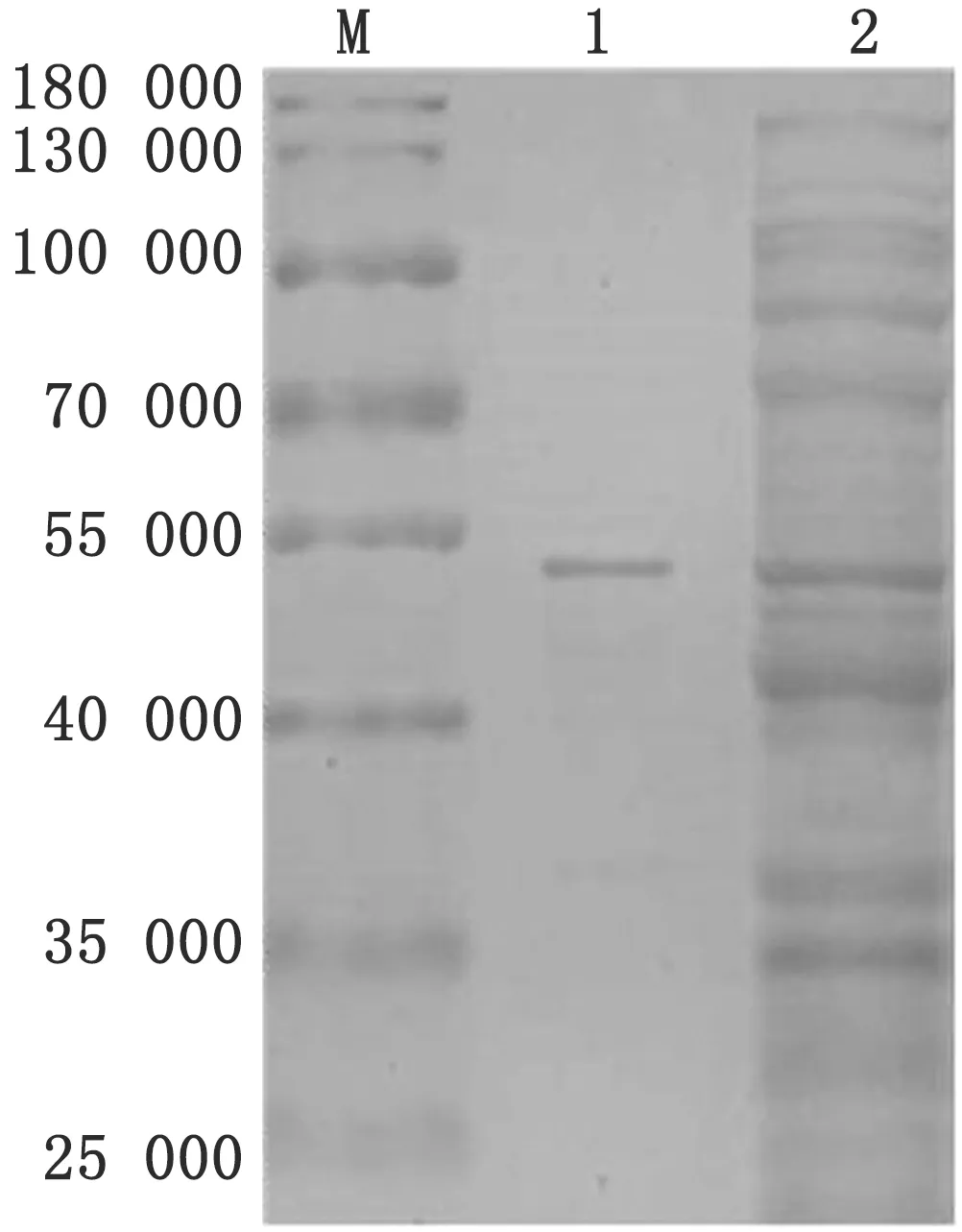
图5 SDS-PAGE分析大肠杆菌表达rFadL的可溶性 M.蛋白Marker;1.菌体裂解物上清;2.菌体裂解物沉淀;3.菌体裂解物图6 SDS-PAGE分析rFadL的纯化效果 M.蛋白Marker;1.纯化蛋白;2.菌体裂解物
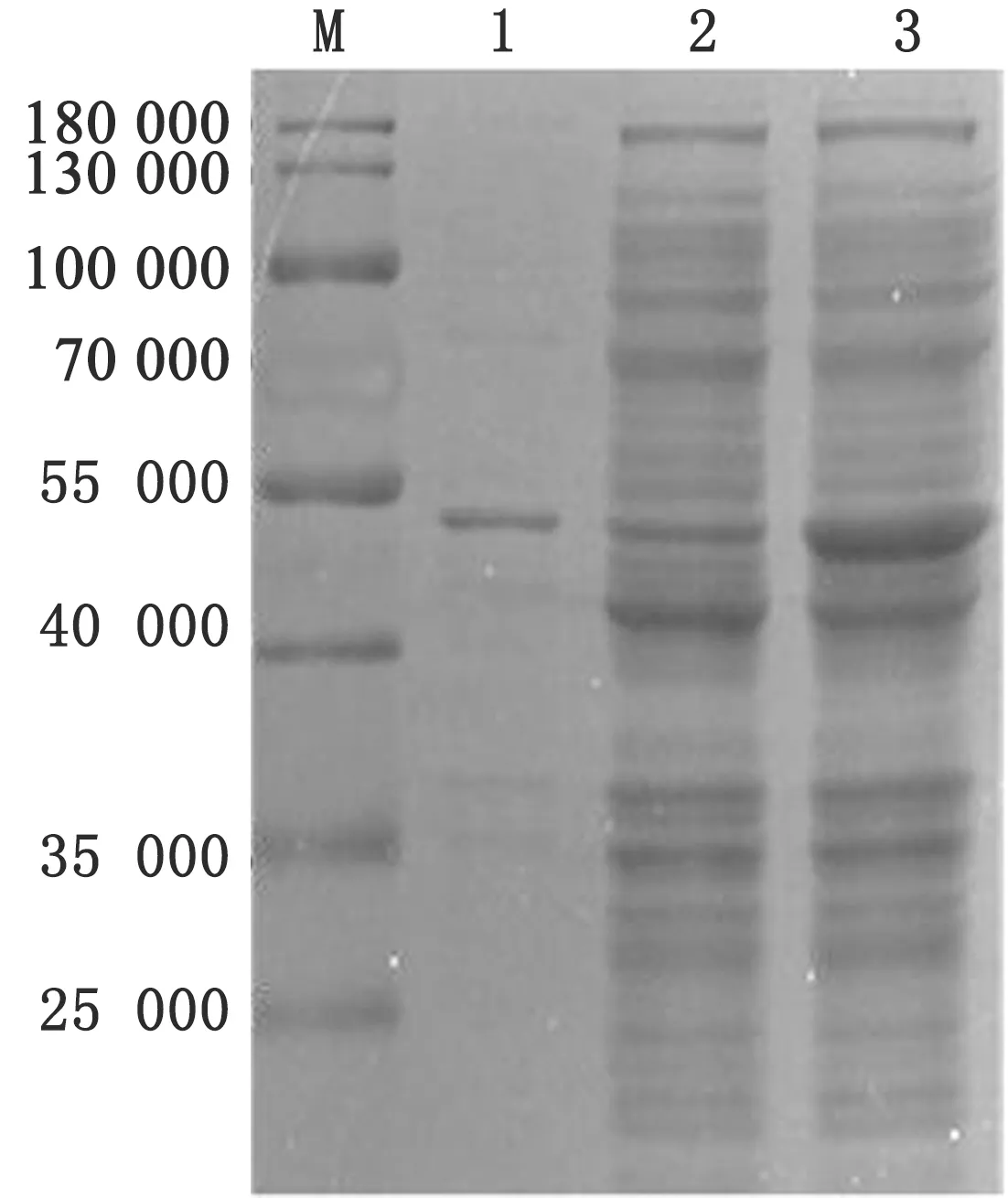
图5 SDS-PAGE分析大肠杆菌表达rFadL的可溶性 M.蛋白Marker;1.菌体裂解物上清;2.菌体裂解物沉淀;3.菌体裂解物
2.4 rFadL的免疫原性测定利用间接ELISA方法测定rFadL免疫后不同时间小鼠血清特异性抗体水平,绘制抗体水平曲线。结果显示,rFadL免疫小鼠后会迅速刺激小鼠产生高水平特异性抗体,随着免疫次数增加和时间延长特异性抗体水平不断提高(图7),表明rFadL重组蛋白具有良好的免疫原性。
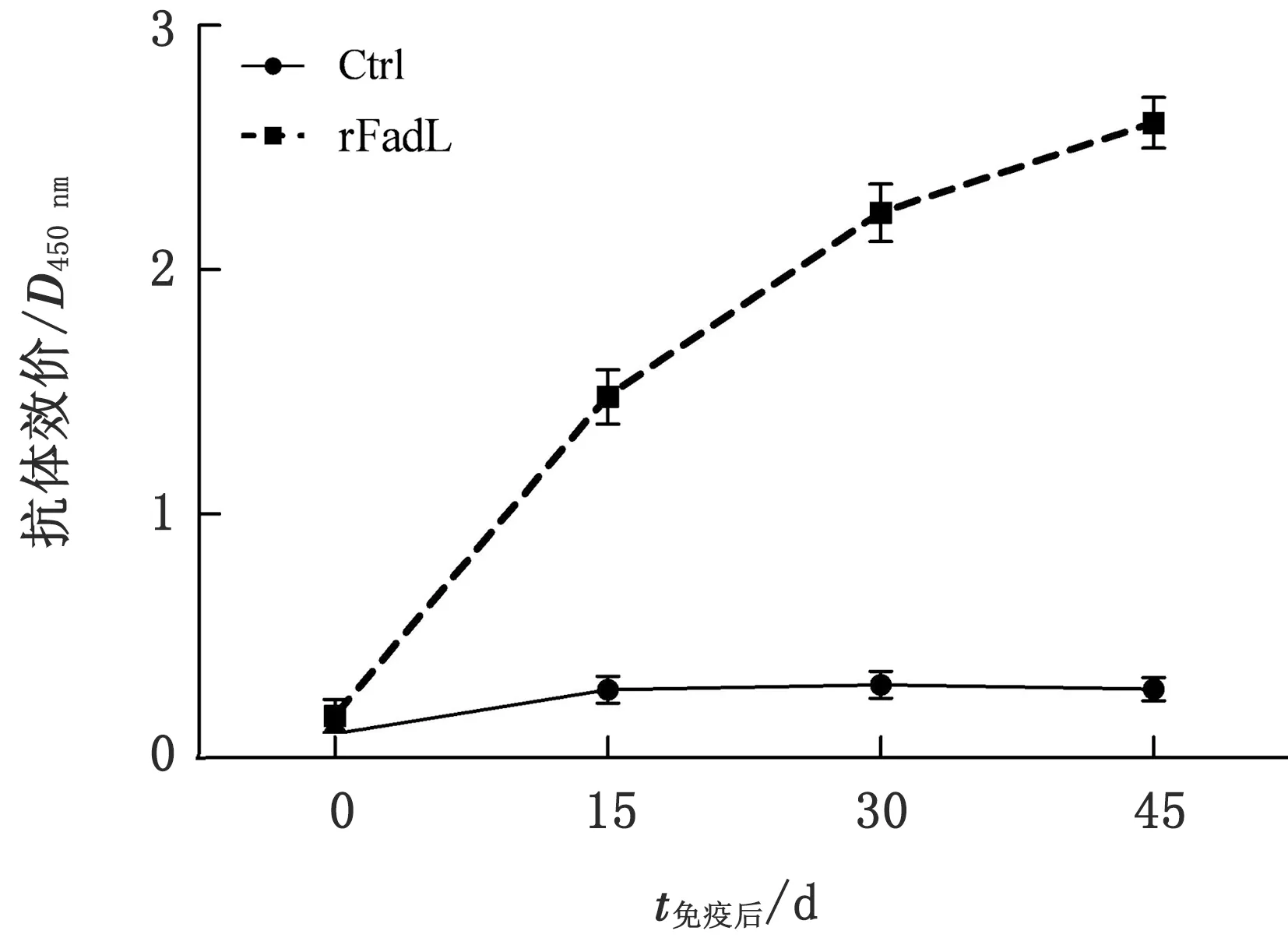
图7 免疫小鼠血清的抗体水平变化
2.5 rFadL对斑马鱼的免疫效果测定以rFadL蛋白免疫斑马鱼,于免疫后28 d腹腔感染ET-CL强毒株,通过统计斑马鱼发病和死亡情况分析rFadL蛋白的免疫效果。结果显示(图8),对照组斑马鱼在接种ET-CL强毒菌后于4 d内陆续死亡,表现为游动缓慢、无力,腹部出血,死亡时间主要为感染后的48 h;rFadL蛋白免疫组斑马鱼也出现部分死亡,死亡症状及外观与对照组相似,但部分斑马鱼短暂表现症状后逐渐恢复,截至168 h(7 d),仍存活11尾,所占比例为55%。结果表明,rFadL蛋白免疫斑马鱼能够对迟缓爱德华菌感染产生一定保护力。
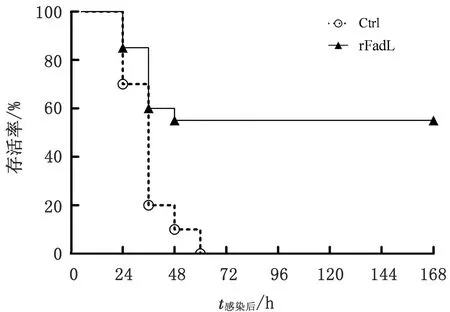
图8 rFadL蛋白对斑马鱼免疫保护力
3 讨论
迟缓爱德华菌作为重要的水产病原,能够造成多种海水和淡水鱼类的脓肿病和败血症,特别是对鲆鲽等经济鱼类的危害尤其巨大,成为困扰水产养殖的重大难题[14]。目前针对该病的治疗仍以抗生素为主,但由于该菌胞内寄生,大部分抗生素无法作用于胞内,给该病的防控带来很大困难[15]。2015年我国首个大菱鲆迟缓爱德华菌疫苗(EIBAV1株)通过农业农村部审核获批一类新兽药证书,给该病防控带来希望。但是迟缓爱德华菌不同菌株间存在较大差异,疫苗的开发仍然任重道远。
在水产疾病防控研究中,利用外膜蛋白作为疫苗用于特定病原的防控已有较多报道[16-17]。鉴于细菌外膜蛋白成分复杂、提取工艺难度大不利于量产和商品化应用,很多研究致力于外膜蛋白有效免疫成分的筛选和应用。在迟缓爱德华菌的研究中,一大批具有免疫保护效果的蛋白被挖掘出来,并在此基础上开展各种类型疫苗的开发[18]。如迟缓爱德华菌OmpA蛋白的免疫保护效果已经得到证实,在此基础开展的核酸疫苗和载体疫苗研制已有报道[19-21]。前期已经筛选到多种蛋白具有免疫原性,如FliC[22]、FlgJ[23]、TolC、PagC、Pili[24]和GroEL等,并用动物模型对其免疫保护力进行初步评估。YANG等[8]研究表明,原核表达系统表达的FadL蛋白能够很好地保护免疫小鼠免受沙门菌的感染,免疫保护率可达70%,效果显著。本试验参照YANG等[8]的报道而锁定FadL蛋白作为研究对象。对FadL蛋白氨基酸序列进行分析结果显示,该蛋白在爱德华菌属成员间高度保守,与沙门菌的同源性高达63.2%,揭示爱德华菌的FadL蛋白也可能具有类似的免疫保护作用,但需要进一步证实。因此本试验对迟缓爱德华菌FadL蛋白进行原核表达并分析其免疫保护效果。选择pET28α载体作用于FadL蛋白,由于该蛋白产生的His融合标签较小,一般不会对表达蛋白的构象和免疫特性产生明显影响。本试验成功表达了重组FadL蛋白,可溶性分析显示,该蛋白在表达菌上清和沉淀中均有分布,为了方便纯化,在做表达菌株大体积诱导培养时,降低了IPTG浓度(0.3 mmol/L)配合低温诱导(30℃)以增加蛋白的可溶性,最终成功获取了纯化的重组蛋白。本试验分别利用小鼠模型和斑马鱼模型评估rFadL蛋白的免疫原性,这是因为迟缓爱德华菌是多种动物共患病原菌,小鼠也是被广泛认可的动物模型;以及在利用间接ELISA方法测定蛋白免疫原性时,所用到的HRP标记山羊抗小鼠二抗为商品化试剂更为容易获得。小鼠试验结果证实rFadL蛋白具有良好的免疫原性。进一步利用斑马鱼模型评估该蛋白的免疫保护力,虽然小鼠可以作为迟缓爱德华菌感染动物模型,但哺乳动物和鱼类免疫系统存在较大差异,小鼠模型难以反映出重组蛋白对鱼类的真实免疫保护效果,因此选用斑马鱼模型对该蛋白的免疫保护力进行评价,结果也证实了rFadL蛋白对斑马鱼感染迟缓爱德华菌具有一定免疫保护力。
本试验以迟缓爱德华菌的FadL蛋白为研究对象,成功获得了其重组蛋白rFadL,并通过动物模型证实rFadL的免疫原性和免疫保护效果,揭示了该蛋白的疫苗潜力,为迟缓爱德华菌疫苗的研究提供了参考。
