湖南省禽白血病病毒分子流行病学调查及env基因序列分析
2020-11-06吕孙良张慧慧胡文琴黎洁玉宋雅婷肖朝庭
吕孙良,张慧慧,胡文琴,黎洁玉,宋雅婷,肖朝庭
(湖南大学 生物学院 病原生物学与免疫学研究所,湖南 长沙 410082)
禽白血病病毒(avian leukosis virus,ALV)属于逆转录病毒科甲型反转录病毒属,是禽白血病的病原,在禽类宿主中能够引起淋巴细胞性白血病、成红细胞性白血病、成髓细胞白血病和髓细胞样白血病等疾病[1]。目前依据病毒的宿主范围、血清中和反应及外部囊膜膜蛋白的特点等分为A~K共11个亚群[2-3],其中ALV-E为内源性ALV,致病性不强,但在感染的后期会对宿主的免疫系统造成破坏,导致其免疫力降低。而ALV-J为外源性ALV,致瘤性及感染能力均强于以ALV-A/B为代表的经典ALV亚群,是ALV目前主要的流行及致病亚群[4]。而ALV-F目前国内外的研究较少,对其致病性及其致病机制的了解甚少。我国有报道在不同时期及地区分离和鉴定出了ALV-E/J[5-7],但对于湖南省内ALV的流行情况鲜有报道。研究表明ALV的env基因决定其宿主范围,且对于致病性的强弱也有很大的影响[8-9]。为了解湖南省内禽类养殖场中ALV的感染情况,本试验对来自21个养殖场的156份组织和血清样品进行RT-PCR检测,并对其中ALV阳性样品的env基因进行克隆测序和分析,以期为湖南省禽类养殖中ALV的防控和净化提供依据。
1 材料与方法
1.1 样品收集及处理被检样品采自湖南省15个地区的21个养殖场,共156份组织/血清样品,-80℃ 保存。样品处理均在生物安全柜内进行。血液样品:真空采血后放置4℃约1 h,待凝血后4 400 r/min离心20 min,取上清备用。组织样品:取约0.1 mg 的肝脏、脾脏等组织,加入无菌无酶的细胞培养基(DMEM)0.8 mL,研磨后4℃、12 000 r/min 离心10 min,取上清备用。
1.2 主要试剂病毒基因组DNA/RNA提取试剂盒、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;反转录试剂盒、Taq DNA聚合酶购自Thermo Fisher公司;T4DNA连接酶、pMD19-T载体购自TaKaRa公司;感受态细胞、核酸Marker购自擎科生物技术有限公司。
1.3 引物设计及合成从GenBank下载了52条ALV全基因组代表序列(包含ALV-A~ALV-J群),利用DNAMAN进行序列比对,在序列保守区采用Primer Premier 6设计引物(设计引物采用的模板序列为HPRS103株,GenBank登录号为Z46390),设计好的引物由擎科生物技术有限公司合成。检测引物(包括5′UTR的3′端283个碱基和Gag基因5′端32碱基),ALV-DF:5′-TCATTTGGTGACCCCGACGTGAT-3′,ALV-DR:5′-GCGGACGA-AATCACCTTTATGACG-3′,目的片段大小为314 bp;env基因扩增引物(除5′端的18 碱基外,覆盖env基因全长),ALV-En-DF:5′-GAGGTGACTAAGAAAGATGAGGCGAG-3′,ALV-En-DR:5′-CCATCAACCCAGGTGCACACCAAT-3′,目的片段大小为2 525 bp(不同毒株间大小有差异)。
1.4 样品的RT-PCR扩增参照病毒基因组DNA/RNA提取试剂盒提取已处理的血清及组织样品中的ALV基因组,-80℃保存备用;按反转录试剂盒说明书将病毒基因组反转录为cDNA,-20℃ 保存备用。取1 μL cDNA利用ALV-DF/ALV-DR进行PCR扩增,反应条件:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,35个循环;72℃ 5 min。
1.5env基因的测序及分析阳性样品再取1 μL cDNA进一步用ALV-En-DF/ALV-En-DR扩增env基因,PCR反应条件:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。将PCR产物用琼脂糖凝胶DNA回收试剂盒纯化,4℃过夜,连接pMD19-T载体,随后转入到DH5α感受态中涂板培养,选菌液PCR阳性克隆送擎科生物有限公司测序。利用MEGA7.0、DNAMAN软件对所获得序列进行核酸和氨基酸序列分析并构建其系统发育树,采用RDP4软件对可能发生重组的序列进行重组分析。
2 结果
2.1 样品RT-PCR检测结果用检测引物ALV-DF/ALV-DR对来自15个地区(21个养殖场)的156份组织/血清样品进行检测,其中20个养殖场均检测出ALV(图1),场阳性率为95.24%(20/21),总体送检样品中ALV的PCR阳性率为72.44%(113/156)。初步表明ALV的感染在湖南省禽养殖场中较为严重。

图1 ALV检测引物RT-PCR扩增结果 M.DL2000 DNA Marker;1~8.送检样品的扩增产物;9.阴性对照
2.2env基因扩增与序列分析对检测出ALV的阳性样品选取部分样品用ALV-En-DF/ALV-En-DR引物扩增其env基因(图2),测序后,通过序列比对及系统进化分析。结果显示 ALV-E的场检出率为90.48%(19/21);ALV-J的场检出率为4.76%(1/21);表明ALV-E在养殖场中普遍存在,只有少数养殖场感染ALV-J。

图2 ALV env基因扩增引物扩增结果 M.DL10000 DNA Marker;1~5.送检样品的扩增产物;6.阴性对照
系统进化分析结果发现,在1个野鸡养殖场的5个送检样品中检测出了1株ALV-F (XTLI18100214),2株ALV(XTLI18100110和XTLI18100209),因其env基因与其他ALV亚群差异较大(图3),暂时无法归类,可能为一种新的ALV亚群。其余序列均归为内源性的ALV-E亚群,其env基因与已发表的内源性env基因核苷酸序列同源性为99.38%~99.90%。值得注意的是XTLI18100209及XTLI18100214是从同一份样品中鉴定出来,但两者env基因核苷酸序列相似度仅为58.60%,表明该养殖场存在ALV混合感染的情况。另外XXYI181104及XXYI101101也是从同一份肉鸡的样品中鉴定出来的2株ALV,但XXYI101101属于ALV-E,而XXYI181104属于ALV-J,也表明该养殖场存在ALV混合感染的情况。

图3 本试验检测出的ALV与其他ALV亚群参考株之间env基因核苷酸序列进化树分析(▲标记的ALV序列由本试验测得)
2.3env基因推导的氨基酸序列分析
2.3.1XXYI181104株env基因推导的氨基酸序列分析 本试验中XXYI181104株扩增的env基因的ORF长度为1 689 bp,编码562个氨基酸,与GenBank中其他ALV-J株相比其氨基酸同源性为87.96%~92.63%。XXYI181104株有一些独特的氨基酸突变位点,如A27T、V55A、PL110SP、T122A、T170A、S181T,其中T170A和S181T突变位于gp85基因中的高变区1(hr1),但其余突变既不位于高变区,也不位于可变区(vr)(图4)[8]。另外A27T是由非极性氨基酸突变为极性氨基酸,而T122A、T170A由极性氨基酸突变为非极性氨基酸。这些位点的改变可能会对gp85基因编码的多肽的空间构象产生一定的影响,但是否会发生功能改变还有待进一步研究。

图4 XXYI181104株env基因推导的氨基酸部分突变位点 阴影部分指示位置为突变位点;可变区(vr);高变区(hr);“.”表示缺失;“-”表示相同
2.3.2XTLI18100110/209/214共3株env基因推导的氨基酸序列分析 本试验中XTLI18100110/209/214共3株所扩增的env基因的ORF长度分别为1 689,1 689,1 869 bp,编码562,562,622个氨基酸。其中XTLI18100214与ALV-F(AY608692株)的env基因推导的氨基酸同源性为88.69%,未发现有缺失或插入突变,系统进化分析中归为ALV-F亚群(图3,图5A)。
而XTLI18100110与XTLI18100209株env基因推导的氨基酸之间的同源性为96.84%,但二者与其他ALV亚群的env基因推导的氨基酸同源性仅为44.68%~58.42%(表1),表明这2株ALV很可能是新的亚群。另外以与其同源性最高的ALV-J亚型(HPRS103)作为参考株,可以发现这2株ALV的env基因推导的氨基酸序列均有多处缺失或突变(图5B)。
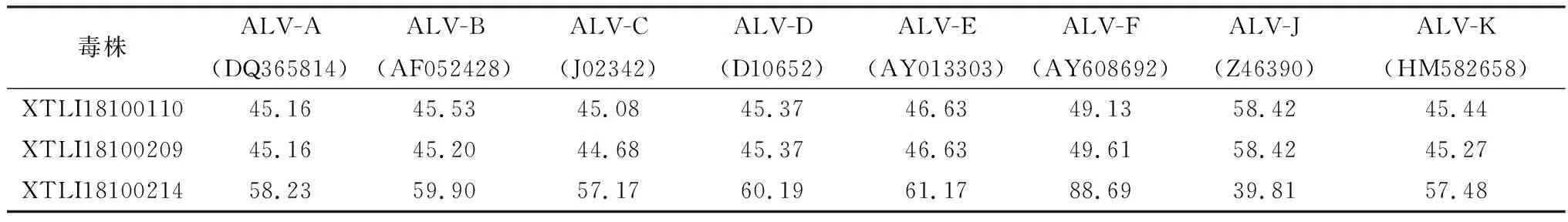
表1 XTLI18100110/209/214株与其他ALV亚群参考株env基因核苷酸同源性 %

图5 XTLI18100214与ALV-F(AY608692株)(A)及XTLI18100110/209与ALV-J(Z46390株)(B)env基因推导的氨基酸比对结果 (“.”表示缺失;“-”表示相同)
2.3.3XTLI18100110/209/214株env基因的重组分析 本试验系统进化分析显示XTLI18100214株属于F型,XTLI18100110和XTLI18100209株与J型关系较近,由于重组易导致新型病毒的出现,因此利用RDP4软件对这3个序列进行了重组分析,结果显示,XTLI18100110/209这2株的env基因均有可能发生过重组,XTLI18100214株可能因为参考序列较少没有检出重组事件。根据已知的序列,XTLI18100110/209株的重组母本为ALV-J/SD13QJ02/China和AY608692 ALV-F/USA,重组位点在env基因核苷酸序列中启动子的下游+241及+1 655附近(图6),说明重组事件发生在env基因内部。

图6 XTLI18100110/209株env基因重组分析(箭头指示可能的重组位点)
3 讨论
目前有研究表明,ALV以水平传播及垂直传播的方式在鸡群内进行传播,而垂直传播是各类ALV传染的主要途径[10]。ALV-E属于内源性ALV,致病性虽然不强,但在鸡发育的后期会导致免疫功能下降,使其患病风险上升,并会造成对其他外源性ALV的免疫耐受。有报道在某地方品种的鸡群中发现ALV-E的阳性率高达93.33%[11],说明ALV-E在国内的鸡群中可能是普遍存在的。而ALV-J则是高致病性的外源性ALV,潜伏期较短,从数天到数周不等,主要靶向骨髓细胞,可以引起骨髓细胞瘤。在ALV-J被发现前,我国本地的鸡群可能也存在有ALV的几类经典亚群,但由于其危害较小,一直未引起重视。但ALV-J在全球范围内暴发后,我国因为引种不当,在国内各地各品种的肉鸡及蛋鸡也都相继发现了ALV-J的感染[12-13]。而近几年国内ALV-J的流行病学调查发现,ALV-J的阳性率在10%左右[14-15],部分地区甚至高达55.2%[16]。马美哥等[17]新近发现的一起进口白羽肉种鸡禽白血病疫情的主要病原也是ALV-J。因此对于ALV-J及其他ALV亚群的流行病学调查具有重要的意义。
本试验首次对湖南省禽类养殖场ALV的感染情况进行了初步检测和调查,结果表明,各地养殖场中ALV的感染情况比较普遍,调查中的21个养殖场中有19个场检测出ALV-E,1个场检测出ALV-J,另外还在1个野鸡养殖场中检测出ALV-F及2株很可能是新亚群的ALV。此外在检测出ALV-J的样品中还发现了ALV-E,而ALV-F和新亚群ALV也是在同一样品中检测出,均说明这2个养殖场存在不同亚型ALV混合感染的情况。另外通过重组分析发现,在野鸡中检测出的XTLI18100209和XTLI18100110株很可能是由ALV-E及ALV-J重组形成的新亚群。另外,本试验对于内源性ALV的检测,虽然采用的是RT-PCR方法,但没有去除鸡基因组DNA,不能排除鸡基因组内源性E群env基因片段的扩增。
本试验首次调查了湖南省禽类养殖场ALV的感染情况,对于今后该省ALV的防控和净化具有一定参考价值。另外,首次在国内养殖的野鸡中发现的ALV-F以及属于新的ALV亚群的2株病毒的致病性及其传染给家鸡风险评估等有待进一步研究。
