兔感染戊型肝炎病毒(HEV)对兔出血综合征(RHD)疫苗免疫效果的影响
2020-11-06金明兰郝心瑞李华南杜志威徐莹莹董莉莉薛洪海孙世梅王悦红金宁一
金明兰,王 欢,郝心瑞,李华南,杜志威,徐莹莹,董莉莉,薛洪海,孙世梅,李 明,王悦红,金宁一
(1.吉林建筑大学 松辽流域水环境教育部重点实验室,吉林 长春 130118;2.山东大学 化学与化工学院,山东 济南 250100;3.军事医学科学院 军事兽医研究所,吉林 长春 130122)
兔出血性症(RHD)是由兔出血性综合征病毒(RHDV)引起的高度接触传染性、急性致死性传染病,其发病率和致死率都很高,给养兔业造成了极大的危害。目前使用的组织灭活疫苗可有效地预防和控制疫情的发生和流行,起到了良好的保护作用[1]。如果在未知兔感染其他疾病的情况下,接种疫苗是否会对机体的免疫效果产生一定的影响还未见报道。
戊型肝炎(hepatitis,HE)是由戊型肝炎病毒(hepatitis virus,HEV)引起的一种经粪-口途径传播的急性传染病,人感染HEV表现为急性黄疸型肝炎,严重危害人类健康[2-3]。HE病死率较高,与其他类型的病毒性肝炎相比呈现逐年上升趋势,且出现多种属动物感染的现象[4-5]。近年来,我国多地陆续报道野生兔、养殖兔感染HEV,并在体内分离出病毒粒子[6-8]。MENG等[9]首次从猪体内分离出HEV。蒋磊等[10]建立了HEV感染树鼩的动物模型,并对感染途径、感染剂量等进行了初步的研究。BEGUM等[11]在感染HEV的患者体内分离到1株HEV,通过同源性分析认为与其食用野猪肉内分离的HEV为同一病毒;ZHANG等[12]研究表明兔感染HEV导致肝脏损伤、在体内残留时间长。但是,国内外未见评估动物机体在感染HEV后是否影响免疫水平的研究。因此,本试验以某兔养殖场为研究对象,对未知感染HEV的兔接种RHDV疫苗,通过检测免疫前、后产生的RHDV体液免疫水平、细胞免疫水平、丙氨酸转氨酶(ALT)、HEV特异性抗体水平,为进一步探究机体感染病原体后对免疫效果影响的研究提供参考。
1 材料与方法
1.1 材料RHDV 疫苗、抗体检测试剂盒购自南京生物制品有限公司;DNA 提取试剂盒购自TIANGEN;Ex Taq DNA聚合酶、DL2000 DNA Marker、DNA 回收试剂盒、感受态细胞购自生工生物工程(上海)股份有限公司;ALT、IL-2和IL-4试剂盒购自上海江莱生物工程公司。
1.2 实验动物某养殖户饲养的新西兰大白兔2 批次,第1批次为18月龄兔80只,随机选取10只接种PBS 2 mL/只,作为阴性对照;70只接种RHDV疫苗2 mL/只,作为疫苗接种阳性对照。第2批次为5月龄兔260只,其中250只接种疫苗2 mL/只,10只接种PBS 2 mL/只,作为阴性对照。分别经皮下多点注射灭活疫苗、PBS,于免疫前、后1~ 4 周采血,每周采血1次后进行抗体检测,评估RHDV免疫效果。一免后5周进行二免,接种剂量、接种途径与一免相同。
1.3 血清样品的制备分别在免疫前、后1~4 周,每周采血1次,采集心脏血液4 mL/只,4℃放置1 h后,1 000 r/min离心10 min,分离血清,-80℃保存。
1.4 特异性抗体、ALT的检测将RHDV标准抗原4℃过夜包被ELISA板并编号。经加入封闭、免疫血清、辣根过氧化物酶标记的抗体、显色溶液OPD、终止液后,测定各孔D450 nm值。所得数据以x±sx表示,并进行统计学分析。用同样方法,将分离的血清加入到96孔板中、编号,稀释血清后加入HEV标准抗原,室温放置约20 min,测定各孔D450 nm值,进行统计学分析。
按照说明书的操作方法,将浓缩液倍比稀释后加入到96孔板中,设立标准品重复、编号,依次加入封闭液、显色液、终止液后,测定各孔D450 nm值。所得数据以x±sx表示,并进行统计学分析。
1.5 分离外周血淋巴细胞取无菌抗凝血1份,加入等体积的Hank's液混匀,2 000 r/min离心10 min,收集界面上的细胞;再以1 500 r/min 离心10 min,弃上清液,加入无菌NH4Cl·Tris溶液;1 500 r/min 离心后弃上清液,加入5 mL Hank's液混匀,1 000 r/min 离心后弃上清液,制备外周血淋巴细胞悬液,加入10% RPMI-1640混匀后,用PBS液10倍稀释后进行细胞计数[13]。
1.6 T淋巴细胞转化试验将制备的淋巴细胞悬液的细胞密度调整为1×106/mL,将100 μL细胞液与等量的刀豆蛋白A(ConA)、RHDV、PBS加入96孔板中,于37℃、5% CO2培养箱内孵育40 h左右,加入10 μL WST,用酶标仪进行淋巴细胞刺激指数(SI)检测。具体操作参照文献[14]方法进行。
1.7 IL-2和IFN-γ的检测在二免后10 d,分离外周血淋巴细胞,按照说明书的操作方法进行IL-2检测[15]。检测各孔的D450 nm值,进行统计学分析。以同样方法进行IFN-γ检测,进行统计学分析。
受上述工作启发,本文针对802.11n长距离链路研究了MAC层数据包的出错模式,并针对性的设计了FEC编码算法AdaCode.全面考虑了数据包丢失和部分出错的情况,将帧间编码和帧内编码相结合,能有效提高数据包的纠错能力.
1.8 HEV基因检测将兔接种疫苗后7,14 d各宰杀3只,无菌采集脏器,-20℃保存待测。参照文献[16]的方法进行HEV引物设计,按照DNA试剂盒说明书提取样品中的DNA,进行目的基因扩增、琼脂糖凝胶电泳检测。
1.9 统计分析有样本重复的试验,数据按x±s表示,并采用统计分析软件SPSS 11.0的广义线性模式(General Linear Models)的单变量分析(Univariate)模块对获得的数据进行配对t检验。
2 结果
2.1 实验动物情况第1批次兔在接种疫苗后1 d有3只兔出现精神萎靡、厌食等症状,3 d后恢复正常。第2批次兔接种RHDV疫苗后,部分动物出现精神萎靡、采食、饮水量降低、腹泻等症状,持续10 d;剖检重症兔可见肝脏肿大、出血、坏死,但未出现死亡。
2.2 特异性RHDV抗体水平的检测2个批次兔接种RHDV疫苗1周后抗体开始上升, 2~4周出现持续增长的趋势。而第2批次兔抗体水平增长幅度不高,其抗体水平略高于对照组和免疫前,远远低于以往同期免疫后产生的抗体水平。第1批次兔在整个试验期间所检测到的抗体水平显著高于第2批次(图1)。
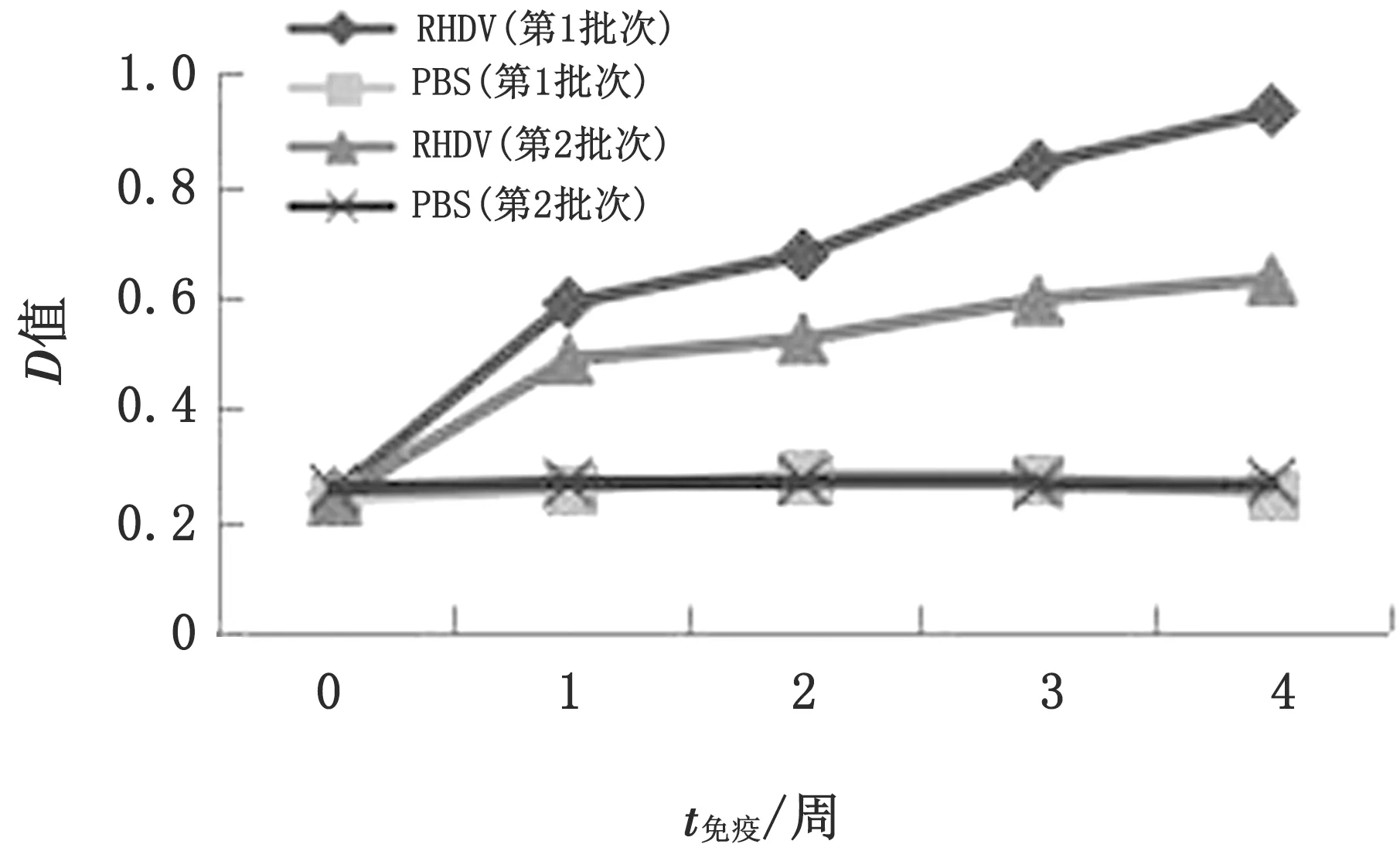
图1 特异性RHDV抗体水平的检测结果
2.3 淋巴细胞转化试验2个批次兔在二免3周后分离外周血淋巴细胞,分别用ConA和RHDV刺激下进行淋巴细胞转化试验。由图2可见,第1批次疫苗接种组SI最高,第2批次疫苗接种组SI较低,但高于PBS对照组,差异不显著(P>0.05)。
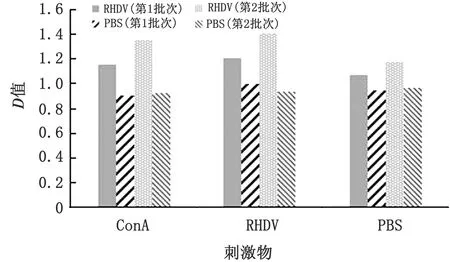
图2 淋巴细胞转化结果
2.4 IL-2 检测免疫兔外周血中IL-2的检测结果如图3所示。第1批次接种疫苗兔血清中IL-2 含量最高,显著高于PBS对照组和第2批次兔。第2批次免疫兔的血清中IL-2含量略高于PBS对照组,但差异不显著。结果显示,接种疫苗后未能有效刺激机体分泌细胞因子,需继续监测第2批次兔IL-2水平,分析干扰因素,防止感染疫病。
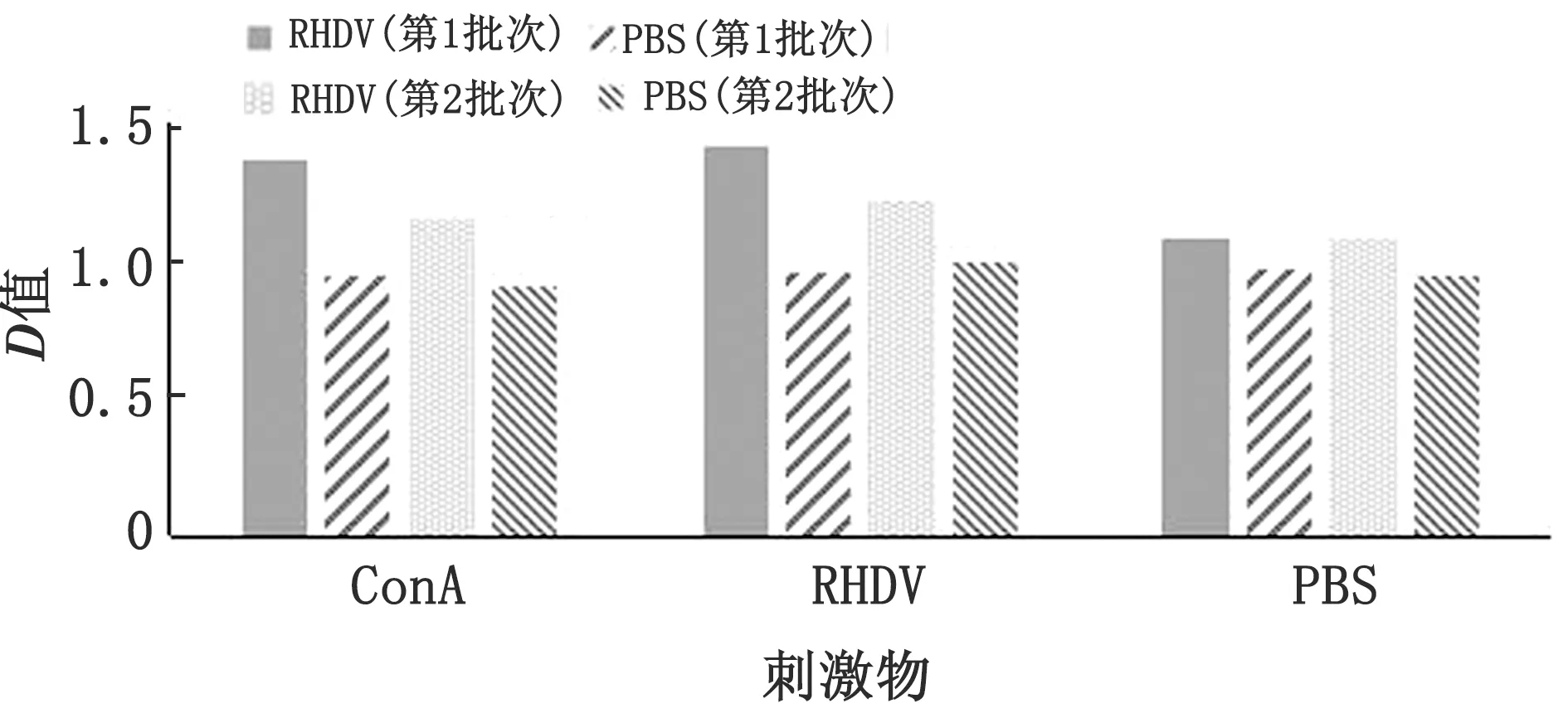
图3 IL-2的检测结果
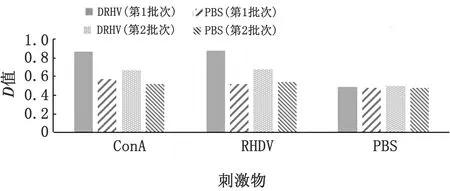
图4 IFN-γ的检测结果
2.6 ALT检测第1批次家兔在接种疫苗期间未出现显著变化,虽然接种疫苗后ALT的含量有所增加,但未达到临床判定阳性的标准。第2批次家兔在接种RHD疫苗后7 d ALT开始升高,14 d 持续上升,在28 d高达70 U/L,已达到临床判定阳性的标准(图5)。

图5 接种疫苗后ALT的变化结果
2.7 HEV抗体检测第1批次兔在整个检测期间未检测到HEV抗体,与接种PBS组的抗体水平相同;而第2批次兔在疫苗接种7,14,21,28 d后,HEV抗体在7 d升高,在14 d开始下降,在28 d下降明显(图6)。

图6 HEV抗体水平的检测结果
2.8 HEV在动物体内残留的检测第2批次饲养家兔在接种RHDV后7,14 d,在肝脏中检测到HEV的基因,而21 d未检测到病毒的基因。由于HEV缺乏有效的细胞培养系统,对HEV鉴定只能通过基因检测的方法进行。第1批次饲养家兔在接种RHDV后7,14,21 d均未检测到病毒的基因。研究表明,HEV在兔肝脏中含量最高,如果在肝脏中未检测到病毒基因,推测在兔体内未残留病毒基因。因此,为减少经济损失,在接种疫苗28 d后,未继续进行动物体内HEV基因检测,默认为HEV在动物体内残留结果为肝脏组织残留结果。
3 讨论
为有效地预防和控制动物疫病的传播及流行,临床上常采用接种疫苗的方法,诱导机体产生免疫反应,保护机体健康[17]。RHDV是我国最早研制的疫苗,在国内养殖场得到广泛应用,临床效果十分显著[18]。但是,在机体受到外界病原体、应激反应、噪声、高温等因素干扰时,其对机体的神经系统、免疫系统、生殖系统、血液系统等的功能会造成不同程度的影响。因此,在接种疫苗后定期监测抗体水平有利于预防疾病和筛选干扰因素。本试验通过监测细胞免疫水平、体液免疫水平,发现接种疫苗后抗体产生的水平不高,结合临床症状,推断机体可能受到病原体的干扰所致,而开展了HEV检测。
HEV可感染多种动物,且多数动物呈现亚临床症状,是一种人兽共患病原体[19]。GENG等[20]研究表明,猪是HEV感染率最高的动物,其抗体阳性率高达100%,且MENG等[21]首次从猪体内分离到HEV,认为猪携带HEV是其他动物感染的主要来源。由于猪携带HEV是一种隐性感染,其携带HEV传播给人和其他动物的风险远高于人群内部传播。ZHAO等[22]在甘肃省某兔养殖场中检测出HEV抗体阳性率较高。有研究表明[23],在家兔、野兔中均分离出HEV,检测HEV抗体阳性率较高,证明兔可能是一种新的HEV易感动物宿主。因此,预防和控制兔疫病应密切关注HEV感染所带来的巨大威胁。
本试验中,第2批次兔接种RHDV疫苗后抗体产生的水平不高,显著低于第1批次兔产生的抗体水平,但是仍高于疫苗接种前和PBS对照组的水平,证明机体只是受到某些因素的干扰。因此,结合临床症状、剖检变化,进行了细胞免疫水平、HEV抗体、病毒基因检测。结果显示,兔体HEV抗体阳性;ALT水平高于正常指标;体内检测到HEV病毒基因,表明机体受到HEV感染。动物体内的IL-2和IFN-γ 均较低,再次表明兔感染HEV后在一定程度上影响动物体液免疫和细胞免疫效果。机体在受到外界干扰时,干扰因素的类型、强度、季节、动物种类、动物日龄等对机体生殖功能、免疫功能等的影响也存在差别。HUANG等[24]的研究结果表明,HEV毒株来源、基因型、病毒毒力、接种途径、宿主种类、宿主年龄均是疫病感染及流行的主要原因。MENG等[25]分别将3型人HEV和 3型猪HEV接种SPF猪,结果显示3型人HEV导致SPF猪出现厌食、体温升高等症状,肝脏损伤较为严重,表明不同动物、不同基因型HEV、相同基因型的不同毒株对动物机体感染力也存在较大差异。
本试验中,第2批次兔受到HEV的感染,对RHDV的细胞免疫和体液免疫造成一定的影响,但动物未表现出明显的临床症状,更未出现大批死亡,可能与感染HEV毒力、毒株等因素有关。
