lncRNA NNT-AS1对卵巢癌细胞增殖、凋亡和侵袭的作用
2020-11-06顾中亮尉春艳
顾中亮,尉春艳
(西安交通大学第二附属医院妇产科,西安 710004;*通讯作者,E-mail:weichy1023@163.com)
流行病学调查显示,全球每年约20万女性罹患卵巢癌,约12.5万死亡[1]。据2018年统计资料可知,2008-2018年卵巢癌患者死亡率始终处于较高水平,且五年生存率无明显改善[2]。卵巢癌作为临床最常见的女性恶性生殖系统肿瘤,因早期多无明显临床症状,且缺乏有效可行的筛查及检出方法,导致多数患者确诊时已处晚期,因此丧失了最佳治疗机会[3,4]。研究表明,早期卵巢癌患者5年生存期超过90%[5],故早期诊断和治疗对提高存活率尤为重要。
长链非编码RNA(long non-coding RNA,lncRNA)作为竞争性内源RNA,在肿瘤发生、发展中发挥着癌基因或抑癌基因的作用,并参与肿瘤细胞的增殖、迁移、侵袭、凋亡和耐药等过程[4,6,7]。烟酰胺核苷酸反义转氢酶RNA1(nicotinamide nucleotide transhydrogenase-antisense RNA1,NNT-AS1)作为新发现的lncRNA,可影响细胞的增殖、转移、凋亡等,在消化系统和女性生殖系统恶性肿瘤中均有特异性异常表达[8],在消化系统肿瘤、宫颈癌等多种肿瘤中均呈高表达,但在某些肿瘤中却呈低表达[9,10]。Wang等[11]研究表明,NNT-AS1在大肠癌患者中高表达,且与经淋巴结的转移、血管的浸润及分化密切相关。然而,NNT-AS1在卵巢癌中的表达情况以及对卵巢癌的作用尚未完全清楚,因此,本研究通过对NNT-AS1在卵巢癌细胞增殖、侵袭及凋亡中的作用进行研究,以期为卵巢癌的早期诊断及治疗提供一定的理论依据,具体研究如下。
1 资料与方法
1.1 细胞与试剂耗材
正常人卵巢上皮细胞系T29、人卵巢癌细胞系HO-8910及SK-OV-3(购自中国科学院上海生命科学研究院细胞库);胎牛血清[Gibco,赛默飞世尔科技(中国)有限公司,上海],Trizol总RNA抽提试剂盒、Lipofectamine 2000、流式细胞试剂[Invitrogen,赛默飞世尔科技(中国)有限公司,上海],逆转录试剂盒、荧光定量PCR试剂盒[Takara,Takara Biomedical Technology(Beijing) Co.,Ltd.,北京],MTT试剂盒[Promega(Beijing) Biotech Co.,Ltd.,北京],caspase-3及caspase-9活性检测试剂盒(Bioss,北京博奥森生物技术有限公司,北京);细胞培养基、Transwell相关耗材均购自杭州诺扬生物技术有限公司。
1.2 方法
为研究卵巢癌细胞中NNT-AS1的表达情况并探索NNT-AS1对卵巢癌细胞增殖、凋亡及转移的影响以及可能的作用机制,首先使用qRT-PCR检测卵巢癌HO-8910、SK-OV-3细胞NNT-AS1表达情况并比较其与正常人卵巢上皮细胞系T29的差异,随后将卵巢癌HO-8910、SK-OV-3细胞分别分为siNNT-AS1组(NNT-AS1沉默组)、siNC组(阴性对照组)和control组(对照组),siNNT-AS1组和siNC组分别转染NNT-AS1沉默质粒siNNT-AS1和阴性对照质粒siNC,control组给予空载体,72 h后验证转染情况,并分采用MTT法检测细胞增殖活性、流式细胞术检测细胞凋亡、Transwell实验检测细胞侵袭能力,采用比色法检测caspase-3、caspase-9活力。
1.2.1 细胞培养、转染 将T29、HO-8910、SK-OV-3细胞系置于内含10%胎牛血清、1%链霉素的Eagle培养基内,5%CO2培养箱内培养至密度高于80%后,进行基因转染或检测。
1.2.2 qRT-PCR检测NNT-AS1表达情况 采用Trizol试剂盒提取各组细胞总RNA,设计引物序列见表1,随后按照说明进行逆转录并采用qRT-PCR检测NNT-AS1表达情况[12],随后使用2-ΔΔCt法计算相对表达量。
1.2.3 NNT-AS1基因沉默 HO-8910、SK-OV-3细胞分别分为siNNT-AS1组、siNC组和control组。siNNT-AS1组、siNC组分别采用Lipofectamine 2000转染siNNT-AS1(5′-GCAGGAGAGUAGCCAAGUCCA-3′)和siNC(5′-CUAGAUGCCAGUGUCCAGGGA-3′),control组仅加入空载体。质粒由上海基因制药有限公司设计构建。转染72 h后采用qRT-PCR检测两种细胞系NNT-AS1表达情况以验证基因沉默效果,并进行MTT实验、流式细胞术、Transwell实验以及caspase-3和caspase-9活性检测。
1.2.4 MTT法检测细胞增殖活性 将处于对数生长期的HO-8910、SK-OV-3细胞分别制成单细胞悬液后,接种至96孔板(5×103/孔),按说明书加入MTT溶液后继续培养,随后分别在24,48,72 h时更换为150 μl/孔DMSO后,测490 nm处吸光度值(OD490 nm)并绘制生长曲线。
1.2.5 流式细胞术检测细胞凋亡 将HO-8910、SK-OV-3细胞分别消化并PBS洗涤,Binding Buffer制备1×106/ml重悬液,加入内含5 μl PI及Annexin Ⅴ-藻蓝蛋白的100 μl的染色缓冲液中并避光孵育后,使用流式细胞仪检测Annexin Ⅴ阳性的凋亡细胞。
1.2.6 Transwell实验检测细胞侵袭能力 收集HO-8910、SK-OV-3细胞后分别接种(1×106/ml)于小室内,37 ℃培养24 h后,1%多聚甲醛固定后结晶紫染色,显微镜下取9个随机视野计膜下细胞数平均值。
1.2.7 比色法、检测caspase-3、caspase-9活性 按试剂盒说明,消化并PBS洗涤后,裂解液裂解,10 000 r/min离心1 min取上清,检测蛋白浓度(3 μg/μl)后加入混有缓冲液的96孔板内,37 ℃孵育4 h后测405 nm处吸光度值(OD405)。单位蛋白中酶活性=OD405÷蛋白浓度。
1.3 统计学分析

2 结果
2.1 正常卵巢细胞及卵巢癌细胞NNT-AS1表达情况
卵巢癌HO-8910、SK-OV-3细胞系中的NNT-AS1相对表达量均显著低于正常卵巢细胞系T29,差异均有统计学意义(均P<0.05,见图1)。

与T29比较,*P<0.05图1 正常卵巢细胞及卵巢癌细胞NNT-AS1表达水平对比Figure 1 Comparison of NNT-AS1 expression between normal ovarian cells and ovarian cancer cells
2.2 基因沉默的效果验证
转染72 h后,由qRT-PCR可见siNNT-AS1组HO-8910和SK-OV-3细胞系中的NNT-AS1相对表达量均显著低于siNC组和control组,差异均有统计学意义(均P<0.05),提示NNT-AS1基因沉默成功。
2.3 NNT-AS1对HO-8910、SK-OV-3细胞增殖的影响
由MTT实验可见,HO-8910细胞系、SK-OV-3细胞系转染siNNT-AS1后,其各时间点增殖活性均高于对应siNC组及control组,差异均有统计学意义(均P<0.05,见图2)。提示NNT-AS1表达下调可促进卵巢癌细胞HO-8910、SK-OV-3的增殖。

与同时间siNC组和control组比较,*P<0.05图2 NNT-AS1对卵巢癌细胞增殖的影响Figure 2 Effects of NNT-AS1 on proliferation of ovarian cancer cells
2.4 NNT-AS1对HO-8910、SK-OV-3细胞凋亡的影响
流式细胞术检测结果显示,HO-8910细胞系、SK-OV-3细胞系转染siNNT-AS1后,其细胞凋亡率均低于对应siNC组及control组,差异均有统计学意义(均P<0.05,见图3)。提示NNT-AS1表达下调可抑制卵巢癌细胞HO-8910、SK-OV-3的凋亡。
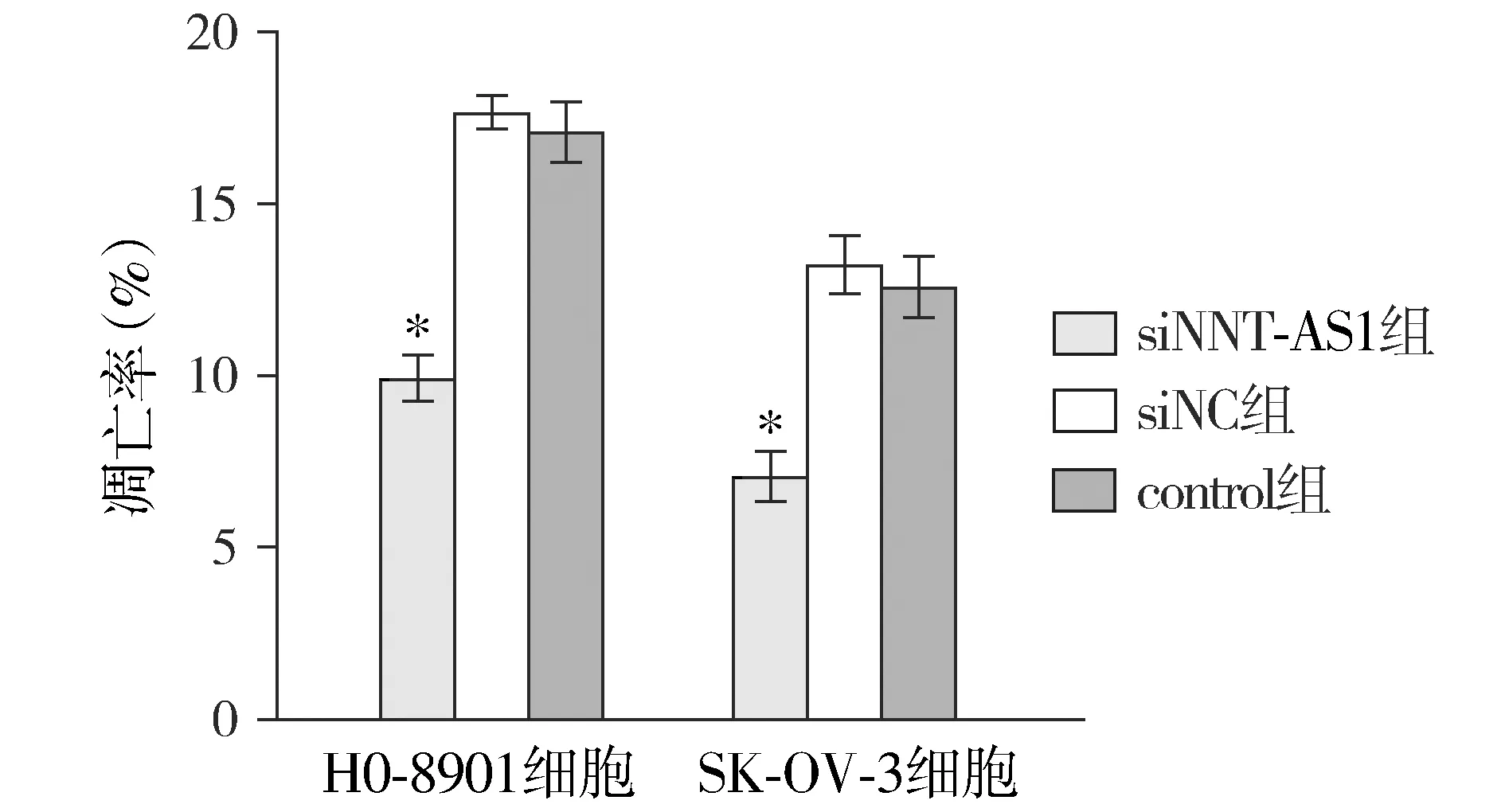
与siNC组及control组比较,*P<0.05图3 NNT-AS1对卵巢癌细胞凋亡的影响Figure 3 Effect of NNT-AS1 on apoptosis of ovarian cancer cells
2.5 NNT-AS1对HO-8910、SK-OV-3细胞侵袭的影响
Transwell结果表明,HO-8910细胞系、SK-OV-3细胞系转染siNNT-AS1后,细胞穿膜数均高于对应siNC组及control组,差异均有统计学意义(均P<0.05,见图4,5)。提示NNT-AS1表达下调可促进卵巢癌细胞HO-8910、SK-OV-3细胞的侵袭。
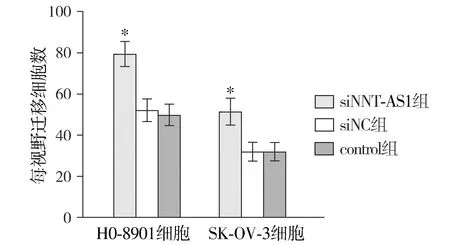
与siNC组及control组比较,*P<0.05图4 NNT-AS1对卵巢癌细胞侵袭的影响Figure 4 Effect of NNT-AS1 on invasion of ovarian cancer cells

图5 Transwell实验观察NNT-AS1对HO-8910、SK-OV-3细胞侵袭的影响结果Figure 5 Effect of NNT-AS1 on invasion of HO-8910 and SK-OV-3 cells by Transwell
2.6 NNT-AS1对卵巢癌细胞caspase-3、caspase-9活性的影响
对caspase-3、caspase-9活性进行检测发现,HO-8910细胞系、SK-OV-3细胞系转染siNNT-AS1后,其caspase-3、caspase-9活性均分别低于对应siNC组及control组,差异均有统计学意义(均P<0.05,见图6)。
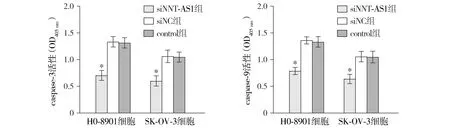
与siNC组及control组比较,*P<0.05图6 NNT-AS1对卵巢癌细胞caspase-3、caspase-9活性的影响Figure 6 Effects of NNT-AS1 on caspase-3 and caspase-9 activities in ovarian cancer cells
3 讨论
2011年Salmena等[13]提出了竞争性内源RNA的假说,指出非编码RNA可通过竞争miRNA反应元件来调节miRNA的功能。lncRNA作为竞争性内源RNA的一种,即可通过上述机制调控miRNA功能,发挥癌基因或抑癌基因的作用,并进一步参与肿瘤细胞的增殖、迁移、侵袭、凋亡和耐药等过程,在肿瘤的发生、发展中占重要作用[14,15]。因此,lncRNA可能作为肿瘤的早期诊断、治疗及预后判断的潜在靶向标记物。
目前针对lncRNA在卵巢癌内的作用机制研究较少,多集中在肺腺癌转移相关转录本1(关MALAT1)、Homeobox转录反义基因间RNA(HOTAIR义)、核富集转录体1(NEAT1体等lncRNA的研究中,针对NNT-AS1在卵巢癌内的作用机制研究较少[16,17]。NNT-AS1作为一类新鉴定出来的长链非编码RNA,最早被发现于结肠癌[11],随后在肝癌[18]、胃癌[19]、非小细胞性肺癌[8]、宫颈癌[7]、白血病[20]等肿瘤中被发现均有表达的异常升高,而在卵巢癌中的研究较少[21]。本研究中,采用卵巢浆液性囊腺癌细胞系HO-8910、人卵巢腺癌细胞系SK-OV-3进行研究,发现与正常卵巢细胞系T29相比,NNT-AS1表达下降。随后基因沉默NNT-AS1后,进一步对HO-8910、SK-OV-3卵巢癌细胞的增殖、凋亡、侵袭水平进行研究,发现NNT-AS1沉默后,可促进卵巢癌细胞HO-8910、SK-OV-3的增殖及侵袭并抑制其凋亡。Huang等[21]对卵巢癌细胞HO-8910、SK-OV-3进行NNT-AS1基因沉默后,也发现其增殖能力上升、凋亡下降,而且侵袭能力增加了60%-70%,与我们的研究结论一致;他们还对细胞的迁移能力和修复能力进行了研究,发现NNT-AS1基因沉默后卵巢癌细胞的迁移能力和修复能力均显著升高,结合我们的研究结果,进一步说明NNT-AS1在卵巢癌中可能发挥保护性作用。另外,我们通过对caspase-3、caspase-9活性的检测,发现其均呈下降趋势,提示NNT-AS1是通过抑制内源性途径进而实现对卵巢癌细胞凋亡的调控[12,22],NNT-AS1可能成为通过内源性途径生物治疗卵巢癌的潜在靶点。
分析NNT-AS1在卵巢癌细胞中与在消化系统肿瘤、肺癌甚至宫颈癌中表达情况不同的原因,以及在卵巢癌细胞中与MALAT1、HOTAIR、NEAT1等其他lncRNA表达升高情况也不同的原因,一方面可能是因为NNT-AS1在不同系统肿瘤中竞争抑制的miRNA或下游信号通路不同,如结直肠癌中NNT-AS1主要通过活化MARK/Erk信号参与肿瘤发生[11],而在肝癌或胃癌发展中则是通过miR-363/CDK6参与[18,23];另一方面是因为即使在卵巢癌细胞中不同lncRNA的作用机制不同所致[23]。由于有研究表明,在卵巢癌中,lncRNA ADAMTS9-AS2表达下调,且与卵巢癌细胞增殖、侵袭相关,该表达特点与NNT-AS1相似,而前者是通过miR-182-5p/FOXF2信号轴进而发挥对卵巢癌进展的抑制作用[24],因此,NNT-AS1是否通过某种miRNA对FOXF2或通过类似机制进而实现对卵巢癌的调控作用,有待进一步探索。
综上所述,卵巢癌HO-8910、SK-OV-3细胞增殖、侵袭增加及凋亡下降可能与NNT-AS1表达下降有关,对NNT-AS1进行检测或干预可能发挥预防或治疗卵巢癌的作用。然而,NNT-AS1在卵巢癌细胞中的具体作用仍需设计拯救实验,通过上调其表达进一步验证;另外,参与其作用过程的具体miRNA及信号通路也需进一步深入探索。
