基于TCGA数据库分析促癌基因GUCY1A2在胃癌中的表达及其对细胞增殖的影响
2020-11-06张新鑫朱梦琪韩亚娟贾建光
张新鑫,朱梦琪,王 辉,韩亚娟,贾建光*
(1蚌埠医学院第一附属医院肿瘤外科,蚌埠 233000;2蚌埠医学院第一附属医院肿瘤内科;*通讯作者,E-mail:jiajianguang1978@126.com)
胃癌是全球最常见的癌症之一,其在癌症中具有较高的发病率和死亡率[1]。仅在2018年,美国大约就有26 420例新发胃癌病例和10 800例胃癌死亡病例[2]。在中国的癌症患者中,消化道肿瘤仍然是导致癌症患者死亡的主要原因[3]。胃癌早期患者通常有很高的康复机会,但在许多情况下,直到晚期才诊断出胃癌,这是其5年生存率较低的原因[4]。因此,有必要寻找一种生物标志物,用它来对胃癌进行预防、治疗和预后评估。
可溶性α2鸟苷环化酶1(GUCY1A2)是一种异二聚体蛋白,催化三磷酸鸟苷(GTP)转化为3′,5′-环状鸟苷一磷酸(GMP)和焦磷酸。先前研究发现GUCY1A2基因相关的疾病包括关节炎[5]、心肌梗死和肺癌[6]。增殖是肿瘤中最常见的表型,在胃癌的发生发展过程中起到重要作用[7-9]。然而目前GUCY1A2基因在胃癌中的作用机制尚不清楚。因此,本研究基于TCGA数据库分析GUCY1A2基因在胃癌中的表达及其对细胞增殖的影响,进而为阐明GUCY1A2基因在胃癌进程中的作用提供一定的实验依据。
1 材料与方法
1.1 数据库分析
本研究通过TCGA官方数据库下载443例胃癌患者的临床信息和375例胃癌患者的基因表达数据。将下载的443例胃癌临床信息和375例表达谱数据利用perl软件和R语言软件整合将患者按表达量中位数分为高表达组和低表达组进行分析和绘图。并利用数据进行胃癌预后单因素及多因素分析。
1.2 细胞培养和主要试剂
正常胃黏膜细胞GES-1和胃癌细胞SGC-7901、AGS、MGC-803均购自中科院细胞研究所。RPMI-1640培养基、胰蛋白酶购自美国Hyclone公司,胎牛血清(FBS)、Materigel胶购自浙江天杭生物科技股份有限公司,siRNA、NC所用片段均购自上海吉玛基因有限公司,Lipofectamin2000由Thermo Scientific公司购买。一抗(GUCY1A2、Ki-67、GAPDH)均购买于Affinity公司,二抗购自武汉三鹰生物科技有限公司,Western blot试剂盒及BCA蛋白浓度测量试剂盒购自碧云天生物技术公司,四甲基偶氮唑盐(MTT)购自Biofroxx公司。
正常胃黏膜细胞GES-1和胃癌细胞SGC-7901、AGS、MGC-803均采用RPMI-1640培养基进行培养。培养基添加含10%胎牛血清、1%青霉素和链霉素。4种细胞均培养于37 ℃、5%CO2饱和湿度条件下的培养箱中。在细胞增殖至70%融合率时,即用0.25%胰酶进行消化传代,通常3-4 d传代1次。
1.3 细胞转染
取对数生长期的细胞进行转染,要求转染时细胞融合达到60%,严格按照Lip2000及基因片段说明书进行转染操作,实验分组为NC组(Lipofectamine®2000和NC所用片段序列)、siRNA组(Lipofectamine®2000和siRNA序列)。分别用10 μl Lip2000混合4 μg基因片段置入500 μl不含血清培养基静置20 min后加入培养皿,最终培养液终浓度为1 μg/L,6 h更换不含双抗仅含10%胎牛血清培养液,48 h进行后续实验。siRNA序列为5′-GGTGCGAATGCCACGTTATTG-3′。
1.4 免疫组化检测GUCY1A2蛋白
选取蚌埠医学院第一附属医院于2018年1月至2018年12月在外科手术的胃癌组织蜡块5例,进行切片制备、脱蜡、复水后对组织进行抗原修复,然后进行免疫反应,滴加一抗(1 ∶200),4 ℃冰箱孵育过夜。加二抗(1 ∶500),室温孵育1 h。DAB化学染色,苏木素复染。酒精梯度脱水,二甲苯透明,中性树脂封片。阳性染色结果判断:胞浆中的染色面积和棕黄色颗粒决定是否为阳性细胞。
1.5 细胞活力检测
MTT细胞增殖检测试剂盒检测细胞活力,取经过转染后的细胞,胰酶消化后用培养基重悬至5×104密度,充分混匀后按100 μl/孔接种于96孔板,每组4个复孔,放入培养箱中继续培养24,48,72 h。在相应的时间点每孔加入15 μl的MTT,继续孵育2 h,用酶标仪测定波长为490 nm时每孔细胞的吸光度OD值。
1.6 Western blot法检测GUCY1A2和Ki-67蛋白表达水平
使用RIPA细胞裂解液将细胞在冰上裂解30 min。在4 ℃条件下、14 000 r/min离心10 min,收集上清液。BCA法测量蛋白质浓度。SDS-PAGE凝胶分离蛋白质提取物,并转印到PVDF膜上。将膜在含有5%脱脂牛奶中封闭2 h,并分别与GUCY1A2(1 ∶1 000)、Ki-67(1 ∶1 000)、及GAPDH(1 ∶1 000)等一抗4 ℃孵育过夜,随后与兔二抗(1 ∶1 000)室温孵育2 h。用ECL显影液对条带进行显影。
1.7 统计学分析
所有试验重复3次,采用SPSS21.0统计软件对实验数据进行统计分析。实验数据均以均数±标准差表示,多组间比较采用单因素方差分析及两因素方差分析,组间两两比较则采用LSD-t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 TCGA数据库中的GUCY1A2的表达量
通过TCGA数据分析,结果显示非配对样本与正常组织相比,GUCY1A2的表达量表达明显增加,差异有统计学意义(P<0.05,见图1)。而在32对配对样本中与癌旁组织相比,GUCY1A2的表达量表达明显增加,差异有统计学意义(P<0.05,见图1)。

与正常组织相比,*P<0.05图1 TCGA数据库分析GUCY1A在癌旁组织与癌组织中的表达量Figure 1 Expression of GUCY1A in adjacent and cancerous tissues in TCGA database
2.2 GUCY1A2基因蛋白表达与胃癌患者预后的关系
通过对GUCY1A2在胃癌中的表达进行K-M生存分析,胃癌组织中GUCY1A2高表达患者生存率显著高于GUCY1A2低表达患者生存率(P<0.05,见图2)。
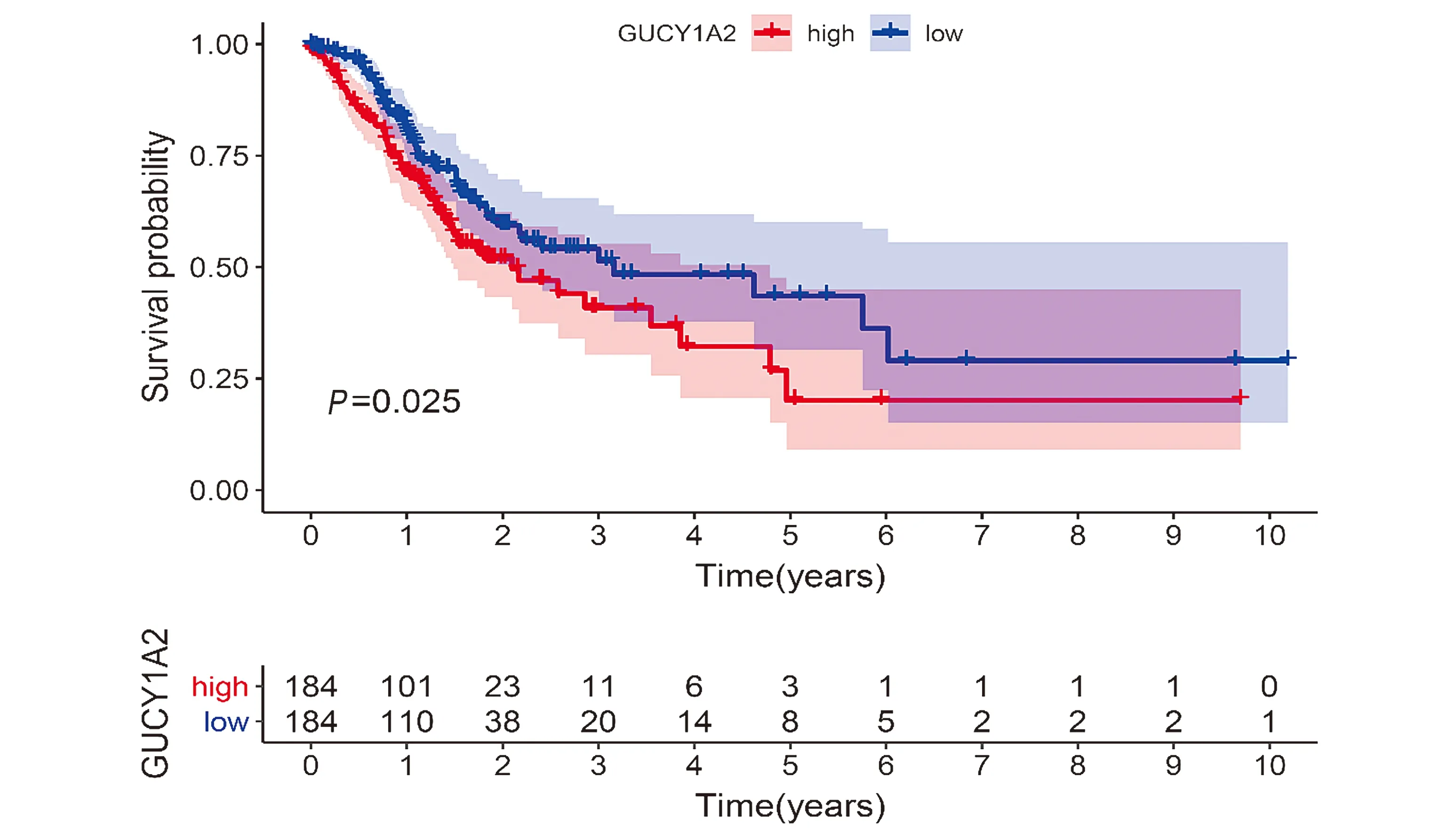
图2 胃癌患者GUCY1A2高表达组与GUCY1A2低表达组生存率比较Figure 2 Comparison of survival rate between GUCY1A2 high expression group and GUCY1A2 low expression group in gastric cancer patients
2.3 胃癌预后单因素及多因素分析
采用Cox比例风险模型分析后,单因素结果显示,GUCY1A2高表达、年龄大、临床分期高、TNM分期高是影响胃癌预后的危险因素。多因素分析显示,GUCY1A2高表达、年龄大、男性是影响胃癌预后的独立因素(见表1)。
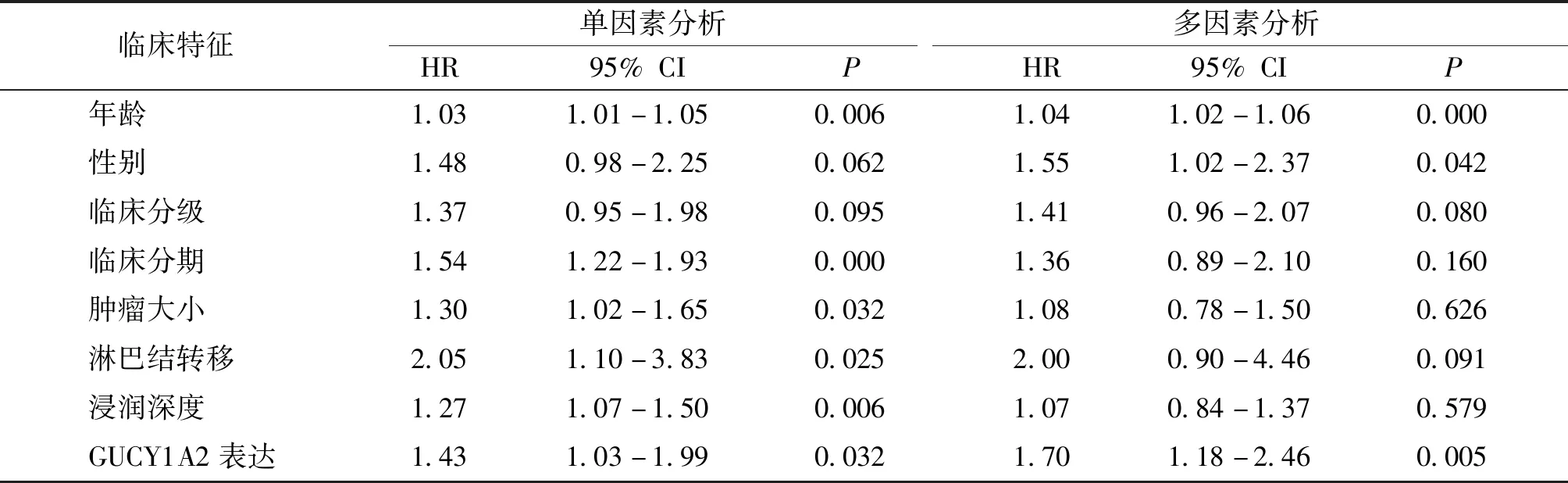
表1 GUCY1A2表达以及临床特征对胃癌患者生存率的影响
2.4 GUCY1A2在胃癌组织中高表达
为探究GUCY1A2在胃癌中的表达情况,对胃癌组织及癌旁组织进行免疫组化。同时对免疫组化镜下观察结果。结果显示,胃癌组织中GUCY1A2阳性表达呈棕色或棕褐色,GUCY1A2蛋白在癌组织中阳性表达明显高于癌旁组织(见图3)。
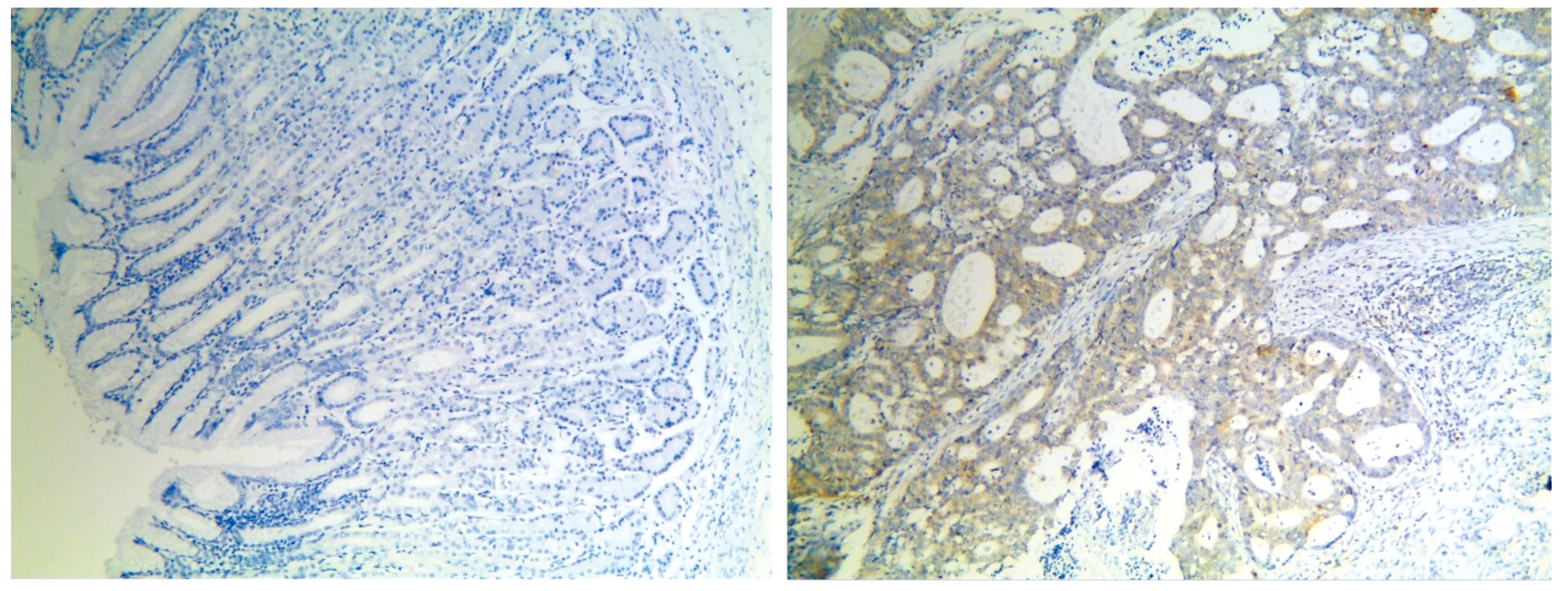
A.癌旁组织 B.癌组织图3 GUCY1A2在胃癌组织中高表达 (×200)Figure 3 GUCY1A2 is highly expressed in gastric cancer tissues (×200)
2.5 GUCY1A2在胃癌细胞内的表达
Western blot实验结果表明,与正常胃黏膜细胞相比,胃癌细胞中SGC-7901、AGS、MGC-803的GUCY1A2表达明显增加,差异有统计学意义(P<0.05,见图4)。由于SGC-7901细胞和AGS细胞中GUCY1A2表达升高最显著,因此选择SGC-7901细胞株和AGS细胞株作为研究对象进行后续研究。
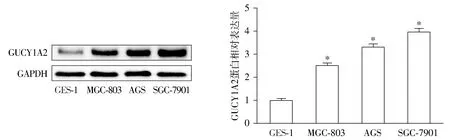
与GES-1细胞相比,*P<0.05图4 GUCY1A2在正常人胃黏膜细胞和胃癌细胞中的表达Figure 4 Expression of GUCY1A2 in normal human gastric mucosa cells and gastric cancer cells
2.6 Western blot检测转染后GUCY1A2表达水平
Western blot结果显示,胃癌细胞株SGC-7901和胃癌细胞株AGS转染后,siRNA组的GUCY1A2蛋白表达量,与NC对照组相比显著下降,差异有统计学意义(P<0.05,见图5)。因此转染沉默GUCY1A表达水平是有效的。

与NC组比较,*P<0.05图5 siRNA转染48 h后胃癌株SGC-7901和AGS细胞中GUCY1A2的表达水平Figure 5 Expression of GUCY1A2 in SGC-7901 cells and AGS cells at 48 h after transfection with siRNA
2.7 MTT检测转染后胃癌细胞增殖作用
MTT结果显示,胃癌细胞SGC-7901和AGS沉默GUCY1A2的表达水平后显著抑制了胃癌细胞的生长速度及细胞活性,于培养48 h和72 h时各沉默组与对照组比较,差异有统计学意义(P<0.05,见图6)。说明GUCY1A2表达下降可以显著抑制胃癌细胞SGC-7901和AGS的体外增殖能力。

与NC组比较,*P<0.05图6 胃癌细胞SGC-7901和AGS沉默GUCY1A2后的细胞增殖Figure 6 Cell proliferation of gastric cancer cells SGC-7901 and AGS after silencing GUCY1A2
2.8 GUCY1A2对胃癌细胞内增殖指标Ki-67的影响
Western blot实验结果显示,沉默GUCY1A2表达量后,与NC对照组比较,siRNA组Ki-67蛋白水平显著下降(P<0.05,见图7)。说明GUCY1A2表达下降可以显著抑制胃癌细胞SGC-7901和AGS的体外增殖能力。

与NC组比较,*P<0.05图7 沉默GUCY1A2对增殖标志物Ki-67的影响Figure 7 The effect of silencing GUCY1A2 on proliferation marker Ki-67 in SGC-7901 and AGS cells
3 讨论
胃癌是最常见的恶性肿瘤,是世界范围内最常见的癌症死亡原因之一。胃癌患者通常只在晚期出现症状。然而,大多数患者直到出现症状才得到医疗关注。在最终诊断时,许多胃癌患者由于处于疾病的晚期,治疗效果较差。目前,胃癌的诊断依赖于胃镜检查和病理评估,需要对患者进行侵袭性的程序。然而,在一些患者中,即使这种方法也可能无法明确诊断。因此,研究发现一个生物学标志物具有重要的意义。近年来,在子宫内膜癌[10]和肺腺癌[11]中不断发现生物标志物。胃癌的发展是一个多因素的过程,它经历了许多不同的阶段,每个阶段都受到蛋白编码基因和非编码基因的遗传和表观遗传的调节[12],如DNA水平[13]、mRNA水平[14]、微小RNA小分子(miRNAs)[15]及蛋白的表达改变[16]均可影响胃癌的进展。近年来随着高通量测序及基因芯片技术的发展,越来越多的癌症潜在基因治疗靶点被研究发现[17,18],这也为诊断和治疗胃癌提供了一个新的方向。
GUCY1A2基因编码的蛋白质是复合物的一个亚基,它与亚基相互作用形成被一氧化氮激活的鸟苷酸环化酶。该基因已发现编码不同亚型的两个转录变种。然而,目前关于GUCY1A2基因的功能作用尚无相关报道,尤其GUCY1A2基因在胃癌中的功能机制未见任何研究。本研究分析TCGA数据库临床信息和基因表达数据,发现正常胃组织中GUCY1A2的表达情况明显低于癌组织中的表达,并且通过K-M分析显示胃癌组织中GUCY1A2高表达患者生存率显著低于GUCY1A2低表达患者生存率。同时,通过多因素分析,GUCY1A2高表达、年龄大、男性与胃癌患者预后有明显的相关性。因此,我们得出GUCY1A2基因可能与胃癌的预后相关。随后我们通过免疫组化检测癌组织的表达水平,发现GUCY1A2在癌组织中的表达量明显高于癌旁组织。Western blot实验发现GUCY1A2基因与正常胃黏膜细胞相比,在胃癌细胞系中表达量上升。以胃癌细胞SGC-7901和AGS为实验对象,沉默GUCY1A2表达水平通过MTT实验发现其显著抑制细胞增殖能力。同时利用Western blot实验检测增殖标志物Ki-67表达量,发现沉默GUCY1A2后,Ki-67蛋白水平显著下降。因此我们认为GUCY1A2的表达降低能够明显抑制细胞增殖。
综上所述,本研究证明GUCY1A2基因在胃癌中是促癌基因,研究讨论并证实了沉默GUCY1A2能够抑制胃癌细胞株SGC-7901和AGS细胞的增殖能力,这提示GUCY1A2能对胃癌细胞增殖起到重要作用,或许可以作为胃癌临床治疗的一个重要靶标。
